中国人群与西方人群黑色素瘤疾病特征存在差异。完全按照西方人群获益的方案来进行诊治并不适合中国患者。目前临床常用的治疗方案是BRAF抑制剂为代表的靶向治疗和以PD-1抗体为代表的免疫治疗。本文将分享1例Ⅳ期恶性黑色素瘤多发转移,BRAF V600E突变阳性的患者,接受维莫非尼与PD-1抗体联合治疗,并有效控制多发转移灶的案例。

广东省抗癌协会黑色素瘤专业委员会委员及秘书
广东省抗癌协会肉瘤素瘤专业委员会委员及秘书
广东省抗癌协会生物治疗专业委会委员
广东省抗癌协会癌症康复与姑息治疗专业委员会委员
广东省健康管理学会肿瘤防治专业委员会委员
病例简介:
患者女性,40岁。2012年3月因“右颈皮肤先天性黑痣增大伴瘙痒半年”在当地医院行“右颈部黑痣切除术”,当时病理:色素痣。2013年7月出现右颈部淋巴结肿大,当地医院行“右颈淋巴结切除活检”,病理考虑为:淋巴结转移性黑色素瘤。再次复合原右颈部黑痣病理,考虑为黑色素瘤。否认肝炎、结核等传染病史。无心脏病、高血压、糖尿病史。
手术治疗:
1.复发后第一次手术:2013年于我院就诊,完善影像检查未见远处转移。2013年10月行 “右颈淋巴结清扫术”,术后病理示:(右颈1区淋巴结)1/7见恶性黑色素瘤转移。患者确诊为“右颈皮肤黑色素瘤,pTxN2bM0 ⅢB/ⅢC 期”。术后行大剂量干扰素辅助治疗1年。
2.复发后第二次手术:2016年5月出现右颈皮下肿物及左颈淋巴结肿大,2016年6月行“左上半颈淋巴结清扫术+右颈皮下肿物切除术”。术后病理示:(右颈皮下结节)恶性黑色素瘤;左颈淋巴结未见肿瘤。术后定期复查。
3.复发后第三次手术:2017年10月复查CT发现右乳外上象限结节及右腋窝肿大淋巴结。2017-11-15行 “右腋窝淋巴结清扫+右乳肿物切除术”,术后病理:(腋窝淋巴结)2/21见恶性黑色素瘤转移:(右乳腺结节)恶性黑色素瘤。术后予大剂量干扰素辅助治疗半年。完善分子诊断:B-raf第15号外显子V600E突变检测阳性。
4.第四次复发:2018年7月复查CT发现双多发肺转移。诊断:复发型多发转移(多发远处淋巴结,乳腺,肺部)黑色素瘤,pTxN3M1 Ⅳ期
系统性治疗:
1.2018-07-15至2018-09-28维莫非尼治疗,疗效达到PR
1)2018-07-15开始口服维莫非尼960 mg BID,主要副反应为间断发热、皮疹、肌肉关节痛等,可耐受。
2)2018-8-13复查CT:双肺病灶缩小,脾脏出现多发新病灶。建议继续口服维莫非尼治疗1个月后复查。
3)2018-09-21复查CT:原双肺内多发转移瘤,较前眀显缩小、减少,大部分已未见眀确显示。脾内病灶较前明显缩小、减少。疗效PR,建议联合免疫治疗。
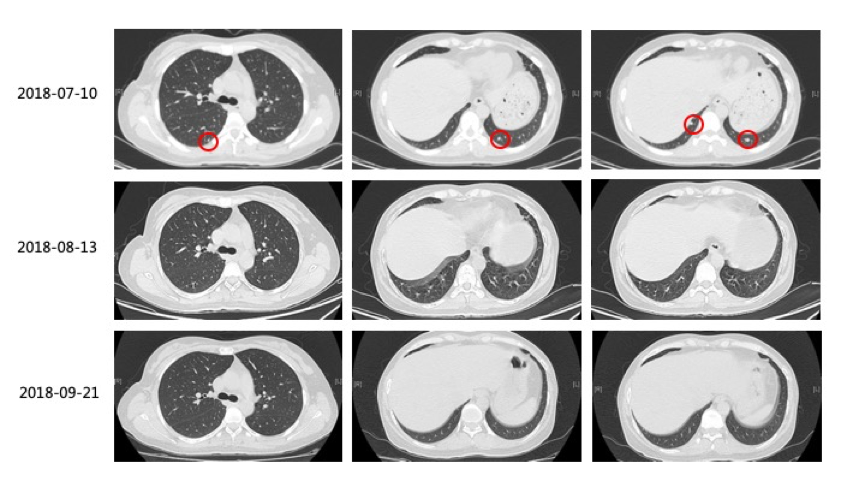
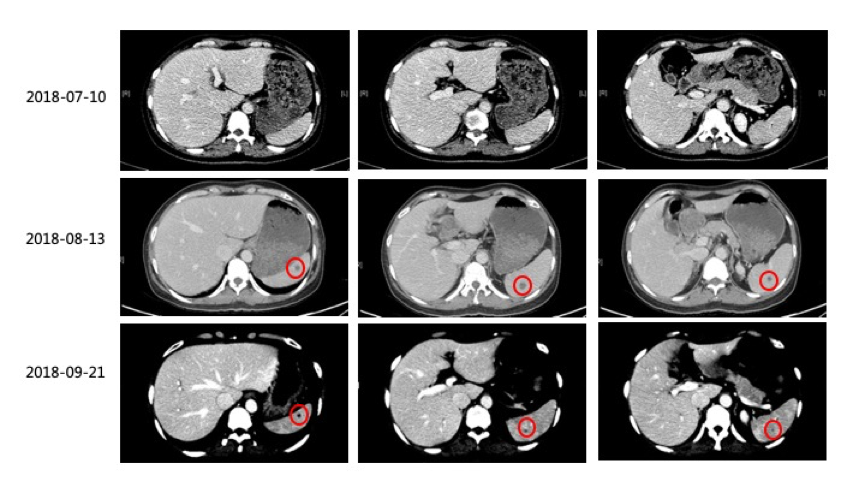
(图1:维莫非尼治疗3周期后,原双肺内多发转移瘤较前眀显缩小、减少,脾内病灶较前明显缩小、减少;疗效评估为PR)
2.2018-09-28至2019-03-17免疫检查点抑制剂联合维莫非尼,最佳疗效达到CR
1)2018-09-29至2018-11-12予帕博利珠单抗(PD-1抑制剂)100mg治疗3疗程,同期口服维莫非尼720 mg BID,可耐受。
2)2018-11-16复查CT示:原双肺内多发转移瘤未见显示,脾内病灶较前缩小,减少。疗效持续PR。患者继续口服维莫非尼并联合帕博利珠单抗治疗,期间出现Ⅱ度甲状腺功能减退,及虹膜睫状体炎,考虑为免疫相关副作用,予“甲状腺素片”替代治疗及“布林佐胺滴眼液、马来酸噻吗洛尔滴眼液”等对症治疗后控制良好。
3)2019-03-14复査CT提示原各病灶未见明确显示,临床疗效达CR。建议维莫非尼减量逐渐停药,PD-1抗体维持治疗。
3.2019-03-30至2019-05-30维莫非尼减量服用至停药,免疫检查点抑制剂维持治疗5周期:疗效评估PD
1)2019-03-18至2019-7-25继续行帕博利珠单抗100 mg Q3w治疗。
2)2019-03-30起维莫非尼减量至480 mgBID口服至2019年5月底停药。
3)2019-07-25复查CT示:右侧腋窝皮下脂肪间隙新发结节,直径约8 mm,考虑转移瘤。双肺散在多发数个小结节,较大约直径约7 mm,较前新发,考虑转移瘤可能性大。患者出现新病灶,疗效评价为PD。联合治疗阶段累积免疫帕博利珠单抗治疗8周期、维莫非尼8个月。
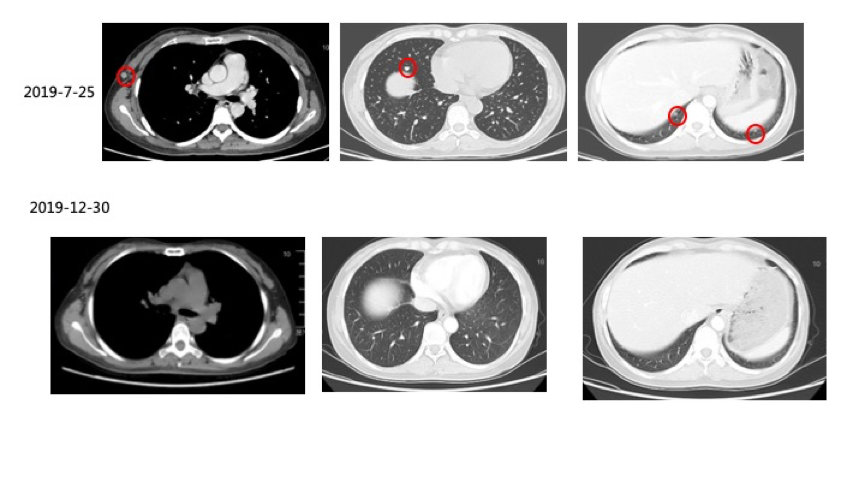
(图2:维莫非尼停药2个月后复查CT显示,右侧腋窝皮下脂肪间隙新发结节、双肺散在多发转移瘤,疗效评估PD)
4.疾病进展后再次开始维莫非尼免疫检查点抑制剂,疗效评估PR
1)2019-07-26起恢复维莫非尼治疗。720 mg BID剂量,并继续帕博利珠单抗100 mg Q3w治疗,恢复维莫非尼服药后患者体表病灶渐缩小。
2)2019-09-26复查CT:右侧腋窝皮下脂肪间隙结节,考虑转移瘤,较前缩小。原双肺散在小结节,较前缩小,现已不明显。
3)2019-12-30复查CT:右侧腋窝皮下脂肪间隙结节较前继续缩小;双肺结节消失。
4)联合方案维持治疗,并定期复查。
病例总结
患者中年女性,诊断为多发转移型恶性黑色素瘤,分子诊断显示BRAF V600E突变阳性。该患者病程较长。在手术切除复发病灶以及大剂量干扰素治疗2周期后,患者出现颈部以及肺内多发转移病灶。患者接受维莫非尼8个月与PD-1抗体的联合治疗8周期以后达到临床CR,但是患者在维莫非尼停药2个月后出现肺内新发转移病灶,评价为PD。随后,再次开始维莫非尼联合PD-1抗体维持治疗:疗效达到PR并继续维持。
专家点评

中山大学附属肿瘤医院生物治疗中心副主任
中山大学附属肿瘤医院黑色素瘤单病种首席专家
中国临床肿瘤学会CSCO黑色素瘤专业委员会副主任委员
广东省医院协会肿瘤防治分会副主任委员和肿瘤免疫治疗专委会主任委员
中国临床肿瘤协会黑色素瘤专委会委员
本例患者选择维莫非尼与PD-1单抗联合治疗,有望延缓耐药性、维持疗效
该例恶性黑色素瘤患者的特征在于BRAF V600E突变阳性、且病程较长。在当前这例病例中,BRAF抑制剂对于肿瘤的控制起到了主要的作用。BRAF是黑色素瘤的重要驱动基因,也是黑色素瘤患者的独立预后因素。经过长期的维莫非尼与PD-1单抗联合治疗,患者的多发转移病灶得到了有效的控制。需要指出的是,目前对于BRAF突变的患者应接受靶向治疗还是免疫治疗,抑或是靶向联合免疫的治疗目前临床研究仍在进一步的探索中。
本例患者采用BRAF抑制剂联合PD-1单抗的方案进行治疗,旨在结合两种治疗药物各自的优势,而后根据国际指南,在达到最大疗效后慢慢停用靶向药物,用PD-1单抗维持治疗。
通过整个治疗过程我们可以发现,靶向联合免疫的方案达到了很好的治疗效果,最佳疗效达到CR。但是一旦撤去靶向药物,患者黑色素瘤出现复发,而在复发后再次加上靶向药物,病情再次得到控制。因此提示在整个治疗过程中,主要依靠靶向药物在控制肿瘤,而PD-1单抗发挥的价值相对较弱,其主要作用在于延长耐药。
从这例患者的经验来看,国际指南中要求达到最大疗效后的转化治疗策略可能对于国内患者并不一定适用。此外,这例病例也从侧面再次反映出,对于中国的黑色素瘤患者而言,PD-1单抗的有效性或许与西方患者相比同样存在差异,而这也需要进一步的前瞻性随机对照研究进行确认。因此,在国内黑色素瘤的临床实际诊疗中,我们应慎重对待西方经验,切勿盲目照搬。
综上所述,BRAF抑制剂能够显著延长BRAF突变型恶性黑色素瘤的客观缓解率以及患者的生存获益。目前对于BRAF抑制剂联合PD-1抑制剂的治疗模式还处于研究阶段,尚无定论。此例患者在维莫非尼、PD-1抑制剂的同期联合治疗下,能够长期维持PR,说明这是非常值得探索的领域。期待后续靶向和免疫联合治疗的更多尝试,能打破恶性黑色素瘤治疗传统布局、带来一次又一次的惊喜。
1. Flaherty KT, Puzanov I, Kim KB et al. Inhibition of Mutated, Activated BRAF in Metastatic Melanoma. New England Journal of Medicine 2010; 363(9):809–819.
2. Chapman PB, Hauschild A, Robert C et al. Improved Survival with Vemurafenib in Melanoma with BRAF V600E Mutation. New England Journal of Medicine 2011; 364(26):2507–2516.
3. McArthur GA, Chapman PB, Robert C et al. Safety and efficacy of vemurafenib in BRAF(V600E) and BRAF(V600K) mutation-positive melanoma (BRIM-3): extended follow-up of a phase 3, randomised, open-label study. Lancet Oncol. 2014; 15(3):323–332.
排版编辑:Mice















 苏公网安备32059002004080号
苏公网安备32059002004080号


