本文着重梳理2018年度出现的结直肠癌领域比较重要的治疗进展,即已经或即将改变临床实践的新进展,详见如下5大方面。

主任医师,中山大学附属肿瘤医院结直肠科副主任
中国临床肿瘤学会(CSCO)副秘书长、常务理事;
2015-2017年ASCO学术委员会委员;
CSCO青年专家委员会第一届主任委员;
中国抗癌协会大肠癌专业委员会委员;
CSCO结直肠癌专委会常委;
CSCO结直肠癌指南专家组秘书、执笔人;
CSCO全国胃肠道间质瘤专家委员会委员、胃肠胰神经内分泌肿瘤专家委员会委员;
中国医师协会结直肠外科医师分会常务委员;
广东省大肠癌专业委员会常委;
1.局部进展期直肠癌术前治疗策略进展
局部进展期直肠癌(locally advanced rectal cancer,LARC)的治疗,进入肿瘤学效果和功能并重的时代,传统“三明治”治疗模式[术前放化疗-全直肠系膜切除术(total mesorectal excision,TME)-术后辅助化疗]的利弊凸显,众多模式涌现,其中一个重要方向就是强化术前治疗策略,获取更高的肿瘤退缩率,从而改变原有的手术模式,保全器官功能,乃至改善生存,在过去的2018年,如下两个方面的进展值得关注,或许已经在改变临床实践。
1.1 奥沙利铂的价值
1.1.1 术前CRT中使用 口服卡培他滨或持续静脉输注小剂量5-FU是目前适形放射治疗(conformal radio therapy,CRT)模式中的标准化疗类型。为了提高疗效,业界尝试很多新型化疗模式,在CRT中加入奥沙利铂、伊立替康以及靶向药物西妥昔单抗或贝伐单抗(Bevacizumab,Bev),靶向药物的尝试均以失败而告终,研究得最多的,是在术前CRT中加入奥沙利铂。
迄今已经报道的全球大型Ⅲ期研究一共有6个:ACCORD-12,STAR-01,R-04,CAO/ARO/AIO-04,PETACC-6和中国的FOWARC研究。相关数据见表1。从改善生存的角度看,仅有德国的AIO-04研究是阳性的,但目前并没有改变临床实践。2018年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)年会,PETACC-6和FOWARC研究进行了生存数据更新,均为阴性结果,即奥沙利铂的加入未能改善生存。但从肿瘤退缩[即病理完全缓解(pathological complete response,pCR)]的角度看,AIO-04研究(17%对13%)、FOWARC研究为阳性研究(29%对13%),ACCORD-12为边界阳性(19%对14%)。而从肿瘤退缩分级(tumor regression grade,TRG)0/1级(即包括显著缓解和完全缓解)的指标看,ACCORD-12研究(39.4%对28.9%,P=0.008)与FOWARC研究(68.8%对48.4%)均为阳性。 从这些研究的结果看,奥沙利铂的加入在某种程度上加大了肿瘤退缩程度。尤其是中国FOWARC研究,pCR率和显著TRG率均达新高。仔细分析中国研究和其他国际研究的不同之处发现,国际研究的奥沙利铂使用方法是完全按照“放疗增敏剂”的模式来使用的,一般是50~60 mg/(m2·w),与放疗同步使用5周,而这个剂量强度和全身化疗是完全不同的。反观FOWARC研究,是将奥沙利铂以标准的全身化疗模式mFOLFOX6与放疗同步,剂量为85 mg/(m2·2w)。无独有偶,笔者所在单位自2004年以来一直采用全身化疗模式的CAPEOX与放疗同步进行CRT,奥沙利铂剂量130 mg/(m2·3w)(70岁以上减为100 mg),卡培他滨1000 mg/(m2·d),d1~14,每3周重复——在为期5周的放疗期间,刚好化疗2个周期。分析2010~2017年共728例资料完整的LARC病例(结果尚未正式发表),其中卡培他滨单药同步CRT组192例,CAPEOX同步CRT组536例,结果显示pCR从17.7%提高到30.8%,P<0.001;TRG 0/1从40.1%提高到61.4%,P<0.001。而且,我们的结果也提示获得pCR者OS显著延长。
从这些研究的结果看,奥沙利铂的加入在某种程度上加大了肿瘤退缩程度。尤其是中国FOWARC研究,pCR率和显著TRG率均达新高。仔细分析中国研究和其他国际研究的不同之处发现,国际研究的奥沙利铂使用方法是完全按照“放疗增敏剂”的模式来使用的,一般是50~60 mg/(m2·w),与放疗同步使用5周,而这个剂量强度和全身化疗是完全不同的。反观FOWARC研究,是将奥沙利铂以标准的全身化疗模式mFOLFOX6与放疗同步,剂量为85 mg/(m2·2w)。无独有偶,笔者所在单位自2004年以来一直采用全身化疗模式的CAPEOX与放疗同步进行CRT,奥沙利铂剂量130 mg/(m2·3w)(70岁以上减为100 mg),卡培他滨1000 mg/(m2·d),d1~14,每3周重复——在为期5周的放疗期间,刚好化疗2个周期。分析2010~2017年共728例资料完整的LARC病例(结果尚未正式发表),其中卡培他滨单药同步CRT组192例,CAPEOX同步CRT组536例,结果显示pCR从17.7%提高到30.8%,P<0.001;TRG 0/1从40.1%提高到61.4%,P<0.001。而且,我们的结果也提示获得pCR者OS显著延长。
将中山大学肿瘤医院的数据和FOWARC研究的数据结合起来分析(我中心并未参与FOWARC研究),两个完全独立的数据显示在中国患者群体中,含有奥沙利铂的标准全身化疗与放疗同步的模式能够显著提高肿瘤退缩和pCR率,而关于国际学界担心的耐受性问题,似乎在中国患者中不是问题。FOWARC研究中mFOLFOX6同步CRT组放疗完成率90%,术前化疗完成率94%,较标准FU单药同步CRT组均无降低,并有数值上的优势。我们中心的资料显示能完成计划性CAPEOX同步CRT的患者比率高达96%以上。
总之,尽管国际上目前不主张CRT中加入奥沙利铂,但笔者的观点是不能一概否定其价值,如果我们治疗的目标是最大限度的肿瘤退缩以达到保全括约肌功能时,值得重新审视奥沙利铂的价值。此时应该把奥沙利铂当做标准全身化疗模式而不是放疗增敏剂的模式来使用,这样一个使用方式的调整,是不是导致肿瘤退缩显著增加的主要原因呢?笔者觉得非常值得进一步研究。目前中山大学肿瘤医院正在进行一项大型Ⅲ期随机对照试验来验证该模式的效率(NCT02031939)。
1.1.2 术后辅助化疗中使用 关于CRT+TME手术后辅助化疗的随机对照研究甚少。来自韩国的ADORE研究第一个开展CRT后辅助化疗中奥沙利铂价值的随机对照研究,2018年ASCO年会报道了最终随访的生存数据[8]。321例接受了氟尿嘧啶单药增敏CRT以及TME手术,术后病理分期为ypⅡ/Ⅲ期的LARC患者,随机分组接受术后辅助化疗5-FU/LV(Mayo方案)对比FOLFOX4,经过中位74个月随访后,发现奥沙利铂加入术后辅助化疗可显著改善生存:6年无病生存期(disease-free survival,DFS)从56.8%提高到68.2%,HR=0.63,P=0.01;ypⅢ期患者获益更大[HR=0.59(95%CI:0.38~0.92),P=0.019]。6年总生存(overall survival,OS)总体无获益,从76.4%延长至78.1%[HR=0.73(95%CI:0.45~1.19),P=0.21],亚组分析显示ypN2[HR=0.42(95%CI:0.18~0.96),P=0.04]或肿瘤退缩不明显[HR=0.42(95%CI:0.19~0.97),P=0.043]的患者OS获益明显。
ADORE研究结果体现了LARC术后辅助化疗中奥沙利铂的价值与结肠癌中有类似趋势:总体能获益,肿瘤退缩欠佳、预后越差的患者,获益越大。因此,在我个人的临床实践中,对于CRT后未达到pCR的患者,推荐使用含奥沙利铂的辅助化疗。
1.2 以“观察等待”为核心的TNT策略 基于肿瘤完全消退,即临床完全缓解(clinical complete response,cCR)后的观察等待(Watch&Wait,W&W)策略,毫无疑问是近些年关于LARC患者器官功能保全研究最热门的话题。从最早2004年巴西学者Habr-Gama教授的数据,到最近国际观察与等待数据库的内容[9],越来越多数据表明,对于经过严格评估达到cCR的直肠癌患者,W&W是一种可行、安全的处理方法,这种非手术治疗模式是保全患者直肠括约肌功能、膀胱功能及性功能的最佳策略,但这也面临着不少问题:首先,目前的治疗模式,LARC中能达到cCR的患者比例还是过低(20%左右);其次,需要在观察等待过程中进行主动、密切地监测随访,需要很好的患者依从性,一旦发现“肿瘤再生长”,给予积极挽救性干预;最后,治疗前很难准确预测哪些患者能达到cCR,因此,业界将这种完全缓解称之为“机会性完全缓解”。
W&W策略的核心和难点在于如何准确判断cCR乃至pCR。目前cCR判断的四大标准:肛门指诊、内窥镜、活检及MRI,其中,临床医生的肛门指诊对于判断肠壁病灶是最重要的,而动态的MRI则可对肠壁原发灶和系膜淋巴结判断提供更加有用的信息。对于这部分患者,cCR后给予W&W已经是一种可以推荐的治疗模式,也写入了2017年的ESMO直肠癌指南,但临床实践中需要详细告知患者并作出决策。
总之,对于LARC术前治疗后出现“机会性”肿瘤完全缓解的患者,当有功能保全的考量时,临床医生应该知道W&W是一种选择。那么,如何增加肿瘤cCR的机会呢?
“三明治”模式在近10年的演变过程中,变化最大的就是逐渐延长的手术等待间歇期(从CRT结束到TME手术的间期),在逐渐延长的间歇期内,可以给予更多的全身化疗,将辅助化疗模式前移到手术之前变为新辅助化疗(neoadjuvant chemotherapy,NeoCT)模式,将TME手术变为LARC治疗模式中的最后一个环节,这就是全程新辅助治疗(total neoadjuvant therapy,TNT)的理念雏形。根据全身化疗与放化疗/放疗的顺序,TNT模式又可以分为两种:NeoCT-CRT/SCPRT-TME,或CRT/SCPRT-NeoCT-TME(图1)。不管哪一种模式,TNT策略期望达到的潜在优势都是一致的:提高全身化疗依从性和完成率,由于间隔时间延长和间歇期化疗的双重作用,可增加肿瘤缓解程度,提高保肛率或让更多患者可以接受非手术治疗的W&W策略,最终延长生存。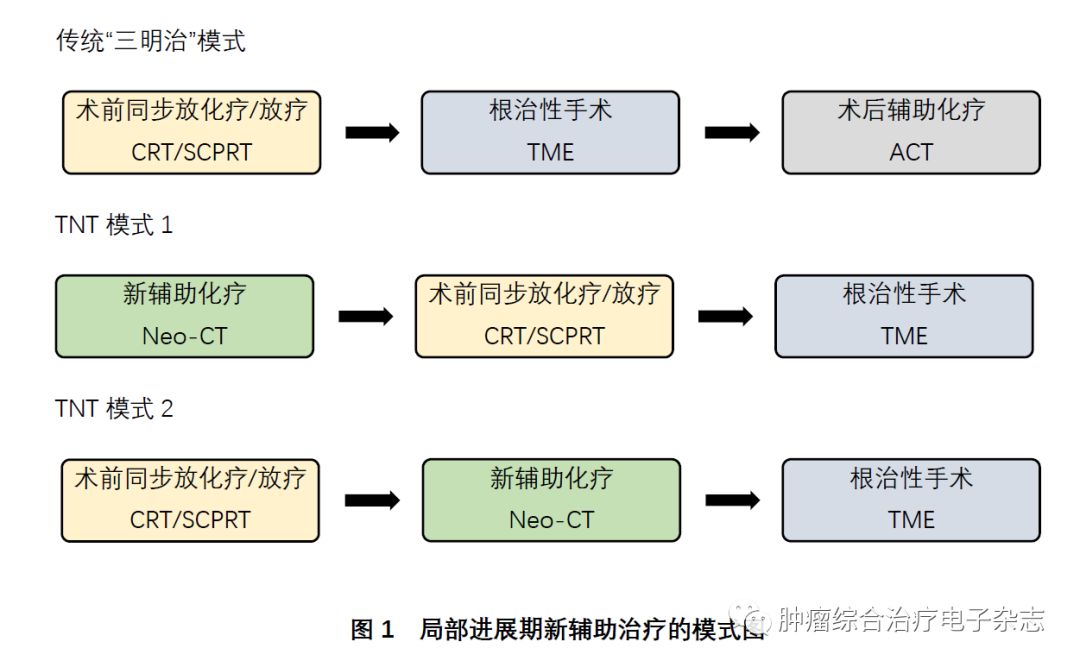 2018年美国纪念斯隆·凯特琳癌症中心报道的628例回顾性大宗病例对比分析,是TNT模式1的经典代表[10]。308例TNT组患者先行8程FOLFOX方案或5程CAPOX方案化疗,再行放化疗的模式(NeoCT-CRT-TME),320例接受常规的治疗模式(CRT-TME-ACT)。TNT组全身化疗依从性显著提高,出现了更多CR,这使得21.8%的患者因此而没有接受手术治疗,并且在CRT结束12个月时依然处于无瘤状态,但对照组常规CRT模式里,该比例仅为5.9%。尽管这种TNT治疗模式并没最终带来生存获益,但意外的发现就是该模式能让更多患者由于肿瘤完全缓解而接受W&W策略,从而保全器官功能。
2018年美国纪念斯隆·凯特琳癌症中心报道的628例回顾性大宗病例对比分析,是TNT模式1的经典代表[10]。308例TNT组患者先行8程FOLFOX方案或5程CAPOX方案化疗,再行放化疗的模式(NeoCT-CRT-TME),320例接受常规的治疗模式(CRT-TME-ACT)。TNT组全身化疗依从性显著提高,出现了更多CR,这使得21.8%的患者因此而没有接受手术治疗,并且在CRT结束12个月时依然处于无瘤状态,但对照组常规CRT模式里,该比例仅为5.9%。尽管这种TNT治疗模式并没最终带来生存获益,但意外的发现就是该模式能让更多患者由于肿瘤完全缓解而接受W&W策略,从而保全器官功能。
放化疗后肿瘤的退缩程度取决于肿瘤本身内在对射线和化疗药物的敏感性、放疗的剂量、化疗的强度以及治疗结束至复查的时间,其中放疗结束至复查的间隔时间尤为重要。这就是TNT模式2的基本理念,经典研究包括正在进行的欧洲RAPIDO和中国Stellar研究,试验组均采用了先长程放化疗或短程放疗后增加间隔期化疗的TNT策略。对于接受CRT者来说,该模式很好地利用了放化疗结束后6~8周的等候期,可以节约时间,比较符合患者的治疗意愿。而对于采用短程放疗模式的患者来说,要想获得更多的肿瘤退缩,TNT模式是必须的,因为传统的5X5 RT结束后1周立即手术,几乎没有肿瘤退缩和pCR。
由此可见,以强化术前全身化疗、延长手术等候间隔为标志的TNT模式,是目前LARC术前治疗策略中能带来最大程度肿瘤退缩的治疗模式,为器官功能保全提供了肿瘤学基础。就笔者个人目前的临床实践而言,那些如果按照计划进行手术就会面临肛门括约肌功能丧失或极大损伤的低位直肠癌,且在前期的CRT治疗后肿瘤退缩明显,有cCR趋势者,我会积极践行TNT模式治疗,以期达到cCR,然后采用W&W策略来最大程度保全功能。其他情形下则不会刻意去做TNT,除非是临床研究。
2. 结直肠癌免疫治疗进展
自从2015年开启结直肠癌免疫治疗的微卫星不稳定(microsatellite instability,MSI)时代以来,近几年该领域的研究方兴未艾,但几乎没有进展,直到2018年,出现了很多惊喜,总结如下。
2.1 MSI-H早期结肠癌术前新辅助免疫治疗 来自荷兰的NICHE研究[11]拟入组Ⅰ~Ⅲ期结肠癌,接受单纯免疫治疗:CTL-A4单抗Ipilimumab(Ipi)1 mg/kg(第1天)和PD-1单抗Nivolumab(Nivo)3 mg/kg(第1、15天),然后患者在6周内接受手术。初次报道了14例可评价患者的基本资料[错配修复功能缺陷(deficient mismatch repair,dMMR)、错配修复功能良好(proficient mismatch repair,pMMR)各7例],安全性良好,手术无延迟。疗效结果分析以术后病理检查残留的活性癌细胞<10%为病理重大缓解的标准,全部7例dMMR患者均达此标准,其中4例为pCR,而未完全缓解的3例病例,残留癌细胞比例均≤2%。反之,在pMMR则几乎没有出现病理应答,所有患者,残留癌细胞比例均在85%以上。扩展的标志物分析结果:肿瘤突变负荷(tumor mutation burden,TMB)在dMMR和pMMR两组间有显著差异(P=0.008),治疗前肿瘤中的CD3+淋巴细胞浸润(P=0.662)、γ干扰素基因签名(P=0.56)不能预测疗效。治疗后两组的CD8+T细胞浸润均显著增加,dMMR组增加2.4倍,pMMR组更甚,为4.8倍。而治疗后CD3+淋巴细胞浸润增加则见于dMMR(P=0.031)而非pMMR肿瘤(P=0.461)。
NICHE研究是免疫治疗首次用于人类早期结肠癌的新辅助治疗,并证实PD-1单抗联合小剂量CTL-A4单抗的疗法是安全可行的,没有给后续的手术带来干扰。NICHE应该是2018年度结肠癌免疫治疗最让人惊喜的研究,患者仅仅接受1次剂量的Ipi和2次剂量的Nivo,在最后一个剂量的Nivo治疗后大约2周即进行手术。这么小的治疗剂量在这么短的时间内带来如此显著的肿瘤消退,确实让人倍感意外。与LARC术前同步放化疗后肿瘤退缩相比,免疫治疗在MSI-H行早期结肠癌术前带来的肿瘤消退,无论速度还是深度,均是史无前例的。当然本次NICHE并没有报道影像学评估的肿瘤缓解情况。
那么,NICHE研究会给现行的临床实践带来哪些启示呢?笔者首先想到的是免疫治疗带来的肿瘤快速明显退缩,对于那些局部侵犯严重的巨块型不可切除肿瘤,需要进行缩瘤或者患者因为其他原因无法接受手术时,免疫治疗将会发挥其他手段无法比拟的治疗价值。而对于可切除的早期MSI-H型结肠癌,新辅助免疫治疗带来的良好病理退缩能否转化为生存获益,那就得看后续的进一步研究了。
总之,NICHE研究吹响了结直肠癌领域免疫治疗向术前新辅助治疗进军的号角,完全可以预见,在接下来的几年时间里,该领域的类似研究将会大大增加。未来,在MSI-H早期结直肠癌,外科手术的治疗地位将会受到前所未有的挑战。该研究展现出奇高的病理完全缓解率,让你无法怀疑,直肠癌术前放化疗后cCR患者W&W的非手术治疗策略,在不久的将来也许会因免疫治疗而再次在结直肠癌患者身上上演。
2.2 MSI-H转移性结直肠癌的一线免疫治疗 CheckMate142是PD-1单抗Nivolumab在肠癌领域的Ⅱ期单臂试验,共有3个队列:晚期末线治疗2个队列(Nivo单药组和Nivo+Ipi联合组),晚期一线治疗1个队列(无化疗,单纯接受免疫治疗,Nivo 3 mg/kg q2w+Ipi 1 mg/kg q6w)。研究主要终点为客观缓解率(objective response rate,ORR)。研究目前正在进行中,本次报道一线队列共45例可评估病例的资料[12]。中位随访13.8个月后,观察到ORR为60%,疾病控制率(disease control rate,DCR)为84%;与基线肿瘤负荷相比,80%的患者均出现肿瘤负荷降低。而17例BRAF突变亚组的ORR更是高达71%。肿瘤出现治疗应答的中位时间是2.6个月,最迟出现应答的患者在治疗1年后,并且这种应答的持续时间比较长,在研究数据截止时82%的肿瘤应答还在持续,74%的治疗应答已经超过6个月。所有45例患者的中位PFS尚未达到,12个月时PFS率为77%,OS率为83%。总体不良事件与既往报道的一致,主要集中在皮肤、内分泌系统、肝脏和胃肠道。
免疫治疗走到MSI-H型转移性结直肠癌(metastatic colorectal cancer,mCRC)一线治疗中是必然的事件,之前业界思考的仅仅是免疫治疗将以一种什么样的形式走入一线治疗:单纯免疫治疗还是联合化疗?免疫治疗是单药还是联合使用?CheckMate142研究给出一个全新的答案——单纯联合免疫治疗也许就足够了。该一线队列结果虽然样本量很小、生存数据还很不成熟,但我们完全有理由相信,在不远的未来,免疫治疗必将给MSI-H型晚期结直肠癌的一线治疗带来革新,成为新型的治疗标准,尤其是对于MSI-H/BRAF突变的特殊亚型。同类研究KEYNOTE177的结果(一线Pembrolizumab+FOLFOX+Bev)值得期待。
现在的问题是,对于MSI-H型mCRC,一线治疗还需要化疗或靶向药物吗?未来MSI-H群体免疫治疗的一个主要方向应该是进一步富集/筛选优势人群,毕竟还有40%左右的群体无效。如果在MSI-H这一表型基础上,结合TMB和肿瘤新抗原负荷(tumor neo-antigen burden,TNB),或者进一步去细分MSI-H的类型(突变位点的多少),能否进一步富集优势人群呢?MSI-H但TMB不高的那些患者,是不是也对免疫治疗没效?期待早日解答。
2.3 MSS型转移性结直肠癌的免疫维持治疗 MODUL研究是美国国家癌症研究所开展的大型伞形研究,所有mCRC一线接受FOLFOX+Bev的治疗3~4个月、疾病无进展者行分子标志物检测,基于检测结果进入不同的维持治疗模式。研究有多个队列,其中队列2是BRAF野生型患者,按1∶2接受氟化嘧啶(Fluoropyrimidine,FP)+Bev对比FP/BEV+PD-L1单抗Atezolizumab(Atezo)维持治疗。研究主要终点是PFS,假设是从FP/BEV组的7.5月延长到FP/BEV/Atezo组的11.5个月,HR=0.65。队列2一共入组445例,其中378例检测了MSI状态,98%(371例)为微卫星稳定(microsatellite stability,MSS)[w1] [13]。中位随访18.7个月后,结果显示两组间PFS(7.39个月∶7.20个月,HR=0.96,P=0.727)和OS(21.9个月∶22.0个月,HR=0.86,P=0.283)均无差异,PD-L1单抗加入维持治疗并未给MSS型mCRC带来生存获益,安全性资料与既往的报道一致。
PD-L1单抗Atezo在MSS型人群中治疗失败,这倒不意外,毕竟,既往的试验显示,MSS对现行已知的免疫治疗均无法获益。更失望的是,这次Atezo在Bev的助力之下也没能挽回败局。尽管已经有很多的基础研究显示,Bev可以通过逆转血管内皮生长因子(vascular endothelial growth factor,VEGF)介导的免疫抑制来增强肿瘤的T细胞浸润,从而可能给Atezo带来增效功能,不幸的是,事实再次证明,MSS型肿瘤背后的免疫耐受机制并不是我们理解的那么简单。
2015年以来,业界尝试了很多方法,将MSS型肠癌这种对免疫治疗抗拒的肿瘤(又称为“冷肿瘤”)变为对免疫治疗有效的“热肿瘤”,核心内容就是通过与其他治疗手段联合,来增加肿瘤的免疫原性,包括抗血管生成治疗、各种靶向药物[如丝裂原活化的细胞外信号调节激酶(mitogen-activated extracellular signal-regulated kinase,MEK)抑制剂]、化疗、放疗、局部毁损治疗[如射频消融治疗(radio frequency ablation,RFA)]。现在看来,结果并不理想,在肠癌领域,还未曾看到任何成功的曙光。曾经被寄予厚望的是MEK抑制剂Cobimetinib,早前的Ⅱ期研究显示它能部分程度逆转MSS型肠癌对Atezo的耐药,ORR为20%,罗氏公司也很快启动了Ⅲ期研究,遗憾的是,2018年6月,罗氏公司宣布该研究已经失败,未达研究终点。真的能将“冷肿瘤”变为“热肿瘤”吗?目前还在研究中的方法又能有几成胜算?正如癌症免疫治疗先驱、华人科学家陈列平教授说的那样,“癌症免疫治疗能走多远,取决于人类免疫基础研究能走多远”,看来要解决MSS免疫耐受这个问题,只能依靠像陈教授一样潜心于基础研究的科学家做出突破,希望那一天不要太远。
总之,2018结直肠癌领域免疫治疗是“无突破中有进展”。“无突破”意指免疫治疗的有效人群还是仅仅局限在MSI-H/dMMR这一比例很少的特殊群体,而对于绝大多数的MSS/pMMR群体,尚无法享受到免疫治疗带来的红利。迄今为止,旨在将这类“冷肿瘤”变为“热肿瘤”的所有尝试均以失败告终,此为无突破。“有进展”则是在免疫治疗的优势人群MSI-H/dMMR中,适应证进一步扩大,从原来的转移性疾病末线治疗,拓展到一线治疗和早期疾病的新辅助治疗,这些进展是肠癌免疫治疗领域2015年开启MSI时代以来,一路阴霾中终于露出的最大亮光。
3.转移性结直肠癌靶向治疗进展
3.1 EGFR单抗应用的研究进展 EGFR单抗作为mCRC的有效治疗药物,近年的研究重点在如下几个方面:如何更加精准地筛选优势人群(或排除无效人群)、最佳使用时机(比如“再引入”)及与另一类靶向药物抗VEGF类药物的治疗顺序问题。
3.1.1 EGFR单抗优势人群的负性超级筛选 VALENTINO研究探索了在RAS/BRAF野生型mCRC患者中联合应用标志物筛选EGFR单抗优势人群,使用了一个被称为PRESSING的标志物组合分析[14]:HER2/MET扩增—ALK/ROS/TRKs/RET融合—HER2/PI3K/PTEN/低频RAS突变—MSI。根据结果将患者分为PRESSING阴性(上述指标全部阴性)和阳性(上述任一个指标阳性)两个组。结果提示:PRESSING阳性率为24%(46/189),PRESSING阴性者PFS显著长于阳性者(12.1个月∶7.7个月,HR=2.07,P=0.0 001)。结合原发瘤部位的合并分析发现,右侧肿瘤和(或)PRESSING阳性预示着“耐药型肿瘤”,而左侧肿瘤和(或)PRESSING阴性预示着“敏感型肿瘤”,两类肿瘤的中位PFS分别为8.1个月和13.2个月[HR=2.08(95%CI:1.47~2.93),P<0.0 001]。
mCRC肿瘤中,大约1/3被认为是EGFR依赖型,属于EGFR单抗治疗敏感型肿瘤,而如何筛选出这些人群是基础研究和临床实践中面临的重大课题,也是癌症精准医学的重要内容。由于迄今为止尚未找到EGFR单抗的确切靶点,这个筛选过程主要是排除无效人群,因此,KRAS、RAS等标志物也就被称为“负性标志物”。基于药物作用机制及前期发现,目前业界相信,EGFR信号传导通路上的任何一个节点突变,都有可能对抗EGFR治疗带来负面影响,因此,排除这些相关信号通路上的所有突变成为工作的方向,目前主要集中在RAS-RAF-MEK-ERK以及PTEN-PI3K-AKT等信号通路上。“超级负性筛选”概念毫无疑问往精准治疗又迈进了一步,现在的问题是检测成本和临床实用性.
3.1.2 抗EGFR治疗与抗VEGF治疗的顺序问题 REVERCE研究纳入KRAS-2野生型mCRC患者,既往氟尿嘧啶/奥沙利铂/伊立替康治疗失败,96%以上的患者均接受过Bev治疗,但未曾接受过EGFR单抗治疗,随机分为2组:C-R组,即标准治疗顺序——西妥昔单抗序贯瑞戈非尼;R-C组,即相反顺序——瑞戈非尼序贯西妥昔单抗[15]。结果显示主要终点OS在R-C组显著延长[17.4个月∶11.6个月,HR=0.61(95%CI:0.39~0.96),P=0.029],从C-R模式变为R-C模式后,西妥昔单抗(4.2个月∶5.2月)和瑞戈非尼(1.8个月∶2.4月)两个药物的PFS均得到延长,在RAS/BRAF野生型(HR=0.51,95%CI:0.3~0.86)和原发瘤位于左半结肠者(HR=0.60,95%CI:0.37~0.98),这些本是EGFR单抗传统优势人群,R-C模式的生存获益反而更大。后续的生物标志物更新分析显示,胎盘生长因子或血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)-3水平与PFS1显著相关,在R-C组,这些因子水平更高,生存更长[16]。而在西妥昔单抗治疗后,血浆新出现的肿瘤性突变基因(RAS、BRAF、EGFR S492R突变及HER2与MET扩增)明显较瑞戈非尼治疗后增加。
RAS/BRAF野生型mCRC,尤其是左半结肠患者,EGFR单抗和VEGF单抗两类靶向药物均可以使用,但最优顺序如何呢?尽管大型头对头研究FIRE-3和CALGB80405研究仅仅设计了一线靶向药物对比,提示一线使用西妥昔单抗疗效优于Bev,但这两个试验并没有专门设计一、二线交叉顺序的严格对比,因此,严格意义上该类患者的靶向治疗顺序仍有争议。
由于抗血管生成治疗可以跨线使用,因此,假如该类患者在一线含Bev治疗失败后,二线的靶向治疗有两种选择:继续跨线使用Bev,或交叉至EGFR单抗。近2年以来一些小型随机对照研究探索了此问题,结果均提示继续跨线使用Bev的疗效要优于二线交叉到EGFR单抗;提示一线使用Bev后,可能影响后线EGFR单抗疗效的发挥,提示该类患者治疗中靶向药物的治疗顺序可能还是很重要的,需要合理布局。有趣的是,最近的一项荟萃分析发现,既往接受过Bev治疗失败后的mCRC患者,后续接受帕尼单抗治疗者生存优于接受西妥昔单抗者(12.8个月∶10.1个月,HR=0.72,P=0.031),这些结果提示既往接受Bev治疗对后线西妥昔单抗治疗影响要大于帕尼单抗。
REVERCE探讨的几乎也是类似的问题。由于在该研究中一线治疗几乎所有患者均使用了Bev(两组中使用率分别为96%和98%),而瑞戈非尼的抗瘤效应中,最主要的也被认为是抗VEGF效应,因此,REVERCE研究也可以认为是一线抗VEGF失败后,二线是继续跨线抗VEGF还是交叉抗EGFR的研究。其结果与上述多个研究显示出一致的趋势。
将近期这些研究结果全部汇总分析,提示RAS/BRAF野生型的左半mCRC患者,靶向治疗的顺序是有意义的:有条件使用两类靶向药物的患者,最佳的靶向组合策略也许应该是一线EGFR单抗,然后Bev、酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)瑞戈非尼等抗血管生成治疗,这样才能把每一个药物的效应发挥到最大。而一旦一线治疗选择了Bev,现有证据支持继续抗VEGF治疗(Bev跨线或瑞戈非尼),最后末线才使用EGFR单抗如西妥昔单抗。
由此可见,临床上为了优化EGFR单抗疗效,目前的临床实践和近期的转化研究重点方向在如下几点:更加精准和丰富的分子检测筛选;对于敏感性肿瘤(如RAS/BRAF野生型左半mCRC),需要慎重决策治疗顺序;应该更多的在一线治疗中使用EGFR单抗;在治疗中应用液体活检技术进行动态监测,早期发现癌细胞的分子进化来对应耐药;值得在末线治疗中尝试一线EGFR单抗的再引入,未来克服耐药的方向是开发新型EGFR单抗,或与其他靶向药物、免疫治疗联合等;最后,探索两个EGFR单抗帕尼单抗和西妥昔单抗之间的差异。
4.基于Bev的mCRC治疗进展——加法策略
鉴于Bev临床使用的良好安全性、耐受性与普通化疗不良反应没有明显叠加,Bev被用来与越来越强烈的化疗方案联合,治疗那些肿瘤负荷较重、预后不良且身体状况良好的mCRC患者,目前最强烈的组合当属FOLFOXIRI+Bev。意大利TRIBE研究首次在大规模Ⅲ期随机对照试验里证实了FOLFOXIRI+Bev的疗效显著优于目前临床标准方案FOLFIRI+Bev,成为治疗的新选择,但除了对耐受性/毒性的担忧之外,还面临其他问题:一线治疗里一次性就将几乎所有能用的药物全部用完,疾病进展后如何选择后续治疗?如果一线治疗选择两药化疗+Bev,按目前标准策略,二线更换化疗并跨线继续使用Bev,患者会在二线结束后使用到所有3个细胞毒化疗药,这样还有必要使用如此强烈的FOLFOXIRI方案吗?2018 ESMO年会报道的来自意大利同一研究组的TRIBE2研究,就是专门针对这些问题而设计的[18]。
TRIBE2研究纳入679例初治的mCRC患者,按1∶1随机分两组,A组为对照组,一线治疗FOLFOX+Bev,进展后二线换为FOLFIRI+Bev,是典型的Bev跨线治疗设计,也是目前临床标准治疗策略;B组为研究组,一线FOLFOXIRI+Bev,进展后二线重新引入FOLFOXIRI+Bev。两组患者的一线治疗最多4个月(8周期)后,疾病未进展者即进入FU/LV+Bev维持治疗,进展后开始二线治疗。研究的主要终点是至第2次疾病进展的时间(PFS2)。最后结果显示,能成功接收2线治疗的患者比例在A组中为88%,B组为76%,研究达到主要终点,PFS2从16.2个月显著延长至18.9个月,HR=0.69(95%CI:0.57~0.83),P<0.01。其中1线治疗的获益最大,ORR从50%提高至61%,PFS从9.9个月延长到12.0个月。TIRBE2研究的OS数据预计在2020年公布。
TRIBE2的设计不可谓不大胆,完全超越了常规的临床思路,如此强烈的治疗方案也走“重引入”的策略,这种临床研究的思路确实好好给我们上了一课,笔者估计TRIBE2研究的最终OS也许会延长6~7个月以上。不管结果如何,从可行性角度看,意大利同行已经告诉我们答案:不要担心一线三药治疗的后续选择问题,三药方案也可以再来一次。
5.转移性结直肠癌的其他治疗进展
5.1 腹腔热灌注化疗在mCRC伴腹膜转移癌的治疗价值受到质疑 腹膜转移的mCRC,在能获得满意细胞减灭手术(cytoreductive surgery,CRS)效果的前提下,如CRS 0/1,腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)已经被多家指南推荐为标准治疗手段,然而,2018年的一项研究却让这种推荐受到了质疑。
来自法国的UNICANCER组织PRODIGE7研究纳入265例Ⅳ期结直肠癌伴腹膜癌患者,其他部位没有发生转移[19]。全部患者均接受满意细胞减灭手术治疗(肉眼残留肿瘤<1 mm,即CRS 0/1),手术中随机分配接受或不接受HIPEC(加热至43℃,并在灌注液中加奥沙利铂以增加疗效)。大多数(96%)患者在手术前、手术后或手术前后接受了全身化疗。中位随访64个月时,研究未达成主要研究终点,非HIPEC组和HIPEC组的中位OS期分别为41.2个月和41.7个月,无统计学差异。无复发生存期也相似,分别为中位11.1个月和13.1个月。术后60天时,HIPEC组患者并发症发生率几乎是非HPEC组患者的两倍(24.1%∶13.6%)。不同的腹膜癌病指数(peritoneal carcinomatosis index,PCI)评分,生存预后有显著差异,这与既往研究结果相同;在亚组分析中发现,能从奥沙利铂的HIPEC治疗中获益的是PCI评分为11~15分的患者,但研究中这部分患者比例较低(HIPEC组13.5%∶非HIPEC组的21.2%)。
PRODIGE7研究是大型随机对照试验,在该领域凤毛麟角,业界曾预期其可能是一个阳性研究,结果多少让人有些意外,也让业界重新思考HIPEC的价值。对于腹膜转移癌,PCI评分、CRS根治程度和全身化疗有效性才是影响预后的最关键因素,在此基础上,HIPEC也许真的只能为部分患者带来额外的生存获益。PRODIGE研究患者所接受的是现代的系统治疗,包括靶向治疗,与该领域既往多数研究仅有氟尿嘧啶类药物作为系统治疗的时代完全不同,另外研究设计时没有按照PCI评分分层,可能会带来一些影响。总之,该研究让业界重新思考HIPEC在结直肠癌腹膜转移患者中的价值。
5.2 卡培他滨联合伊立替康成为亚太mCRC患者标准二线治疗方案 一直以来,口服氟尿嘧啶类药物卡培他滨与伊立替康的联合并未获得指南推荐使用,而2018年由中国学者徐瑞华教授牵头的临床试验AXEPT研究则改写了这一局面[20]。
AXEPT研究共纳入650例东亚(中国、日本、韩国)转移性结直肠癌患者,一线含奥沙利铂方案进展后,随机接受FOLFIRI±Bev,对比mXELIRI(卡培他滨+伊立替康)±Bev作为二线治疗,主要研究终点是OS的非劣效性(界值1.30)。结果显示,FOLFIRI与mXELIRI两组的OS分别是15.4个月与16.8个月,HR=0.85(95%CI:0.71~1.02),P<0.001,非劣效性成立。两组的安全性也具可比性,mXELIRI并未观察到预期外的毒性反应。
AXEPT研究的结果一举奠定了mXELIRI成为东亚mCRC患者标准二线治疗方案,中国临床肿瘤学会结直肠癌指南已在2019年更新中首次推荐该方案作为标准二线治疗方案。
5.3 呋喹替尼成为中国mCRC患者标准三线治疗药物 呋喹替尼是一类靶向VEGFR小分子抑制剂,是中国自主研发的抗肿瘤新药。由中国学者李进和秦叔逵教授牵头的FRESCO是一个多中心随机双盲安慰剂对照的Ⅲ期临床试验[21],共纳入416名二线及以上标准化疗失败的转移性结直肠癌患者,按2∶1随机分配接受呋喹替尼治疗或安慰剂治疗。结果显示,呋喹替尼组的mOS为9.30个月,较安慰剂组显著延长2.73个月,HR=0.65 [95%CI:0.51~0.83],P<0.001;呋喹替尼治疗组的mPFS高达3.71个月,较安慰剂组显著延长1.87个月,HR=0.26 [95%CI:0.21~0.34],P<0.001。呋喹替尼组的疾病控制率高达62.2%,中位稳定持续时间长达5.5个月。FRESCO研究中有40.1%的患者既往接受过靶向治疗,结果显示,呋喹替尼对于既往无论是否接受过靶向治疗的患者均能显著获益。另一方面,呋喹替尼表现出良好的耐受性,最常见的不良反应包括高血压、手足皮肤反应及蛋白尿等,多数为1~2级,可通过支持治疗或者剂量调整进行处理。
呋喹替尼已于2018年在中国上市,正式成为中国mCRC患者的标准三线治疗药物。中国临床肿瘤学会结直肠癌指南已经在2019年更新中推荐呋喹替尼作为标准三线治疗方案。
[1] Eric F, Sophie GB, David A, et al. ACCORD12/0405-Prodige 2 phase Ⅲ trial neoadjuvant treatment in rectal cancer: Results after 5 years of follow-up[C]. J Clin Oncol, 2016, 34:suppl 4, 490.
[2] Claus R, Graeven U, Fietkau R, et al. Oxaliplatin added to fluorouracil-based preoperative chemoradiotherapy and postoperative chemotherapy of locally advanced rectal cancer (the German CAO/ARO/AIO-04 study): final results of the multicentre, open-label, randomised, phase 3 trial[J]. Lancet Oncol, 2015, 16(8):979-989.
[3] Carlo A, Sara L, Luca C, et al. Final results of STAR-01: A randomized phase Ⅲ trial comparing preoperative chemoradiation with or without oxaliplatin in locally advanced rectal cancer[C]. J Clin Oncol, 2016, 34(15_suppl):3521.
[4] Carmen JA, Greg Y, Michael J O'Connell, et al. Neoadjuvant therapy for rectal cancer: Mature results from NSABP protocol R-04[C]. J Clin Oncol, 2014, 32:suppl 3, 390.
[5] Hans-Joachim S, Karin H, Timothy JP, et al. Preoperative chemoradiotherapy and postoperative chemotherapy with capecitabine +/- oxaliplatin in locally advanced rectal cancer: Final results of PETACC-6[C]. J Clin Oncol, 2018, 36:suppl, 3500.
[6] Deng YH, Chi P, Lan P, et al. Modified FOLFOX6 With or Without Radiation Versus Fluorouracil and Leucovorin With Radiation in Neoadjuvant Treatment of Locally Advanced Rectal Cancer: Initial Results of the Chinese FOWARC Multicenter, Open-Label, Randomized Three-Arm Phase Ⅲ Trial[J]. J Clin Oncol, 2016, 34(27):3300-3307.
[7] Deng YH, Chi P, Lan P, et al. Modified FOLFOX6 with or without radiation in neoadjuvant treatment of locally advanced rectal cancer: Final results of the Chinese FOWARC multicenter randomized trial[C]. J Clin Oncol, 2018, 36:suppl, 3502.
[8] Yong SH, Sun YK, Ji SL, et al. Long-term results of the ADORE trial: Adjuvant oxaliplatin, leucovorin, and 5-fluorouracil (FOLFOX) versus 5-fluorouracil and leucovorin (FL) after preoperative chemoradiotherapy and surgery for locally advanced rectal cancer[C]. J Clin Oncol, 2018, 36:suppl, 3501.
[9] van der Valk MJM, Hilling DE, Bastiaannet E, et al. Long-term outcomes of clinical complete responders after neoadjuvant treatment for rectal cancer in the International Watch & Wait Database (IWWD): an international multicenter registry study[J]. The Lancet, 2018, 391(10139):2537-2545.
[10] Cercek A, Roxburgh CSD, Strombom P, et al. Adoption of Total Neoadjuvant Therapy for Locally Advanced Rectal Cancer[J]. JAMA Oncol, 2018, 4(6):e180071.
[11] Chalabi M, Fanchi LF, Van d BJG, et al. Neoadjuvant ipilimumab plus nivolumab in early stage colon cancer[J]. Ann Oncol, 2018, 29(suppl_8):mdy424.047.
[12] H-J J Lenz, E Van Cutsem, ML Limon, et al. Durable clinical benefit with nivolumab (NIVO) plus low-dose ipilimumab (IPI) as first-line therapy in microsatellite instability-high/mismatch repair deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC)[J]. Ann Oncol, 2018, 29(suppl_8):mdy424.019.
[13] A Grothey, J Tabernero, D Arnold, et al. Fluoropyrimidine (FP)+bevacizumab (BEV)+atezolizumab vs FP/BEV in BRAFwt metastatic colorectal cancer (mCRC): Findings from Cohort 2 of MODUL-a multicentre, randomized trial of biomarker-driven maintenance treatment following first-line induction therapy[J]. Ann Oncol, 2018, 29(suppl_8):mdy424.020.
[14] F Morano, S Corallo, M Di Bartolomeo, et al. Negative hyper-selection of RAS wild-type (wt) metastatic colorectal cancer (mCRC) patients randomized to first-line FOLFOX plus panitumumab (Pan) followed by maintenance therapy with either 5FU/LV plus pan or single-agent pan: Translational analyses of the VALENTINO study[J]. Ann Oncol, 2018, 29(suppl_8):mdy424.023.
[15] Shitara K, Yamanaka T, Denda T, et al. Reverce: Randomized phase Ⅱ study of regorafenib followed by cetuximab versus the reverse sequence for metastatic colorectal cancer patients previously treated with fluoropyrimidine, oxaliplatin, and irinotecan[C]. J Clin Oncol, 2018, 36: suppl 4, 557.
[16] Tsuji Y, Shitara K, Yamanaka T, et al. REVERCE: Randomized phase Ⅱ study of regorafenib followed by cetuximab versus the reverse sequence for metastatic colorectal cancer patients previously treated with fluoropyrimidine, oxaliplatin, and irinotecan—Biomarker analysis[C]. J Clin Oncol, 2018, 36:suppl, 510.
[17] Taniguchi H, Yamanaka T, Saka Di, et al. Influence of treatment with prior bevacizumab: A combined analysis of individual patient data from ASPECCT and WJOG6510G trial which compared panitumumab versus cetuximab in patients with wild-type KRAS exon 2 metastatic colorectal cancer[J]. Ann Oncol, 2018, 29(suppl_8):mdy281.002.
[18] Cremolini C, Antoniotti C, Lonardi S, et al. TRIBE2: A phase Ⅲ, randomized strategy study by GONO in the 1st- and 2nd-line treatment of unresectable metastatic colorectal cancer (mCRC) patients (pts)[J]. Ann Oncol, 2018, 29(suppl_8):mdy424.021.
[19] Quenet F, Elias D, Roca L, et al. A UNICANCER phase Ⅲ trial of hyperthermic intra-peritoneal chemotherapy (HIPEC) for colorectal peritoneal carcinomatosis(PC): PRODIGE 7[C]. J Clin Oncol, 2018, 36:suppl 4, 3503.
[20] Xu RH, Muro K, Morita S, et.al. Modified XELIRI (capecitabine plus irinotecan) versus FOLFIRI (leucovorin, fluorouracil, and irinotecan), both either with or without bevacizumab, as second-line therapy for metastatic colorectal cancer (AXEPT): a multicentre, open-label, randomised, non-inferiority, phase 3 trial[J]. Lancet Oncol, 2018, 19(5):660-671.
[21] Li J, Qin SK, Xu RH, et al. Effect of Fruquintinib vs Placebo on Overall Survival in Patients With Previously Treated Metastatic Colorectal Cancer: The FRESCO Randomized Clinical Trial[J]. JAMA, 2018, 319(24):2486-2496.















 苏公网安备32059002004080号
苏公网安备32059002004080号


