手术切除是可切除非小细胞肺癌(NSCLC)患者的主要治疗方法,然而 NSCLC患者术后复发转移是影响患者预后的关键因素。相关数据显示, 病理 I 期、II 期和 IIIA 期人群的复发率分别为 23%、56%和 78% [1]。因此,亟需建立早期 NSCLC患者术后复发风险预测模型为高复发风险患者制定最佳诊疗策略提供重要的理论支持。既往研究显示,组织学类型、胸膜侵袭、淋巴血管浸润、气道播散和坏死对 I-III 期 NSCLC 患者具有预后价值[2]。此外,在可切除肺腺癌患者中,有 39.5%~44.5%的患者合并 EGFR 突变[3],与野生型相比,EGFR 突变 I-III 期 NSCLC 患者的疾病复发率更高,预后更差[4]。近期,《International journal of clinical oncology》杂志(IF: 3.3)发表了一篇文献,评估了早期肺腺癌的高危复发因素以及 EGFR 突变的预后价值[3]。【肿瘤资讯】现邀苏州大学附属第一医院黄海涛教授特此点评,结合临床病理学和分子分型,深入剖析 EGFR 突变高危复发人群特征,助力早期 EGFR 突变 NSCLC 精准化诊疗。
研究介绍
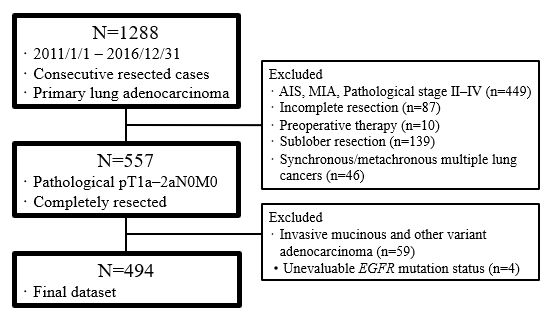
本研究为一项回顾性研究,旨在根据预后不良的病理学指标(包括IASLC分级),确定经手术切除的病理I期肺腺癌患者的高危和低危复发人群,以及评估EGFR突变对高危和低危组预后的影响。研究纳入2011年1月至2016年12月期间接受根治性手术切除的病理IA1-IB期(AJCC第8版TNM分期)肺腺癌患者。排除亚肺叶切除术、同时性/异时性多原发肺癌、微浸润腺癌、浸润性粘液腺癌和其他肺腺癌变异型,或EGFR突变状态无法评估的患者(图1)。对符合条件病例的所有组织病理切片进行重新评估,以明确组织学亚型(贴壁、乳头状、腺泡状、微乳头状、实性、复杂腺体模式)的比例,并确定是否存在淋巴渗透、血管浸润、胸膜侵犯、气道播散(STAS)和坏死。高级别模式包括微乳头、实性和复杂腺体模式。根据主要成分和是否存在超过20%的高级别模式进行分层:级别1(高分化,以贴壁为主,<20%高级别模式),级别2(中分化,腺泡或乳头状为主,<20%高级别模式),级别3(低分化,任何具有≥20%高级别模式的肿瘤)。此外,对切除的肿瘤组织进行EGFR突变检测。患者接受至少5年、最长10年的术后随访。
图1 研究流程图
研究结果
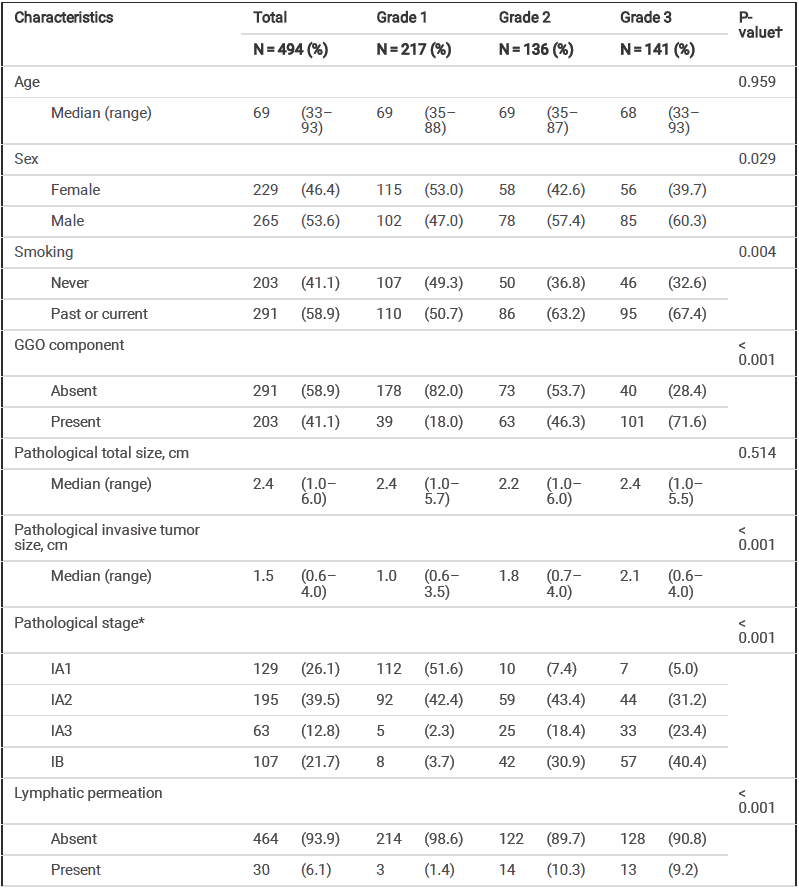
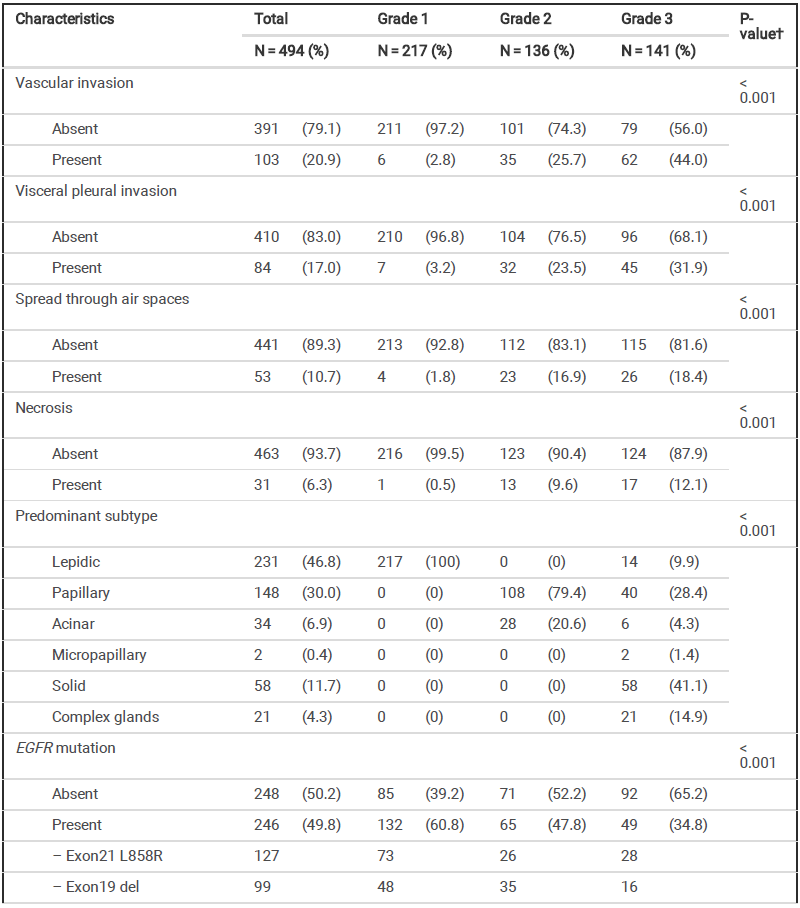
共入组494例患者,其中级别1、级别2和级别3组分别纳入患者217例(43.9%)、 136 例(27.5%)和 141 例(28.5%)。具体基线特征见表 1。各组之间的病理浸润性肿瘤大小、病理分期、淋巴渗透频率、血管浸润、STAS 和坏死等病理因素显著不同(P<0.001)。在整体人群中,EGFR 突变率为 49.8%,其中不同 IASLC分级的 EGFR 突变率存在显著差异(P<0.001)。
表 1 患者基线特征
截止2021年12月31日,整体人群的中位随访时间为73.2个月。不同IASLC分级的无复发生存期(RFS)和总生存期(OS)显著不同,且分级越高,RFS和OS越短(P<0.001)(图2)。
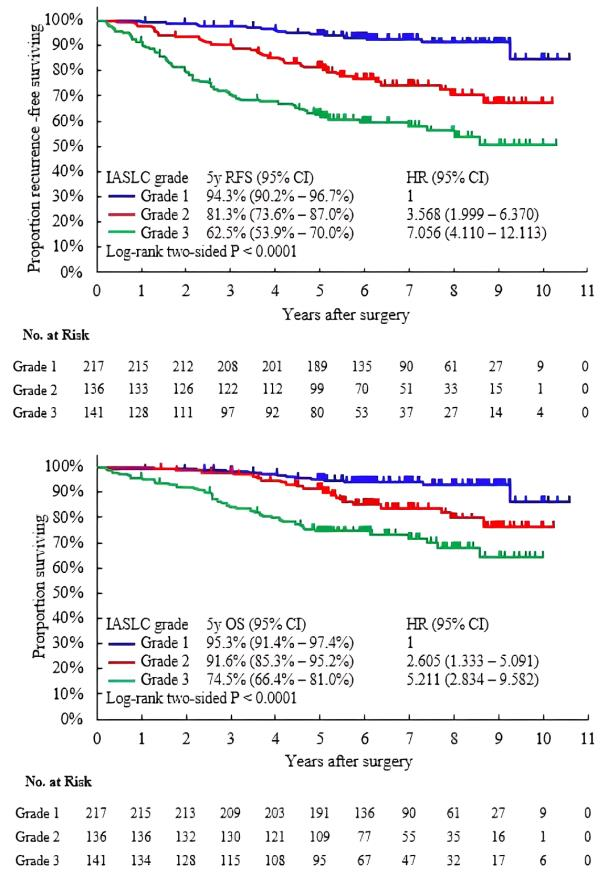
图2 不同IASLC分级的RFS和OS
RFS和OS的单因素和多因素分析显示,IASLC 级别3、≥75岁、病理浸润性肿瘤大小>2cm、无GGO、合并淋巴血管浸润是RFS和OS的预后不良因素(表2)。基于此,对于存在任何一个预后因素(IASLC 级别3、病理浸润性肿瘤大小>2cm和淋巴血管浸润)的患者划分为高危组,无任何预后因素的患者划分为低危组。
表2 RFS和OS的单因素和多因素分析
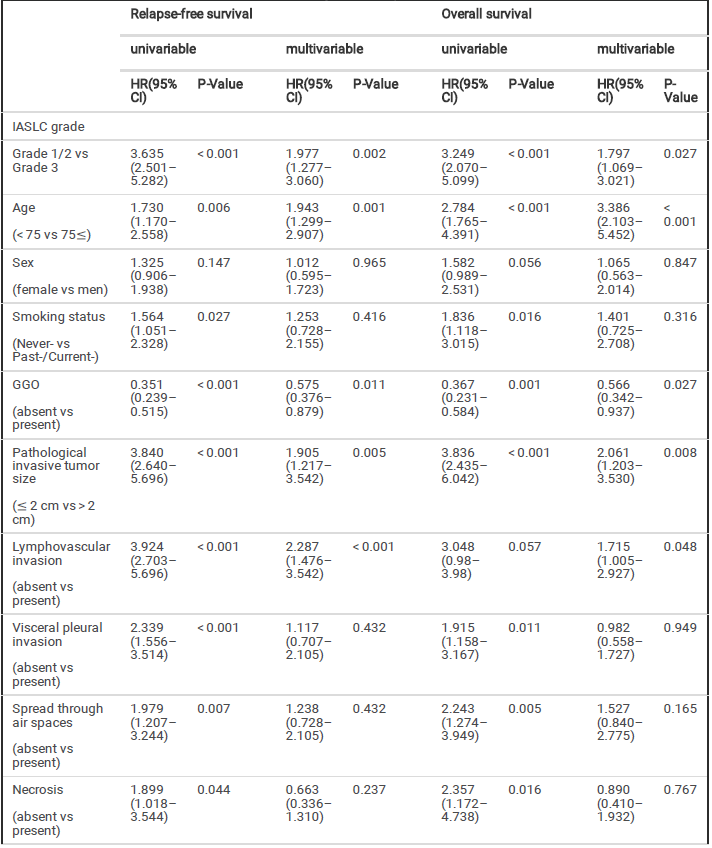
在整体人群中,EGFR突变型和野生型的RFS相当(HR=0.852;95%CI0.587- 1.238;P=0.3994);EGFR突变型患者的OS相较野生型有延长趋势(HR=0.606;95%CI0.381-0.963;P=0.0321)。在高危组中,与EGFR野生型患者相比,EGFR 突变阳性患者的RFS较短,尽管其并没有统计学意义(HR=1.298;95%CI0.846-1.989;P=0.2302)。与其相反的是,EGFR突变型和野生型的OS相当(HR=0.766;95%CI0.443-1.323;P=0.3373)。在低危组中,EGFR突变型和野生型的RFS 或OS未发现有差异(图3)。
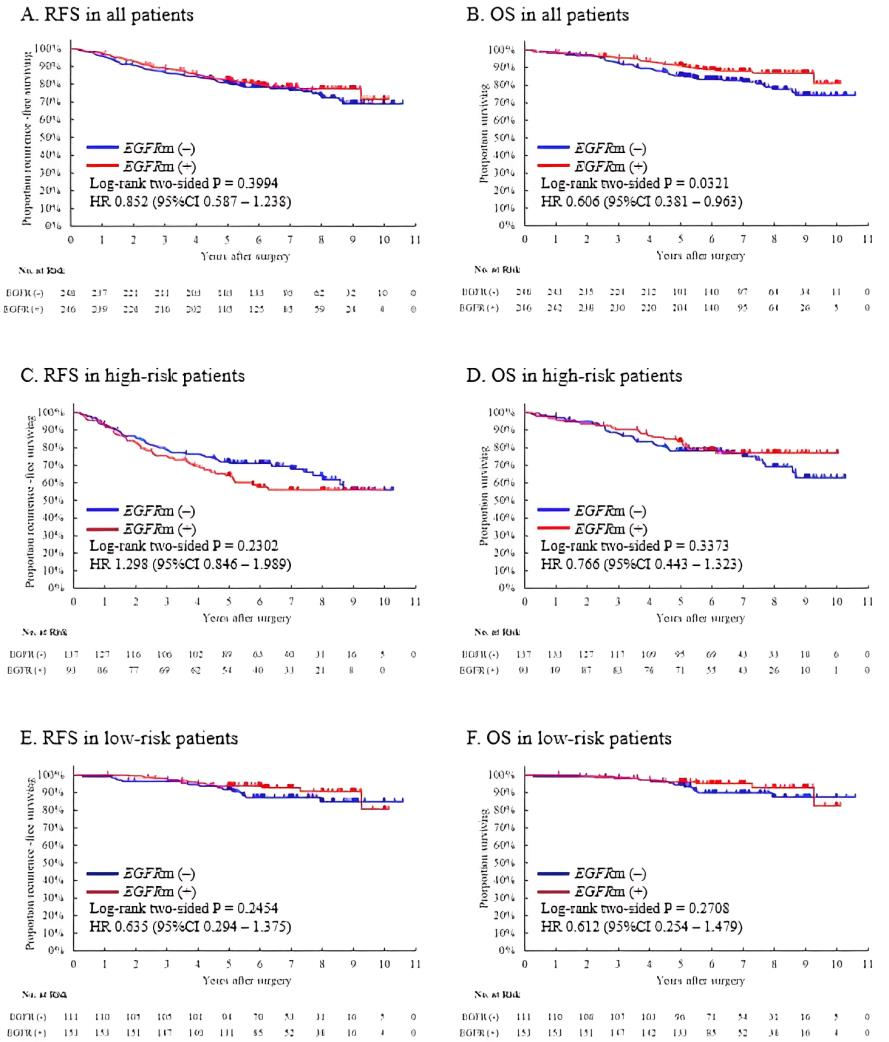
图3 高危组和低危组中EGFR突变型和野生型患者的RFS和OS
在整体人群中,无论是局部复发还是远处复发,EGFR突变型和野生型均无差异。但在高危组中,与EGFR野生型相比,EGFR突变型人群的累积复发率更高,且CNS转移和远处复发率也更高,然而局部复发率未观察到差异(图4)。
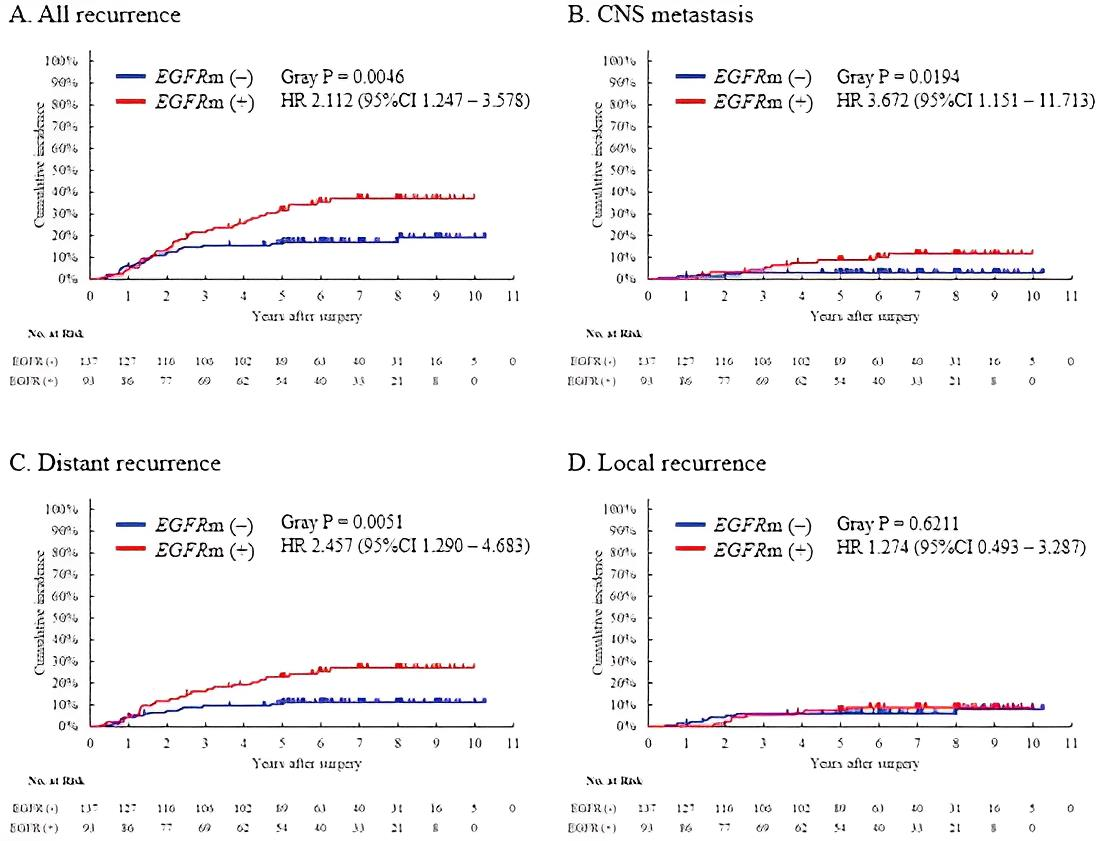
图4 高危组中EGFR突变型和野生型的累积复发率
小结
此研究结果表明,EGFR突变阳性的高危I期肺腺癌术后患者远处转移和中枢神经系统复发率较高,这提示我们有必要对这类患者进行辅助治疗。
胸外科行政副主任
主任医师 副教授 硕士研究生导师
中国医师协会胸外科医师分会青年委员
江苏省医学会胸外科学分会委员
中国医疗保健国际交流促进会胸外科分会委员
中国医药教育学会肺癌医学教育委员会委员
海峡两岸医药卫生交流协会胸外科专委会委员
江苏省抗癌协会肺癌专业委员会委员
江苏省抗癌协会肿瘤微创治疗专业委员会青年委员
江苏省免疫学会肿瘤免疫专业委员会委员
苏州市肿瘤生物治疗学会常务委员
目前可切除NSCLC治疗决策的制定主要基于患者的临床疾病分期和分子分型。对于IB-IIIA期EGFR突变患者,术后EGFR-TKIs辅助治疗已经成为标准治疗,对于 IA 期患者,缺乏标准的术后辅助治疗方案。尽管大部分 IA 期 NSCLC 患者 在手术切除后可取得较长的无病生存期,但仍有 37.5%的患者会在 5 年时出现 疾病复发或死亡[5],其中 IA2 期 NSCLC 患者有 12%~29%会在 5 年时出现疾病 复发或死亡;此外,在 I 期 NSCLC 患者中,以远处转移最为常见 [6,7]。可见, 对于 IA 期人群,亟需探寻新的治疗方案以延迟或预防疾病复发。
既往研究显示,相较安慰剂,辅助化疗并未改善 IA 期 NSCLC 患者的 DFS 和 OS[8]。近年来,随着对 IA 期人群临床病理特征和预后的深入探索,国内外专家 学者发现 IA 期 NSCLC 存在异质性。结果显示,腺癌的具体组织学类型、淋巴 血管浸润和肿瘤大小与 IA 期 NSCLC 患者的高复发率相关[2]。此外,IASLC 委 员会从病理学角度提出,基于主要成分和高级别模式的分级系统有助于预测肺腺 癌患者的预后。该研究结合了 IASLC 分级系统,以及临床发现的预后因素,将 I 期患者区分为高危组和低危组,进一步生存分析显示,在 I 期 NSCLC 患者中, 高危组患者的 RFS 和 OS 较低危组显著降低。 与此同时,这项研究的另一个亮点是评估 EGFR 突变对 I 期 NSCLC 患者预后的影响。结果提示 EGFR 突变的预后价值因不同亚型而异;在整体 I 期 NSCLC 患 者中,EGFR 突变型和野生型的 RFS 和 OS 未观察到差异。然而,复发风险分 层分析显示,在高危组中,EGFR 突变患者的 RFS 和 OS 较 EGFR 野生型更差; 且脑转移发生率更高。以上提示伴高危因素的 I 期 NSCLC 患者,尤其是携带 EGFR 突变的,是未来需要优化诊疗的关键人群。 对于早期可切除 NSCLC 患者,如何防止术后复发是临床医生和患者都非常关注 的问题。近年来,随着对 NSCLC 生物学理解的加深,NSCLC 的病理学特征和 分子检测均取得了重大进展。因此在早期 NSCLC 临床实践中,基于临床及病理 特征,并结合分子分型是未来的诊疗趋势。
[1] Cruz C, Afonso M, Oliveiros B, Pêgo A. Recurrence and Risk Factors for Relapse in Patients with Non-Small Cell Lung Cancer Treated by Surgery with Curative Intent. Oncology. 2017;92(6):347-352. doi: 10.1159/000458533. Epub 2017 Mar 10. PMID: 28278499. .
[2] Moreira AL, Ocampo PSS, Xia Y, et al. A Grading System for Invasive Pulmonary Adenocarcinoma: A Proposal From the International Association for the Study of Lung Cancer Pathology Committee. J Thorac Oncol. 2020;15(10):1599-1610. doi: 10.1016/j.jtho.2020.06.001. Epub 2020 Jun 17. PMID: 32562873.
[3] Nomura K, Aokage K, Kaminuma Y, et al. EGFR mutation impacts recurrence in high-risk early-stage lung adenocarcinoma in the IASLC grading system. Int J Clin Oncol. 2024;29(3):248-257. doi: 10.1007/s10147-023-02464-1. Epub 2024 Feb 6. PMID: 38319510.
[4] Kim H, Lee HJ, Hong H, et al. The prognostic implications of EGFR mutation and ALK rearrangement for the long-term outcomes of patients with resected lung adenocarcinomas. Thorac Cancer. 2019;10(7):1619-1627. doi: 10.1111/1759-7714.13128. Epub 2019 Jun 18. PMID: 31215177.
[5] Peters S, Weder W, Dafni U, et al. Lungscape: resected non-small-cell lung cancer outcome by clinical and pathological parameters. J Thorac Oncol. 2014;9(11):1675-1684. doi: 10.1097/JTO.0000000000000320. PMID: 25436801.
[6] Isaka T, Ito H, Nakayama H, Yokose T, Yamada K, Masuda M. Effect of epidermal growth factor receptor mutation on early-stage non-small cell lung cancer according to the 8th TNM classification. Lung Cancer. 2020;145:111-118. doi: 10.1016/j.lungcan.2020.04.012. Epub 2020 May 11. PMID: 32428800.
[7] Moon Y, Park JK, Lee KY, Kim ES. Prognosis after wedge resection in patients with 8th edition TNM stage IA1 and IA2 non-small cell lung cancer. J Thorac Dis. 2019;11(6):2361-2372. doi: 10.21037/jtd.2019.05.79. PMID: 31372273.
[8] Pignon JP, Tribodet H, Scagliotti GV, et al. Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol. 2008;26(21):3552-3559. doi: 10.1200/JCO.2007.13.9030. Epub 2008 May 27. PMID: 18506026.
本材料由阿斯利康提供,仅供医疗卫生专业人士参考,不可用于推广目的。
审批编号:CN134510
过期日期:2024-7-25
排版编辑:肿瘤资讯-张钰晴











 苏公网安备32059002004080号
苏公网安备32059002004080号


