免疫检查点抑制剂的发现彻底改变了肿瘤的治疗方式,并被广泛应用于临床。但是,并非所有患者都能从免疫治疗中获益[1],因此,需要通过有效的生物标志物来筛选免疫检查点抑制剂的获益人群。微卫星不稳定、PD-L1表达和肿瘤突变负荷是目前被批准用于指导免疫治疗的预测标志物,其中PD-L1表达应用最广[2]。
迄今最大规模泛癌分析PD-L1表达率的研究表明:60.5%接受PD-L1检测的肿瘤患者被诊断为PD-L1阴性,失去免疫治疗获益的可能性[3]。《实体肿瘤PD-L1免疫组织化学检测专家共识(2021版)》指出:已在临床应用的多种抗PD-L1/PD-1药物对应的PD-L1检测抗体/试剂盒以及判读标准/阈值不尽相同,对临床应用提出了挑战;部分PD-L1表达阴性的患者亦可从免疫治疗中获益,部分PD-L1表达阳性的患者治疗无反应;因此,应认识到该标志物的不完美,并不断研究及更新该标志物在免疫治疗中作用的认知[4]。
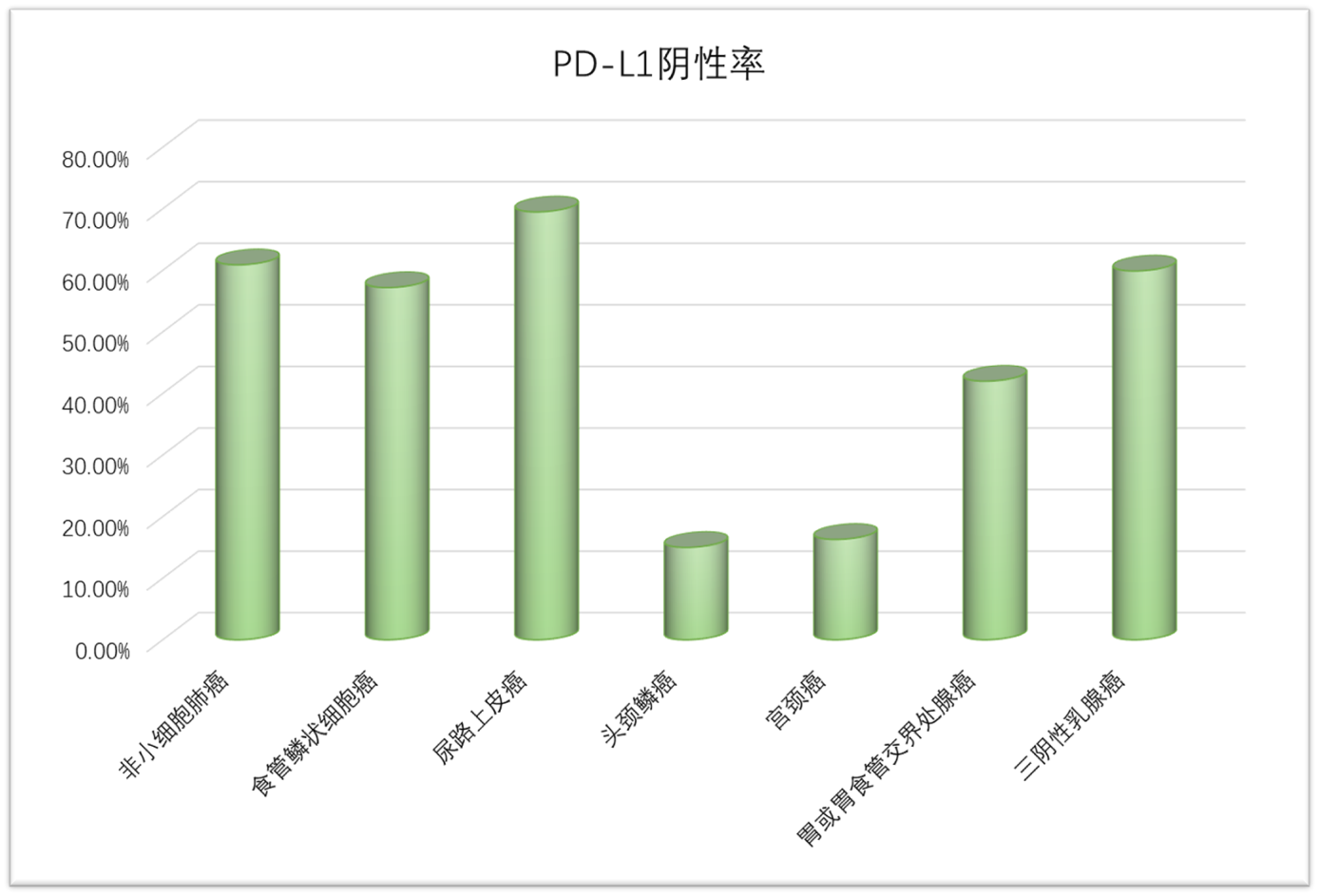
不同肿瘤的PD-L1检测阴性表达率
数据来源于临床试验KEYNOTE-024、010、181、052、048、158、059,IMPassion130
三级淋巴结构(tertitary lymphoid structures,TLS)又叫免疫相关淋巴组织,包括黏膜相关淋巴组织、皮肤相关淋巴组织等[5]。相较于初级淋巴组织(胸腺和骨髓)和次级淋巴组织(脾脏、淋巴结和扁桃体等),TLS是在非淋巴组织中发育的异位淋巴结构,与淋巴结具有相似的结构和功能,包括T细胞区和B细胞区。T细胞区主要由T细胞、成熟的树突细胞和成纤维网状细胞组成。B细胞区主要由B细胞、滤泡辅助T细胞、巨噬细胞和滤泡树突细胞组成。滤泡状树突细胞通常位于B细胞中心,表达各类受体,促进抗原递呈至B细胞,并驱动B细胞表达高活性的抗体,TLS为抗肿瘤的细胞及体液免疫反应提供了一个局部和关键的微环境[6]。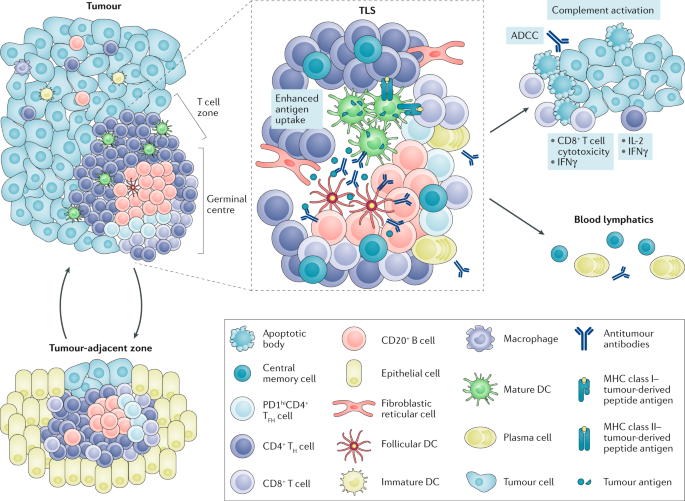
TLS的细胞构成和功能
首次关于TLS的报道出现在肺癌研究中,该研究通过免疫组化对74名早期非小细胞肺癌(NSCLC)患者的样本进行表征,在各阶段NSCLC肿瘤的浸润边缘均发现了B细胞滤泡附近的成熟树突细胞和T细胞簇,并称其为肿瘤诱导的支气管相关淋巴组织[7]。随后,大量研究表明,TLS的细胞组成、密度、位置与肺癌、卵巢癌、黑色素瘤、肝内胆管癌、结直肠癌、头颈癌等多种恶性肿瘤的临床预后改善或者免疫治疗获益有关[8-12]。
2020年,一期《自然》(Nature)杂志上同时发表了三篇来自不同研究团队的关于TLS的研究报道,通过研究黑色素瘤、肾癌和软组织肉瘤的肿瘤免疫微环境以及TLS的组成和浸润情况,发现CD20+ B细胞定位在肿瘤的TLS中,并且与CD4+ 细胞、CD8+ 细胞以及CD21+ 滤泡型树突状细胞共定位。三篇研究共同认为:肿瘤组织中的B细胞和成熟的TLS,是免疫治疗的重要组成部分,与免疫治疗的疗效密切相关;研究认为患者能否从免疫治疗中获益,或许取决于肿瘤中B细胞和TLS的浸润情况[13-15]。
为了评估TLS对免疫治疗的预测价值,一项研究对接受抗PD-L1/PD-1治疗的三个独立癌症患者队列进行大规模回顾性分析[16],利用多重荧光免疫组化技术(mIHC),评估肿瘤免疫微环境中TLS的成熟状态。研究者认为,成熟的TLS(mTLS)由B细胞和CD23+ 滤泡树突状细胞(DCs)组成,与一个较小的CD4+和CD8+混合T细胞区相连。TLS中的B细胞通过分泌抗体和细胞因子对抗PD-L1/PD-1的反应起关键作用。DCs通过调节抗原加工和呈递来调节T细胞功能。B细胞的功能依赖于TLS的成熟状态,促肿瘤或抗肿瘤。在mTLS中,B细胞和DCs通过提供肿瘤抗体来更好地训练CD8+T细胞。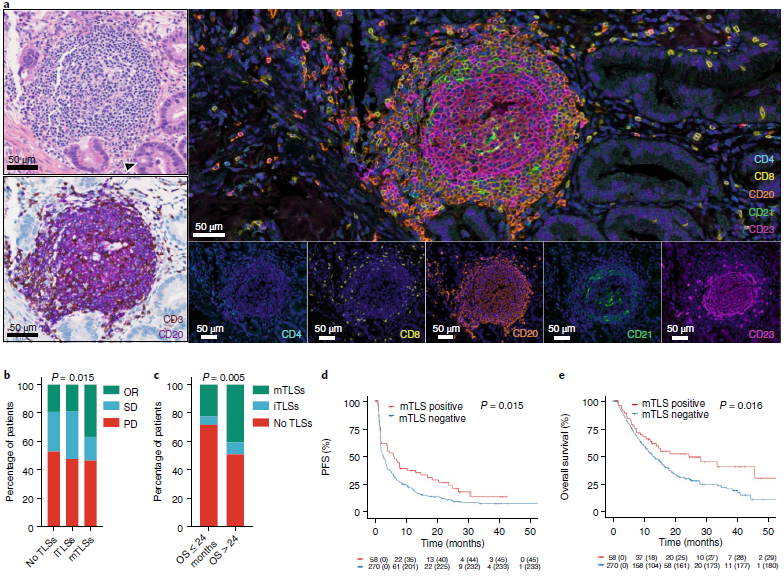
mTLS可以预测接受抗PD-L1/PD-1药物治疗的癌症患者的预后
该研究入组328例患者,涉及11个癌种,在大多数肿瘤类型中都观察到具有良好的高相关性。mTLS阳性肿瘤患者的比例在临床实际获益患者(OR)中显著高于疾病进展/疾病稳定(PD/SD)的患者,长期幸存者中,mTLS患者的比例显着高于其他患者组,mTLS的存在与客观缓解率(ORR)的提高、无进展生存期(PFS)和总生存期(OS)有关。由此可见,mTLS的预测价值似乎不受特定肿瘤类型的限制。
研究发现,mTLS阳性肿瘤更多地被CD8+ T细胞浸润,mTLS的存在与CD8+ T细胞高浸润的肿瘤预后改善显著相关,与PD-L1表达状态无关;但对于CD8+ T细胞低浸润的肿瘤患者而言,无论TLS状态如何,其预后都较差。在获益患者中,CD8+ T细胞的存在是必要的,但不足以诱导持续的抗肿瘤免疫反应,B细胞在抗肿瘤T细胞免疫诱导的反应中起关键作用。由此可见,根据mTLS和CD8+ T细胞的表达情况,可以进一步明确实体瘤中PD-L1阴性患者的获益可能性。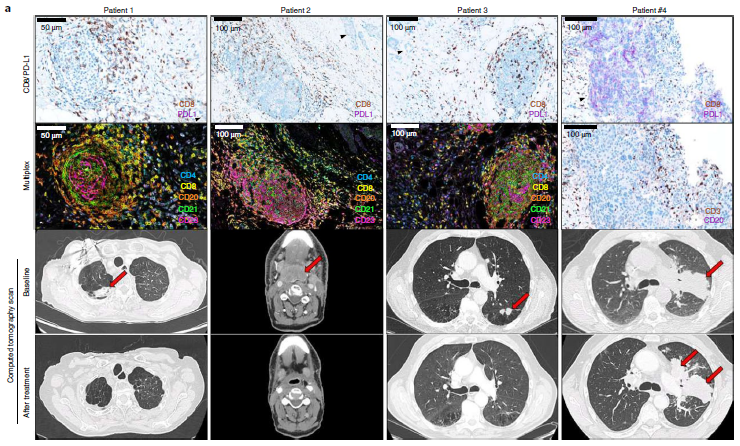
mTLS可以预测免疫检查点抑制的反应,与PD-L1表达状态无关
综上所述,临床中常用的PD-L1表达这一分子标志物并不完美,亟需发现和开发新的、更加有效的免疫治疗分子标志物[4],而多项研究结果表明免疫微环境中的三级淋巴结构的状态与肿瘤患者的预后、接受免疫治疗的疗效息息相关,并且免疫微环境中的TLS状态与PD-L1表达[16]在评估免疫治疗方面是相互独立的[13-15]。免疫微环境中的TLS是一个新的、潜在免疫治疗分子标志物,在平时的临床研究中,有必要将其纳入到后续的临床试验设计中,为后续精准免疫治疗提供更多临床证据。
1.Carretero‐González A, Lora D, Ghanem I, et al. Analysis of response rate with ANTI PD1/PD‐L1 monoclonal antibodies in advanced solid tumors: a meta‐analysis of randomized clinical trials. Oncotarget, 2018, 9(9): 8706‐8715.
2.Walk EE, Yohe SL, Beckman A, et al. The cancer immunotherapy biomarker testing landscape. Arch Pathol Lab Med, 2020, 144(6): 706‐724.
3.Richard S P, James H, et al. A pan-cancer analysis of PD-L1 immunohistochemistry and gene amplification, tumor mutation burden and microsatellite instability in 48,782 cases. Mod Pathol, 2021, 34(2):252-263.
4.实体肿瘤PD⁃L1免疫组织化学检测专家共识(2021版),中华病理学杂志2021年7月第50卷第7期。
5.Marie C. Tumor-Associated Tertiary Lymphoid Structures: A Cancer Biomarker and a Target for Next-generation Immunotherapy. Adv Exp Med Biol, 2021; 1329: 51-68.
6.Catherine S, Florent P, et al. Tertiary lymphoid structures in the era of cancer immunotherapy. Nature Reviews Cancer, 2019, 19: 307–325.
7.Marie C, Martine A, et al. Long-term survival for patients with non-small-cell lung cancer with intratumoral lymphoid structures. J Clin Oncol, 2008. 20; 26(27): 4410-7.
8.Shimabukuro-Vornhagen, A.; Schlößer, H.A.; Gryschok, L.; Malcher, J.; Wennhold, K.; Garcia-Marquez, M.; Herbold, T.; Neuhaus, L.S.; Becker, H.J.; Fiedler, A.; et al. Characterization of tumor-associated B-cell subsets in patients with colorectal cancer. Oncotarget 2014, 5, 4651–4664.
9.Woo, J.R.; Liss, M.A.; Muldong, M.T.; Palazzi, K.; Strasner, A.; Ammirante, M.; Varki, N.; Shabaik, A.; Howell, S.; Kane, C.J.; et al. Tumor infiltrating B-cells are increased in prostate cancer tissue. J. Transl. Med. 2014, 12, 30.
10.Lechner, A.; Schlößer, H.A.; Thelen, M.; Wennhold, K.; Rothschild, S.I.; Gilles, R.; Quaas, A.; Siefer, O.G.; Huebbers, C.; Cukuroglu, E.; et al. Tumor-associated B cells and humoral immune response in head and neck squamous cell carcinoma. OncoImmunology, 2018, 8, 1535293.
11.Ding G Y, Ma J Q, et al. Distribution and density of tertiary lymphoid structures predict clinical outcome in intrahepatic cholangiocarcinoma. J Hepatol, 2021, S0168-8278(21)02178-4.
12.Schumacher et al. Tertiary lymphoid structures in cancer, Science, 2022, 375, 39.
13. Petitprez, F. et al. B cells are associated with survival and immunotherapy response in sarcoma. Nature, 2020, 577, 556–560.
14.Cabrita, R. et al. Tertiary lymphoid structures improve immunotherapy and survival in melanoma. Nature 2020, 577, 561–565.
15.Helmink, B. A. et al. B cells and tertiary lymphoid structures promote immunotherapy response. Nature 2020, 577, 549–555.
16.Vanhersecke, L. et al. Mature tertiary lymphoid structures predict immune checkpoint inhibitor efficacy in solid tumors independently of PD-L1 expression. Nature Caner, 2021, 2, 794–802.

排版编辑:Halo














 苏公网安备32059002004080号
苏公网安备32059002004080号


