2025年接近尾声,各大会议陆续公布了众多肺癌领域的相关研究进展,【肿瘤资讯】整理其中较为重要的研究数据,从驱动基因阳性、驱动基因阴性、小细胞肺癌三个维度进行梳理,以飨读者。本文重点聚焦“驱动基因阳性”领域的重要进展。
FLAURA2研究公布最终OS数据(2025 WCLC)
这项全球III期随机对照临床研究纳入年龄≥18周岁,组织病理学或细胞病理学确认的局部晚期或转移性非小细胞肺癌(NSCLC)患者,患者携带19del或21L858R突变,稳定性脑转移患者允许入组。符合入组标准的患者按1:1的比例,随机分为奥希替尼80mg,口服,每日一次,或在此基础上进一步联合4个周期含铂双药化疗,随后接受奥希替尼联合培美曲塞维持治疗,主要研究终点为PFS,OS为关键次要终点。数据分析是在OS为57%的成熟度数进行。联合化疗组和单纯奥希替尼组分别入组279例和278例患者,19del患者占比分别为61%和60%,脑转移患者占比分别为42%和40%。两组分别有69%和77%的患者在疾病进展后接受后续治疗,两组中位OS分别为47.5个月和37.6个月,HR=0.77,P=0.02。
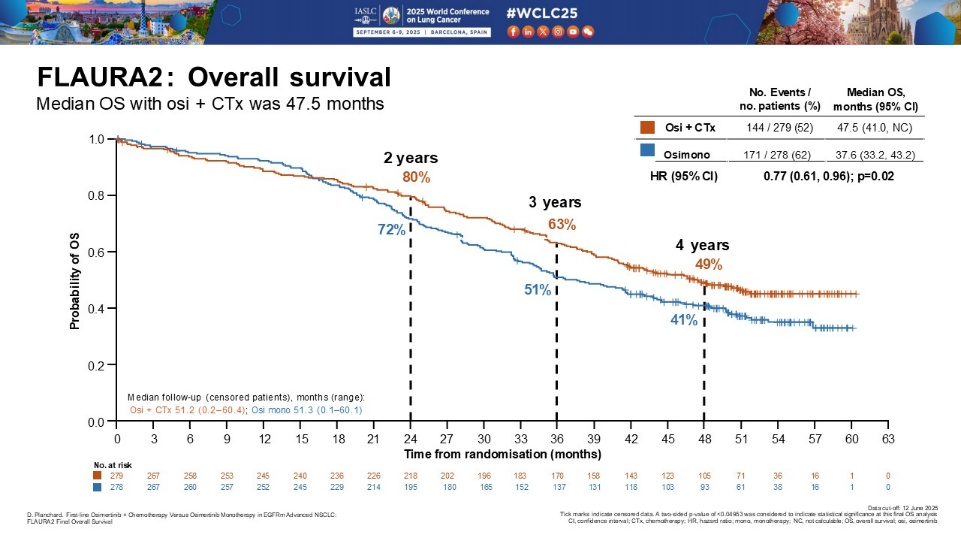
3级不良反应发生率分别为70%和34%,严重不良反应发生率分别为46%和27%,因不良反应而导致奥希替尼终止的比例分别为12%和7%,培美曲塞治疗终止的比例为50%,卡铂终止的比例为17%。
依沃西单抗联合化疗治疗三代EGFR-TKI耐药后的NSCLC患者(HARMONi研究,WCLC)
这项研究纳入局部晚期或转移性NSCLC患者,患者携带EGFR敏感突变,且接受三代靶向药物治疗后耐药,无论患者PD-L1表达水平均允许入组,符合入组标准的患者按1:1比例随机分为含铂双药化疗或在此基础上进一步联合依沃西单抗(20mg/kg),主要研究终点为PFS和OS,OS进行一次期中分析,为出现231例终点事件数时进行,最终分析在OS出现261例终点事件时进行。两组均入组219例患者,脑转移患者占比分别为24.7%和24.7%。19del患者占比分别为59.8%和53.9%,两组中位PFS分别为6.8个月和4.4个月,HR=0.52,P<0.0001。基线有脑转移和无脑转移的患者,HR分别为0.34和0.59。两组中位OS分别为16.8个月和14.0个月,HR=0.79,P=0.057。
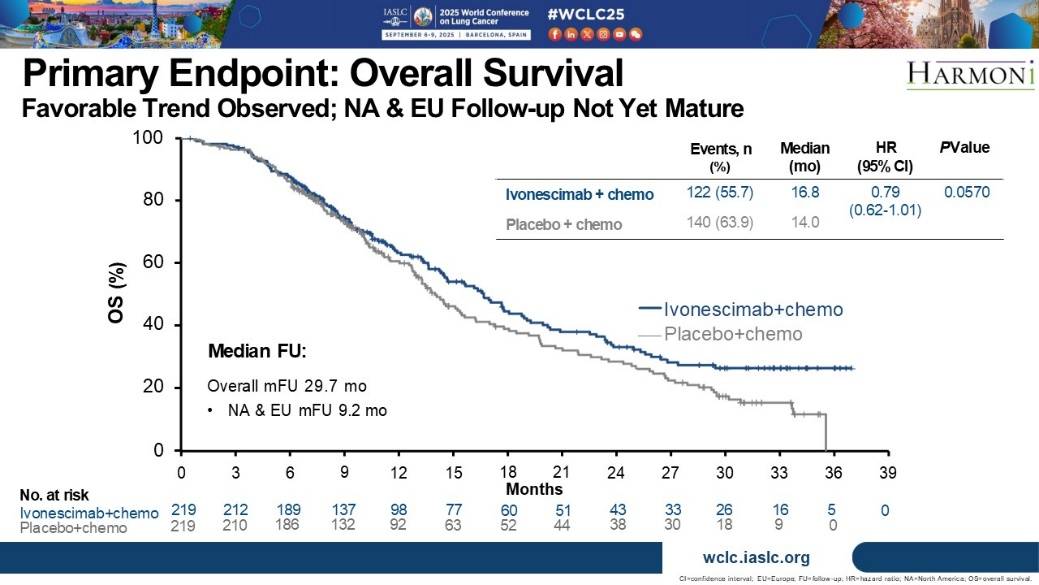 两组中位OS
两组中位OS
两组ORR分别为45%和34%,DCR分别为84%和73%,中位DOR分别为7.6个月和4.2个月。两组3级及以上不良反应发生率分别为50%和42.2%,严重不良反应发生率分别为28.0%和15.1%,3级以上免疫相关不良反应发生率分别为9.6%和6.0%。
HER3-DXd在EGFR突变且三代靶向药物耐药的NSCLC患者中的疗效及安全性:HERTHENA-Lung-02研究(2025 ASCO)
HER3-DXd是一款针对HER3的抗体偶联药物,DAR=8,偶联的细胞毒类药物为I型DNA拓扑异构酶抑制剂。这项研究纳入携带EGFR敏感突变,且靶向药物耐药的患者。符合入组标准的患者按1:1的比例,随机分为含铂双药化疗或HER3-DXd治疗(5.6mg/kg,每3周一次),主要研究终点为 PFS,次要研究终点为OS。OS设定3次期中分析。
最终,两组均入组293例患者,脑转移患者占比分别为35.8%和32.4%。两组中位PFS分别为5.8个月和5.4个月,HR=0.77,P=0.011,9个月PFS率分别为29%和19%,两组ORR分别为35.2%和25.3%,中位DoR分别为5.7个月和5.4个月,颅内ORR分别为19%和11.6%。两组中位OS分别为16.0个月和15.9个月,HR=0.98。
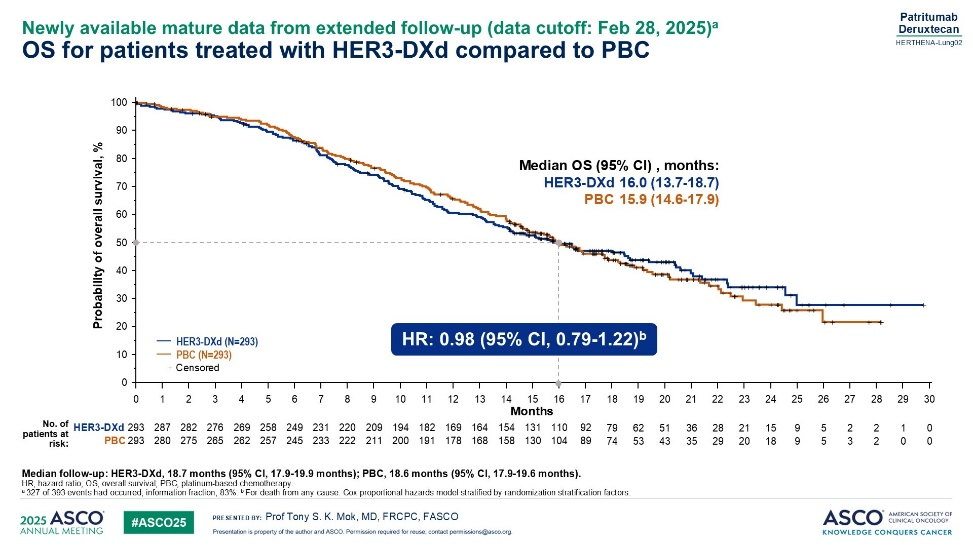
3级及以上不良反应发生率为72.8%和57.1%,3级以上治疗相关不良反应发生率分别为57.9%和46.1%,严重不良反应发生率分别为42.8%和28.6%,因不良反应而导致剂量降低的比例分别为32.4%和21.1%,治疗中断的比例分别为45.2%和37.5%。
芦康沙妥珠单抗三线/二线治疗NSCLC患者的疗效与安全性(OptiTROP-Lung03/04研究,2025 ASCO/ESMO)
芦康沙妥珠单抗是一款针对TROP2的抗体偶联药物,DAR=7.4,细胞毒类药物为I型DNA拓扑异构酶抑制剂。OptiTROP-Lung03研究纳入携带EGFR 19del或21L858R突变且既往接受靶向治疗及含铂双药化疗后疾病进展的晚期NSCLC患者,符合入组标准的患者按2:1的比例,随机分为芦康沙妥珠单抗(5mg/kg,每2周一次),或标准剂量的多西他赛治疗,主要研究终点为ORR,次要研究终点为PFS、OS、DOR及安全性。最终,两组分别入组91例和46例患者,脑转移患者占比分别为19.8%和21.7%,19del占比分别为47.3%和69.6%,两组ORR分别为45.1%和15.6%,DCR分别为82.4%和60%,中位PFS分别为6.9个月和2.8个月,HR=0.30,P<0.0001,中位OS均为未达到,12个月OS率分别为72.8%和54.3%,HR=0.49,P=0.0070。
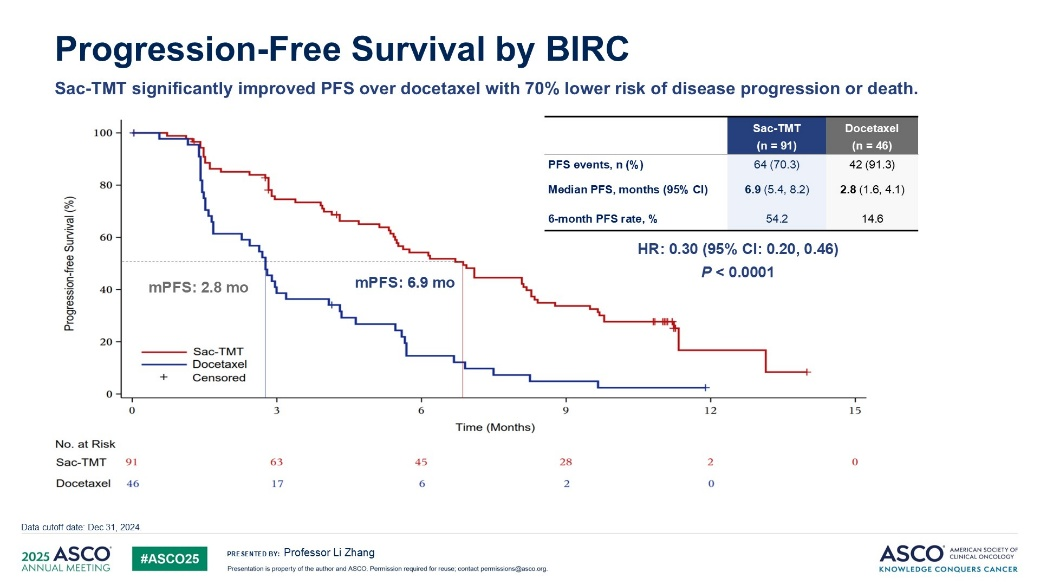
两组3级以上治疗相关不良反应发生率分别为56.0%和71.7%,严重治疗相关不良反应发生率分别为16.5%和41.3%。因不良反应导致剂量降低的比例分别为31.9%和43.5%。
该药二线治疗EGFR-TKI耐药的晚期肺癌患者的数据于今年ESMO年会,以口头汇报的形式公布,即OptiTROP-Lung04研究。该研究纳入驱动基因突变阳性且三代靶向药物耐药或一/二代靶向药物耐药后T790M突变阴性的患者,接受含铂双药化疗或芦康沙妥珠单抗治疗,主要研究终点为PFS,次要研究终点为OS。最终,两组均入组188例患者,脑转移患者占比分别为17.6%和19.1%,19del患者占比分别为56.4%和62.8%。两组中位PFS分别为8.3个月和4.3个月,HR=0.49,P<0.0001,中位OS分别为未达到和17.4个月,18个月OS率分别为65.8%和48.0%,HR=0.60,P=0.0001。ORR分别为60.0%和43.1%,DCR分别为87.2%和80.3%。
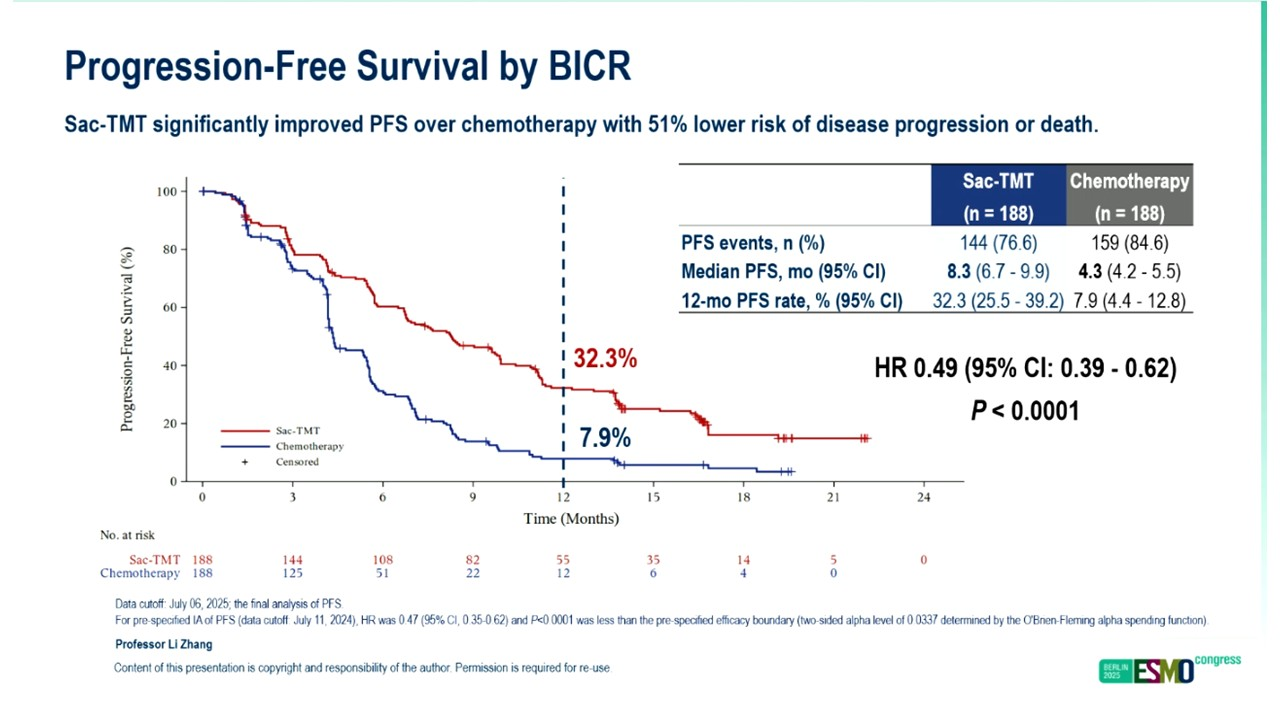 两组中位PFS
两组中位PFS
3级以上治疗相关不良反应发生率分别为58.0%和53.8%,严重治疗相关不良反应发生率分别为9.0%和17.6%,因不良反应而导致剂量降低的比例分别为30.3%和22.5%。
SOHO-01研究: BAY-29270882治疗HER-2突变NSCLC患者的疗效及安全性(2025 ASCO)
该药基于I期临床研究数据,推荐给药剂量为20mg,口服,每日两次。今年世界肺癌大会公布了队列D(既往接受过治疗,但未接受过针对HER2靶向治疗的患者)、队列E(既往接受过HER2-ADC类药物治疗)和队列F(既往未经过任何治疗的患者)数据,主要研究终点均为ORR。最终,三个队列分别入组81例、55例和73例患者,基线分别有22%、27%和12%的患者有脑转移。
队列D的患者ORR为64.0%,DCR为81%,中位PFS为8.3个,月,70例携带HER-2胞内段酪氨酸激酶域突变的患者,ORR为71%,中位PFS为9.6个月,其中,49例携带YVMA插入突变的患者,ORR为78%,中位PFS为12.2个月;队列E的ORR、DCR、中位PFS分别为38%,71%和5.5个月;队列F的ORR、DCR和中位PFS分别为71%、89%和未达到。3级以上不良反应发生率为36%,31%和21%,较常见的为腹泻,发生率分别为23%、11%和5%。
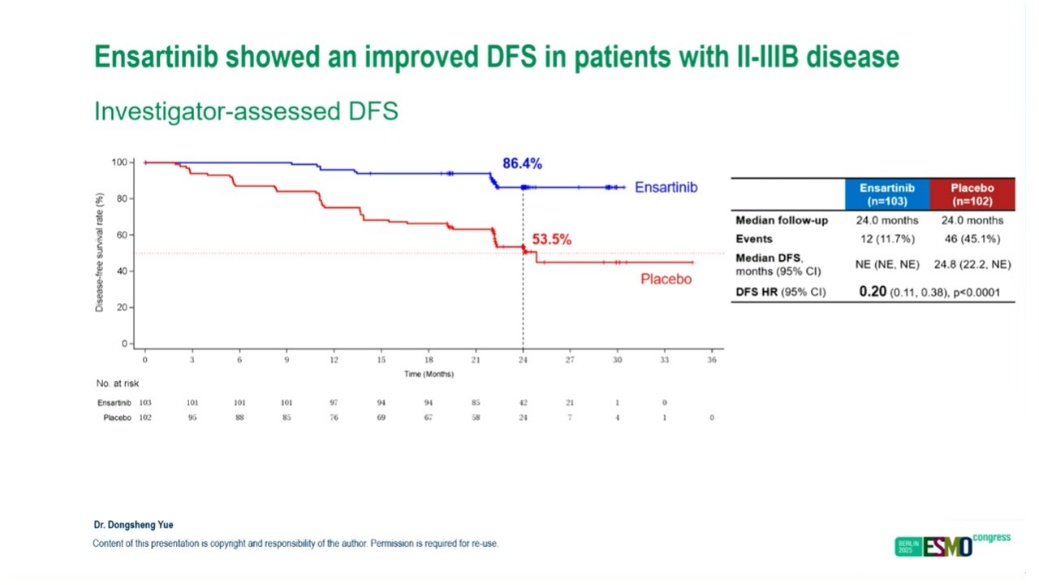
恩沙替尼术后辅助治疗ALK融合阳性NSCLC患者:III期ELEVATE研究研究(2025 ESMO)
该研究纳入年龄大于等于18周岁、接受R0切除的Ib到IIIb期(T3N2)NSCLC患者,患者接受术后辅助治疗,随后按1:1的比例随机分为安慰剂或标准剂量的恩沙替尼治疗,主要研究终点为DFS。最终,两组均入组137例患者,III期患者占比分别为40.9%和40.9%,中位DFS分别为未达到和24.8个月,HR=0.20,中位随访时间均为24.0个月。3-4级全因不良反应发生率分别为35.0%和16.8%,严重不良反应发生率分别为18.2%和10.2%。
瑞普替尼治疗ROS1融合阳性NSCLC患者长期随访数据(2025 WCLC)
该研究纳入局部晚期或转移性NSCLC患者,患者携带ROS1基因融合,无症状脑转移患者允许入组,符合入组标准的患者接受标准剂剂量瑞普替尼治疗。队列1为未接受ROS1-TKI患者,队列2为既往接受过ROS1-TKI治疗的患者。初治患者的ORR为79%,包括14%的患者出现CR;经治患者的ORR为41%,包括7%的患者出现CR。初治患者全组的中位OS为74.6个月,经治患者中位OS为20.5个月。
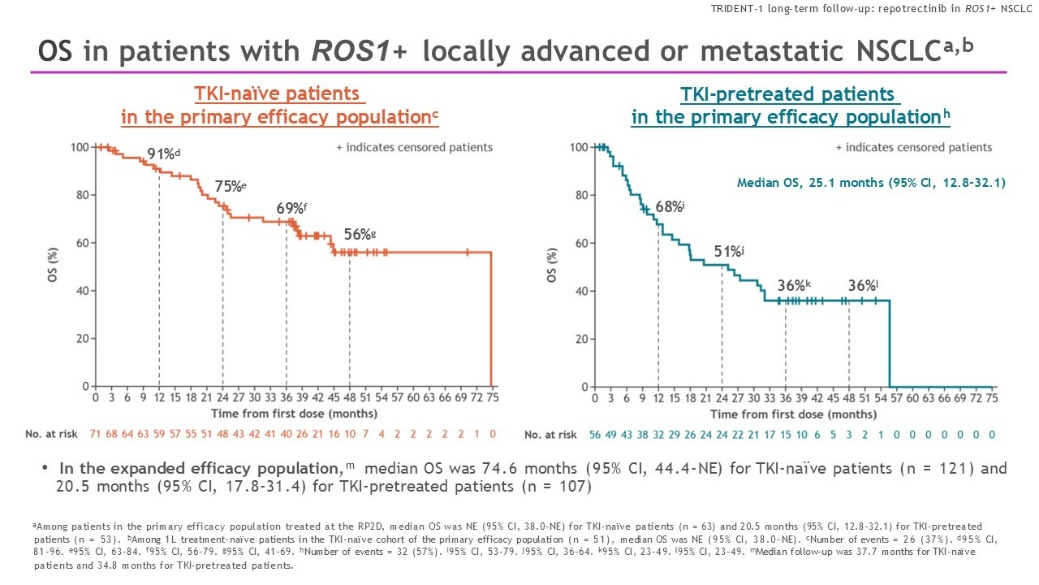 初治与经治患者的的OS
初治与经治患者的的OS
小结
今年,肺癌靶向治疗领域呈现“多点开花”的态势。从中国人群中突变频率较高的EGFR通路,到ALK、ROS1融合及KRAS等相对少见的靶点,多项研究成果的发布进一步充实了临床循证医学证据。纵观年度进展,研究方向主要集中在既有治疗模式的优化组合,以及成熟药物在不同细分人群中的应用探索。相比之下,本年度在全新作用机制的理论突破及原研药物转化方面稍显沉寂,这可能是今年靶向治疗领域美中不足的地方,却也正说明精准医学已进入深水区的关键阶段。
排版编辑:肿瘤资讯-HYF











 苏公网安备32059002004080号
苏公网安备32059002004080号


