肝细胞癌(HCC)作为全球发病率和致死率最高的恶性肿瘤之一,其临床预后不佳,主要受到肿瘤微环境(TME)中免疫抑制和免疫逃逸的挑战。巨噬细胞是 TME 中的关键免疫细胞,其通过 MHC II 类分子呈递肿瘤相关抗原,进而激活 Th1 细胞,启动抗肿瘤适应性免疫反应。然而,在 HCC 发生发展过程中,肿瘤细胞分泌的因子常会抑制巨噬细胞的抗原呈递功能,导致免疫缺陷和肿瘤免疫逃逸。因此,深入探索调控巨噬细胞抗原呈递过程中的关键分子,并开发增强其抗肿瘤免疫功能的新策略,对于 HCC 的免疫治疗至关重要。近期发表于 Cell Death and Disease 的一项研究,深入探讨了RNASEH2C阳性巨噬细胞如何通过调节抗原呈递过程影响肝细胞癌HCC的进展,并揭示了RNASEH2C-TRAF3IP1-RAI14轴在调控巨噬细胞抗原呈递中的关键作用,为肝癌免疫治疗提供了新的潜在靶点。【肿瘤资讯】特整理该研究精华,以飨读者。
研究背景
HCC微环境中的免疫抑制是导致免疫治疗耐药的主要原因之一。巨噬细胞作为TM)中丰度最高的免疫细胞群之一,其功能状态直接决定了抗肿瘤免疫的走向。虽然既往研究多聚焦于M1/M2极化状态,但巨噬细胞作为专职抗原呈递细胞(APC),其通过MHC II分子摄取、处理并呈递肿瘤抗原给CD4+ Th1细胞的能力,是启动特异性抗肿瘤免疫应答的基石。然而,肿瘤细胞常通过分泌IL-10、TGF-β等因子抑制这一过程。因此,寻找能够恢复或增强巨噬细胞抗原呈递功能的关键分子,对于突破现有免疫治疗瓶颈具有重要意义。
研究结果
RNASEH2C+巨噬细胞通过抑制mTOR通路促进肿瘤生长
通过对小鼠原发性HCC组织中的单核-巨噬细胞亚群进行单细胞RNA测序(scRNA-seq)分析,研究团队鉴定出了一群独特的非经典巨噬细胞亚群。这群细胞既不表达典型的M1标志物(如Cd86、Il6),也不高表达M2标志物(如Cd206、Tgfb1),而是以特异性高表达转录因子RNASEH2C为特征,因此被命名为Rnaseh2c+巨噬细胞。
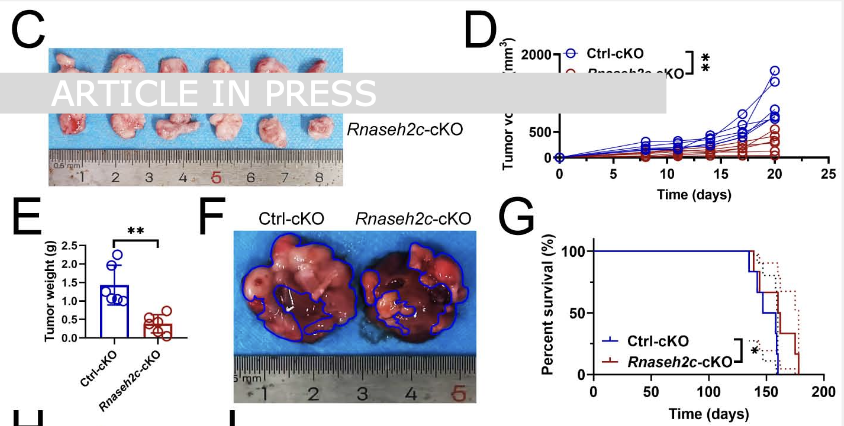
为了明确这群细胞的功能,研究构建了巨噬细胞特异性Rnaseh2c条件性敲除(cKO)小鼠。结果显示,在皮下移植瘤及原发性肝癌模型中,Rnaseh2c-cKO均显著抑制了肿瘤生长并延长了小鼠生存期(图1)。值得注意的是,即使在使用抗CD163抗体清除M2型巨噬细胞后,Rnaseh2c的敲除依然表现出显著的抗肿瘤效应,表明其促癌作用不依赖于M2巨噬细胞。进一步的信号通路分析发现,Rnaseh2c的缺失特异性激活了巨噬细胞中的mTOR信号通路,提示RNASEH2C可能通过抑制mTOR通路来发挥其免疫调节功能。
RNASEH2C通过上调TRAF3IP1抑制mTOR通路
为解析RNASEH2C调节mTOR通路的分子机制,研究者进行了转录组测序,发现Rnaseh2c-cKO显著下调了Traf3ip1基因的表达。作为RNASEH2复合物的一个亚基,RNASEH2C的主要功能是切除RNA/DNA杂合链(R-loops)。R-loops结构通常在转录过程中形成,可调控基因转录。通过DRIP-qPCR及体外转录实验,研究证实Traf3ip1启动子区域存在R-loop结构,而RNASEH2C能够通过消除这些R-loops来促进Traf3ip1的转录延伸,从而上调其表达。
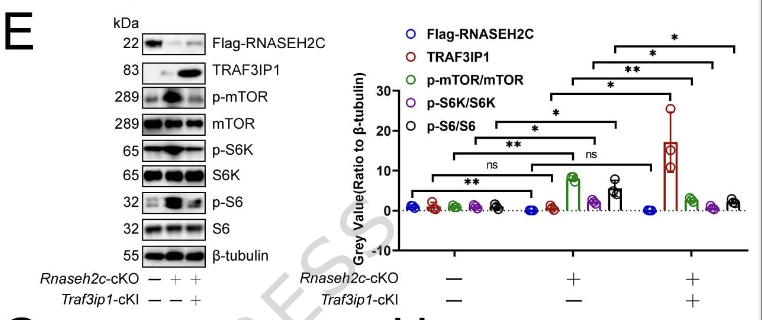
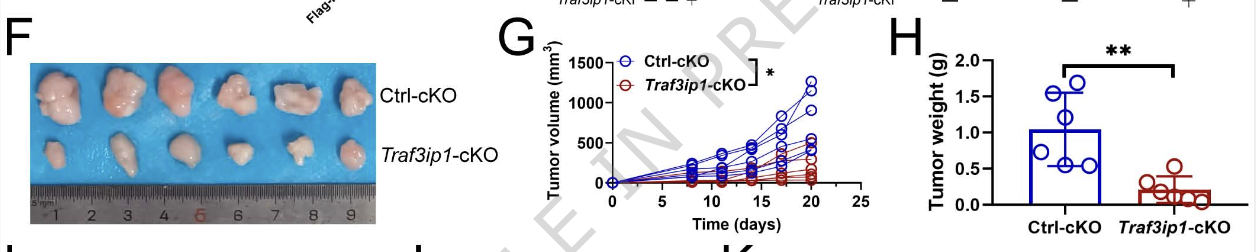
功能挽救实验表明,在Rnaseh2c-cKO巨噬细胞中回补TRAF3IP1可以逆转mTOR通路的激活。同时,巨噬细胞特异性敲除Traf3ip1同样能抑制肿瘤生长,而过表达RNASEH2C则能抵消这一效应(图2)。这一系列证据确立了RNASEH2C通过转录上调TRAF3IP1进而抑制mTOR通路的调控轴,这也是其促进肝癌进展的关键机制。
RNASEH2C-TRAF3IP1轴促进RAI14的溶酶体降解
mTOR通路是溶酶体活性的关键负调控因子。鉴于RNASEH2C抑制mTOR通路,研究团队推测其可能增强了某种关键蛋白的溶酶体降解,进而影响抗原呈递。通过对与溶酶体调节蛋白HSC70和CMTM6相互作用的巨噬细胞相关蛋白进行筛选,RAI14被鉴定为潜在目标。RAI14是一种细胞骨架蛋白,已知参与细胞内的物质运输。
实验结果显示,Rnaseh2c或Traf3ip1的敲除显著增加了巨噬细胞中RAI14的蛋白水平,但未改变其mRNA水平,提示调控发生在翻译后水平。使用溶酶体抑制剂(如氯喹CQ)处理可阻断RNASEH2C过表达导致的RAI14蛋白减少。这表明RNASEH2C-TRAF3IP1轴通过增强溶酶体活性,促进了RAI14的降解。在体内模型中,巨噬细胞特异性敲除Rai14显著加速了肿瘤生长,而同时敲除Rnaseh2c则可逆转这一促癌表型,证实RAI14是该信号轴下游的关键效应分子。
HSC70与CMTM6竞争性调控RAI14的稳定性
深入的机制研究发现,HSC70和CMTM6在RAI14的降解过程中扮演了截然相反的角色。HSC70作为分子伴侣,通常介导底物进入溶酶体降解;而CMTM6则常通过稳定膜蛋白来抑制其降解。研究发现,HSC70促进RAI14降解,而CMTM6则保护RAI14免受降解。
免疫共沉淀及截短体实验显示,HSC70和CMTM6竞争性结合RAI14的同一结构域。当CMTM6缺失时,RAI14与HSC70的结合增加,导致其被送往溶酶体降解。进一步研究表明,HSC70介导的RAI14降解并不依赖于经典的分子伴侣介导的自噬(CMA),而是通过内体微自噬(eMI)途径进行,这一过程依赖于TSG101和VPS4等ESCRT复合物成分。因此,CMTM6的存在对于维持RAI14的稳定性至关重要,它通过与HSC70竞争结合位点,阻止了RAI14进入eMI降解途径。
RAI14促进巨胞饮作用及抗原呈递
RAI14在巨噬细胞中的功能与其对抗原呈递的影响密切相关。研究发现,RAI14能够促进巨噬细胞的巨胞饮作用。巨胞饮是抗原呈递细胞摄取外源性抗原和回收膜表面MHC II分子的重要方式。
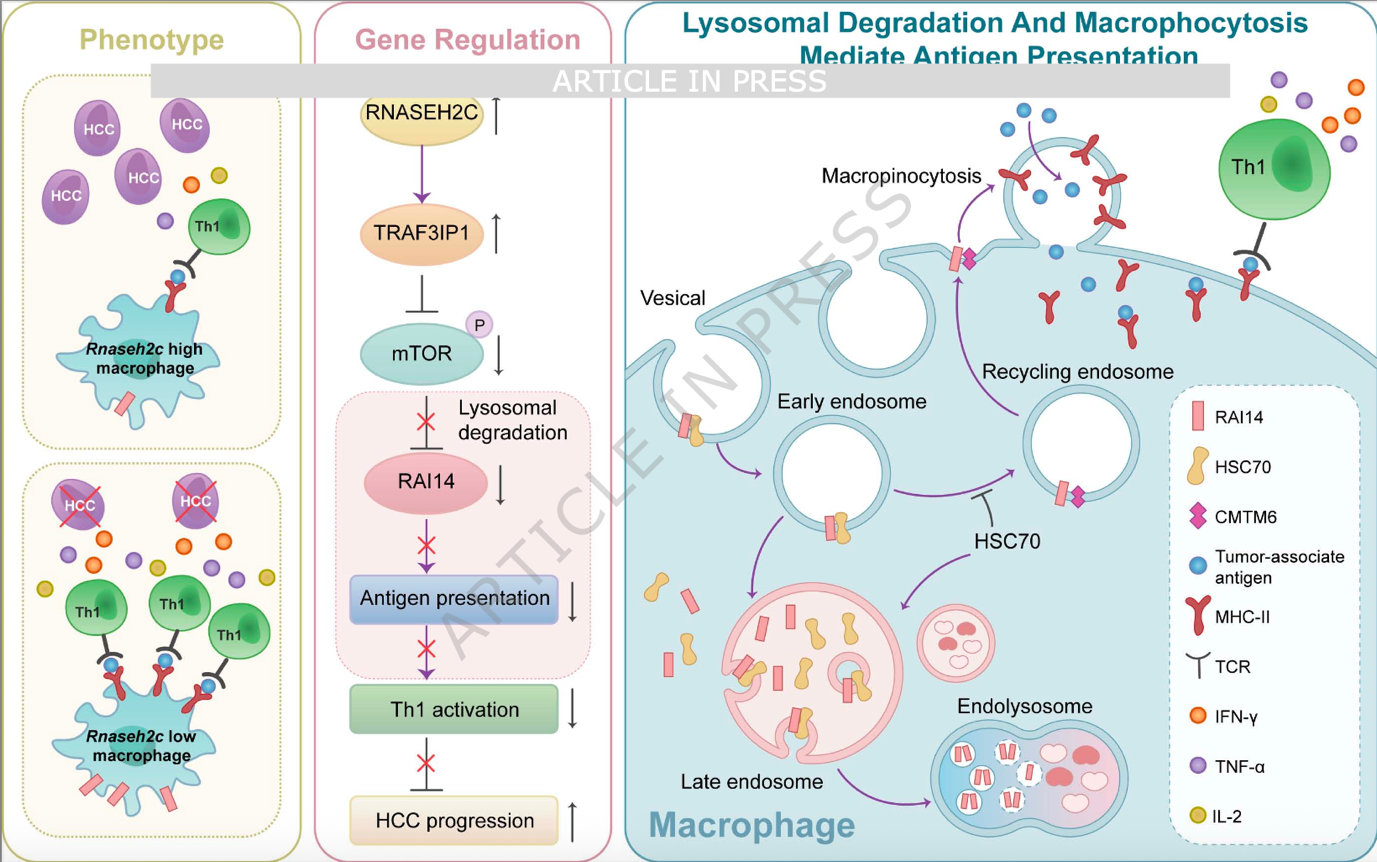
通过使用巨胞饮诱导剂MOMIPP及RAI14敲除小鼠,研究证实RAI14的缺失显著受损了巨噬细胞对MHC II分子的内吞以及对肿瘤相关抗原(如OVA肽)的摄取、处理和负载能力,最终导致CD4+ Th1细胞的激活受阻(表现为IFN-γ、TNF-α和IL-2分泌减少)。相反,Rnaseh2c或Traf3ip1的敲除则通过稳定RAI14,增强了巨胞饮作用和抗原呈递效率。这一发现揭示了“RNASEH2C-TRAF3IP1-mTOR-溶酶体-RAI14”轴在调控巨噬细胞抗原呈递功能中的核心地位。
靶向RNASEH2C增强免疫检查点抑制剂疗效
为了评估该发现的临床转化潜力,研究者利用人源化巨噬细胞构建了患者来源的异种移植(PDOX)模型。利用腺病毒载体在人巨噬细胞中敲除RNASEH2C,并联合使用抗PD-1或抗CTLA-4抗体进行治疗。
结果显示,单独敲除巨噬细胞中的RNASEH2C即可显著抑制肿瘤生长;而当其与免疫检查点抑制剂(ICI)联用时,抗肿瘤效果进一步增强,显著延长了荷瘤小鼠的生存期(图3)。此外,通过分析临床HCC患者的TIDE(肿瘤免疫功能障碍与排斥)评分数据,发现对免疫治疗有响应的患者其肿瘤组织中RNASEH2C表达水平显著较低。这表明,RNASEH2C不仅是一个潜在的预后标志物,更是提高HCC免疫治疗敏感性的有效干预靶点。

结论
本研究首次阐明了非经典Rnaseh2c+巨噬细胞在肝癌免疫逃逸中的作用机制。不同于传统的M1/M2分型,该亚群通过独特的代谢-细胞骨架调控网络抑制抗原呈递。研究不仅将RNASEH2C的功能从DNA修复扩展到了肿瘤免疫调节,还揭示了RAI14作为巨胞饮调节因子在抗原呈递中的关键作用。
尤其是发现HSC70与CMTM6对RAI14稳定性的竞争性调控,为理解蛋白质降解途径的精细调节提供了新视角。临床前模型中靶向RNASEH2C联合免疫治疗的显著疗效,为未来开发针对肿瘤相关巨噬细胞的新型免疫疗法提供了坚实的理论基础。未来的研究可进一步筛选针对RNASEH2C或TRAF3IP1的小分子抑制剂,以期在临床上通过重塑巨噬细胞功能来攻克肝癌的免疫耐药难题。
Pan, B., Yu, H., Lin, Z. et al. RNASEH2C enhances TRAF3IP1 to degrade RAI14 in lysosomes thus hindering macrophage antigen presentation and advancing liver cancer. Cell Death Dis 16, (2025). https://doi.org/10.1038/s41419-025-08305-5
审批编号:CN-174990
过期日期:2026-12-17
声明:本材料由阿斯利康提供支持,仅供医疗卫生专业人士参考
排版编辑:肿瘤资讯-Sally











 苏公网安备32059002004080号
苏公网安备32059002004080号


