2025年11月18日,备受瞩目的学术盛会“MDT中外面对面(泰国站)”顺利开幕。会议汇聚上海交通大学附属胸科医院陆舜教授团队、帕拉波克拉医院Passakorn Wanchaijiraboon教授团队、华中科技大学同济医学院附属同济医院张莉教授团队和浙江大学医学院附属第二医院夏旸教授团队等国内外顶尖肺癌研究团队,聚焦肺癌免疫治疗的前沿进展,深度剖析当前的诊疗实践与未来研究趋势,有力促进该领域的国际学术交流与发展方向探索。【肿瘤资讯】特别整理会议精华内容,以飨读者。

晚期NSCLC免疫治疗联合化疗——病例分享

本病例由帕拉波克拉医院Passakorn Wanchaijiraboon教授分享,具体诊疗过程如下:
病史资料
67岁女性
因“慢性咳嗽”就诊。
患者自述近数月来持续咳嗽,无其他明显伴随症状。
2021年12月胸部CT检查意外发现右肺占位性病变,遂进一步诊治。
辅助检查
影像学检查:
胸部增强CT(2021-12-21):右肺中叶及右肺下叶前基底段巨大软组织密度肿块,大小约6.8×6.3×8.5cm,边界不清;右肺上叶及下叶多发磨玻璃结节(最大1.0cm),考虑肺内转移;纵隔及双侧腋窝多发淋巴结融合肿大;左侧肾上腺见0.9×0.8cm低密度结节,可疑转移。气管及主支气管通畅,无胸腔积液,无骨破坏。
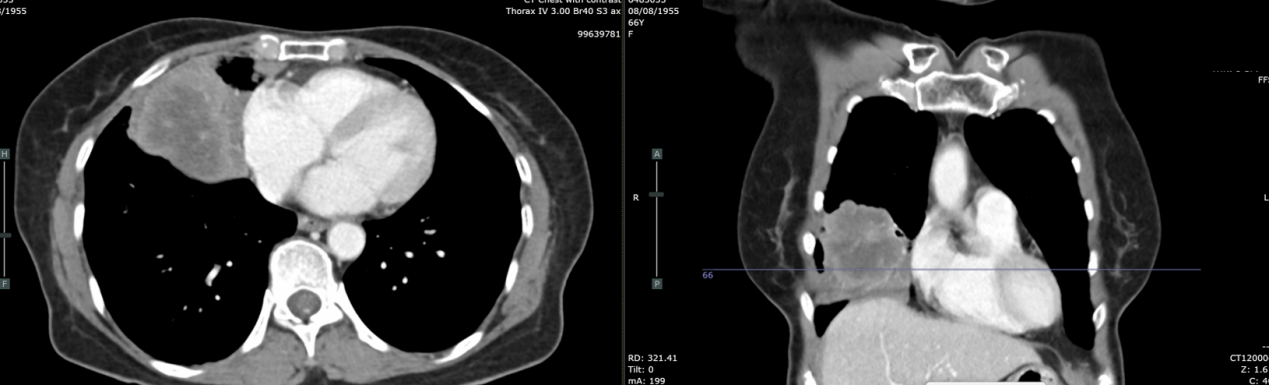
复查CT(2022-03-07):肿块增大至8.9cm,伴阻塞性肺炎,多发淋巴结最大达3.4cm。
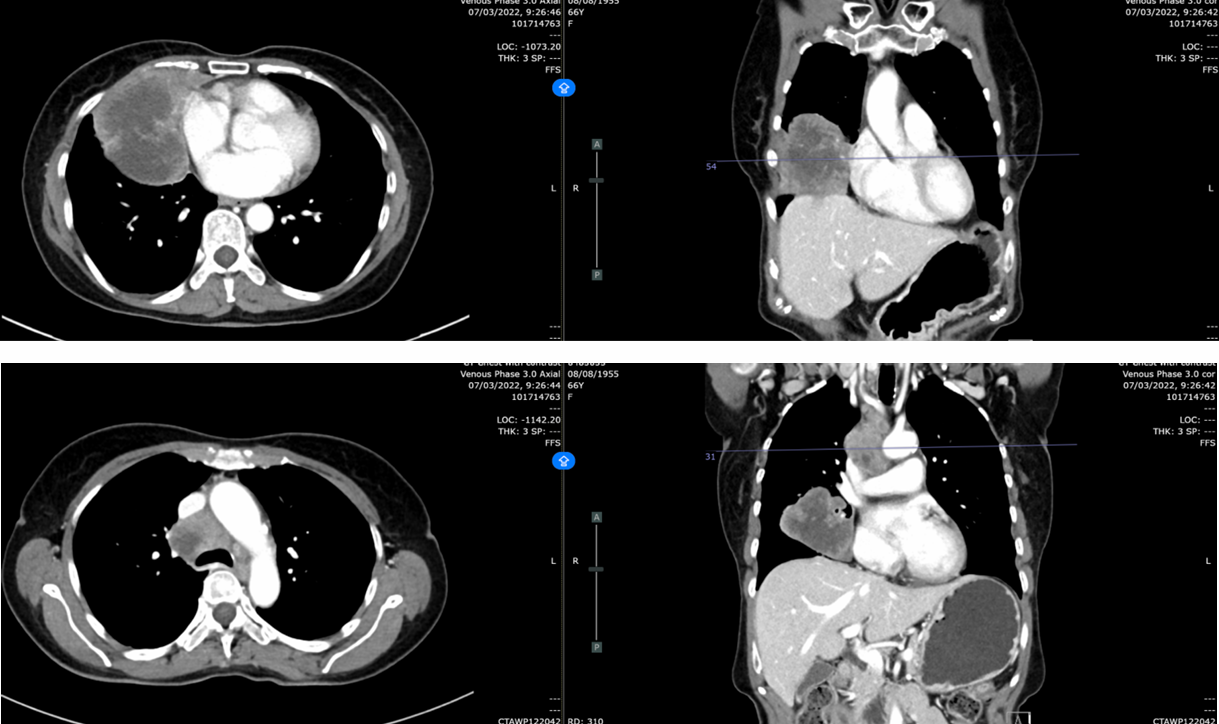
复查CT(2022-04-05):肿块进展至9.4×7.7×7.1cm,侵犯右侧叶间裂、膈肌、胸壁及心包(脂肪间隙消失)。右肺多发纯磨玻璃结节0.4-1.0cm,考虑原位腺癌或非典型腺瘤样增生。纵隔淋巴结分布于右肺门、隆突下、右上及下气管旁区域,以及左上气管旁区域,最大3.3cm(隆突下)。
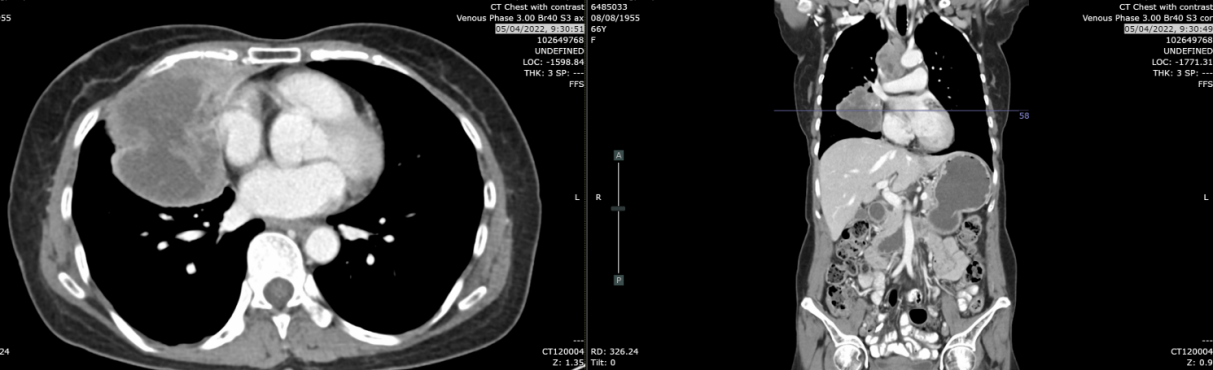
头颅MRI(2022-10-2):脑轴位T1增强扫描未见脑转移灶。
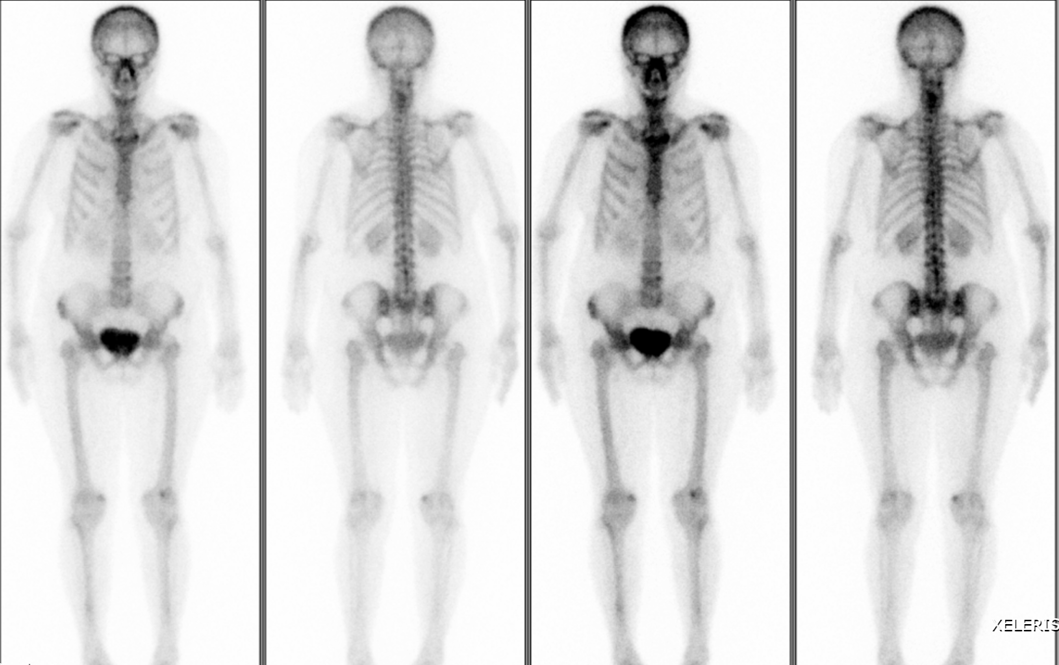
骨扫描:全身骨显像未见骨转移征象。
病理学与分子检测:
2022年1月20日CT引导下肺穿刺活检:病理诊断为腺癌。免疫组化:CK7(+)、CK20(-)、TTF-1(+)、P40(-)、Napsin A(+),支持肺来源。
EGFR基因突变检测(组织):未检测到目标EGFR区域突变(EGFR野生型)。
临床诊断
右肺腺癌(cT4N3M1b,IV期)
诊疗经过
1. 一线治疗(202-03至2022-08):
方案:卡铂+吉西他滨化疗6周期
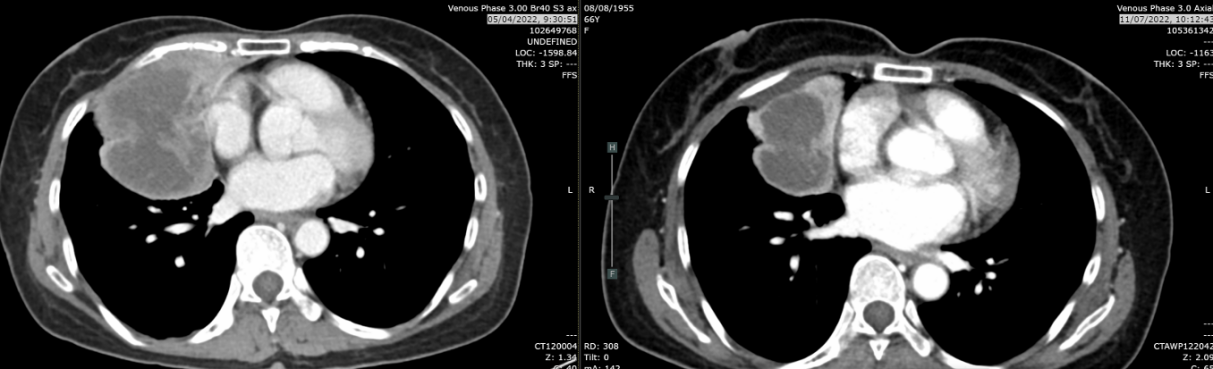
疗效评价:复查CT(2022-07-11),肿块从9.4cm缩小至5.4cm,评估为部分缓解(PR),肺内转移灶及纵隔淋巴结均较前缩小。
2. 二线治疗(2022-09至2022-11):
方案:卡铂+紫杉醇+阿替利珠单抗化疗4周期
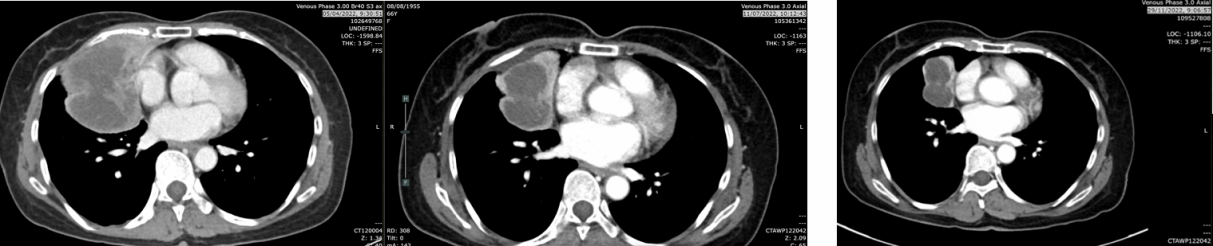
复查CT(2022-11-29):肿块5.2cm(缩小),仍维持PR状态,肺内结节缩小至0.5cm,淋巴结部分缓解并出现坏死性改变。
3. 维持治疗与局部放疗(2022-12至2023-10):
阿替利珠单抗单药维持治疗:自2022-12-07起,共完成11周期,期间病灶持续缩小。
复查CT(2023-02-21):肿块5.3cm,仍维持PR状态。
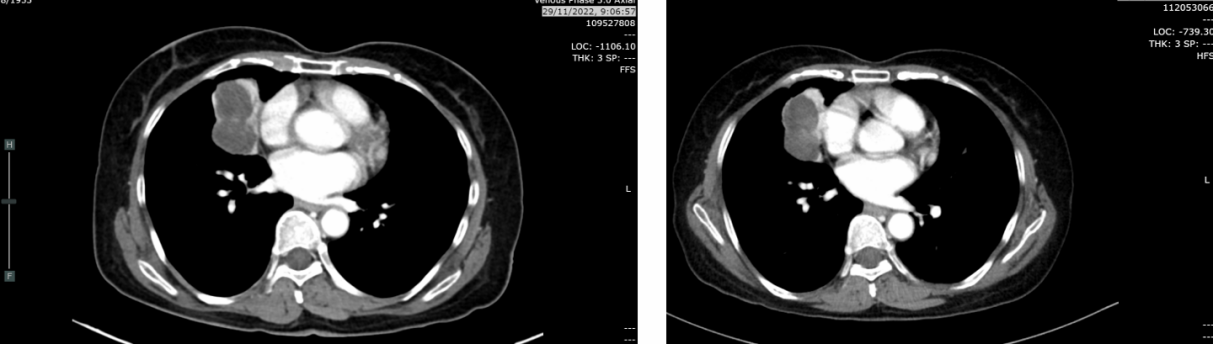
复查CT(2023-05-19):肿块4.3cm,淋巴结缩小至0.8cm,无肝/肾上腺转移。
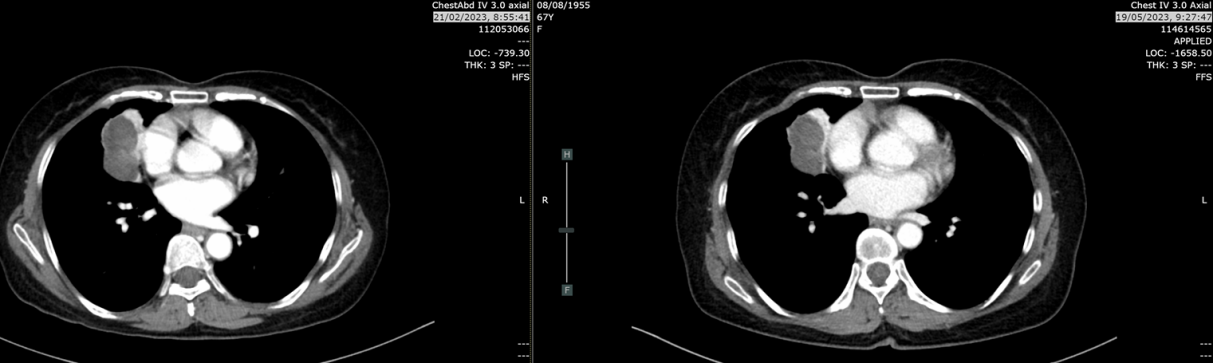
局部放疗:2023-7-31针对右肺原发灶行姑息性放疗30Gy/10Fx。
继续阿替利珠单抗维持治疗第12-16周期至2023-10月,后停药观察。
4. 停药后随访与长期生存:
复查CT(2023-12-19):CT示肿块轻度增大至4.1cm(较7月增长24%),右肺上、中、下叶新见牵拉性支气管扩张及实变影,鉴别诊断包括浸润性转移、感染或混合性肺不张/实变。无肝、肾上腺、淋巴结或骨转移。
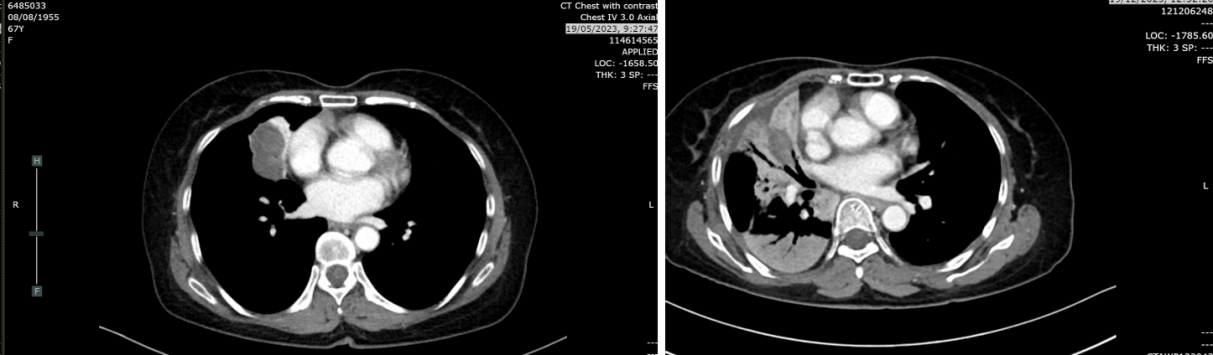
2024年3月21日:肿块缩小至2.8cm,实变及结节较前减少,考虑肺转移灶部分消退。
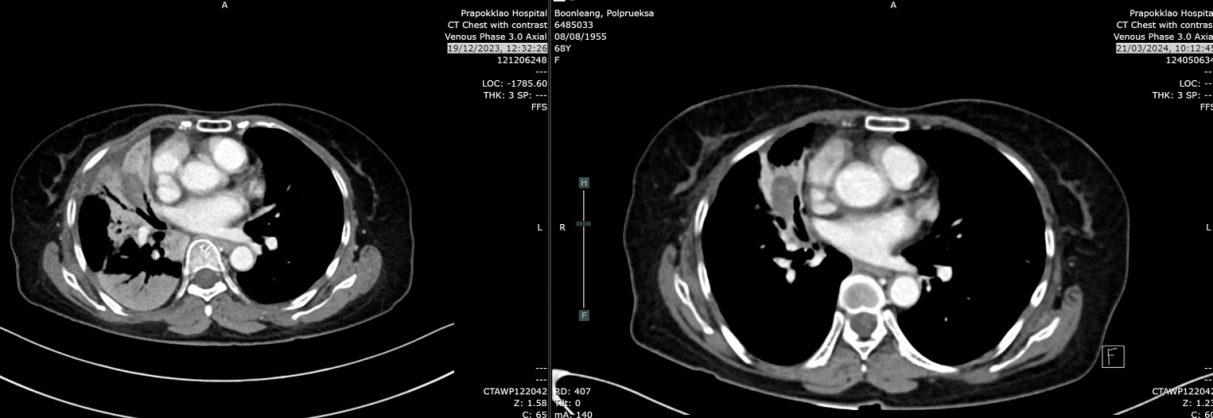
2024年6月17日:肿块略增至2.9cm,亚厘米级淋巴结。
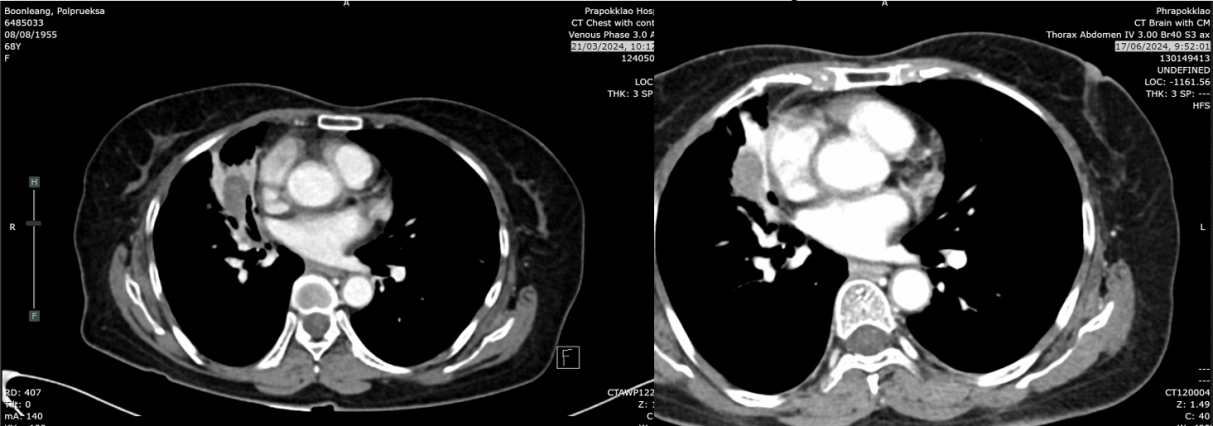
2025年8月26日:肿块2.2cm,右肺上叶、中叶结节0.3-0.4cm稳定,中叶新增磨玻璃影(考虑感染或炎症),无新增转移灶。
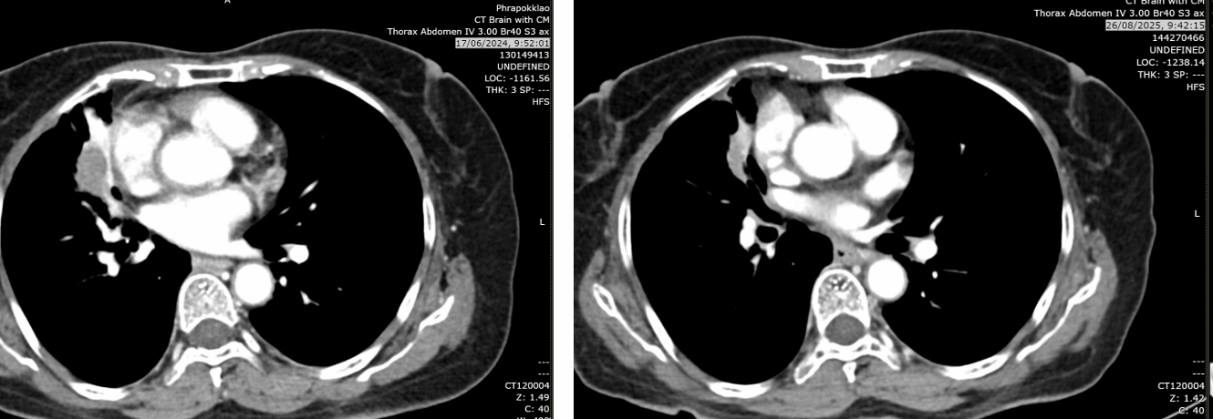
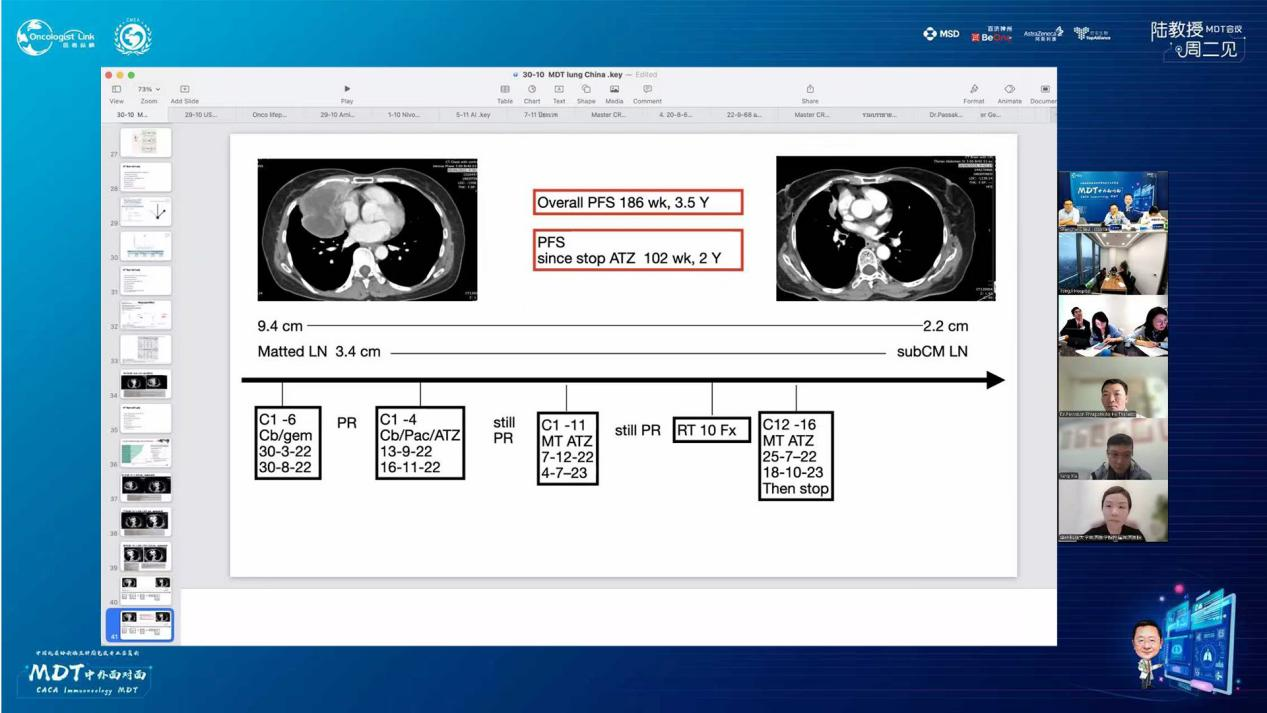
疗效总结:自治疗开始计算,无进展生存期(PFS)达186周(3.5年);自停药后计算,PFS为102周(2年)。
本病例讨论点:
1. 阿替利珠单抗维持治疗是否应持续进行?
2. 原发病灶如果展,应该采取手术治疗还是其他治疗方式?
华中科技大学同济医学院附属同济医院张莉教授:放疗联合免疫治疗已成为重要探索方向,在序贯策略方面,我们略有差异:本病例先行肺野照射、免疫维持近一年后再补原发灶放疗;我们则倾向予1–4周期化疗+免疫诱导,待评效达PR后,针对原发灶实施精准放疗。鉴于放疗后约半年放射性肺炎风险升高,全程须强化影像与肺功能动态监测,及时捕捉亚临床损伤并微调后续系统治疗,以兼顾疗效最大化与毒性最小化。
浙江大学医学院附属第二医院夏旸教授:放疗时机在寡转移/寡进展NSCLC的治疗决策中起决定性作用;对于已接受免疫联合化疗且双肺病灶不可切除的寡进展患者,我倾向于立即以立体定向放疗(SBRT)等精准局部手段干预,而非仓促切换全身方案。临床实践中,此类病例常继续原免疫维持满2年,通过规律PET-CT监测实现“长期稳定带瘤”——一旦确认寡进展,即刻补以放疗,可显著延长PFS并保留后续系统治疗选择,最终达成持久疾病控制与生存获益。
上海交通大学附属胸科医院李子明教授:首先,在突变检测方面,针对女性NSCLC患者,已将包含NGS在内的多基因谱检测纳入常规诊疗路径;其次,在系统治疗基础上,我们主张择机整合局部干预:当患者出现寡进展时,尽早加用SBRT或转移灶切除术,可凭高水平循证证据进一步延长其总生存。
上海交通大学附属胸科医院陆舜教授:本病例的原发结节仅约1cm,但伴周围淋巴结肿大,建议对肿大淋巴结活检以确认是否为转移;目前对如此微小病灶的免疫治疗(如能否完全缓解)经验有限,可先行免疫联合化疗诱导减瘤,诱导后应尽早启动同步放化疗而非仅作维持,以谋求最大获益。本病例在基础放疗剂量下即取得显著退缩,后续出现轻微增大时改用新化疗联合免疫治疗。值得注意的是,患者已接受多周期卡铂,远超常规,虽目前耐受及疾病控制良好,但远期毒性需警惕。原发灶进展考虑手术;远处转移可局部放疗;因患者对免疫治疗缓解良好,应持续给予免疫治疗,并建议此刻即与外科讨论手术可行性。

本病例由华中科技大学同济医学院附属同济医院张莉教授分享,具体诊疗过程如下:
54岁男性患者,因“发现左下肺肿物3个月”入院。患者2021-02于当地医院体检,PET/CT提示左肺下叶肿物。支气管镜活检病理示:(左肺下叶后基底段)鳞状细胞癌。2021-02月至2021-04,于当地医院行吉西他滨+铂类方案化疗3周期,未联合免疫治疗。治疗后为进一步诊治来我院,患者强烈希望接受手术治疗。发病以来,患者精神、食欲可,体重无明显变化。
临床诊断
左肺下叶鳞状细胞癌(cT2aN2M0,IIIA期)
诊疗经过
第一阶段:初始治疗(2021-05至2021-07)
手术治疗:2021-05-10日行左肺下肺叶袖式切除+系统性淋巴结清扫术。术中见肿物侵犯下叶支气管开口,肺动脉与支气管粘连明显,肺门、隆突下及纵隔淋巴结肿大。术后病理证实为ypT2aN2M0 R1,IIIA期鳞癌。
术后同步放化疗:2021-06-12至2021-07-14,行胸部放疗(CTV 50Gy/25次,局部加量至60Gy/30次),同步予顺铂增敏化疗。
第二阶段:复发及局部治疗(2022-07至2023-01)
首次复发:2022年7月,放疗后1年复查发现右肺结节,当地医院予以奥希替尼靶向治疗(基于术后EGFR 19del突变)。
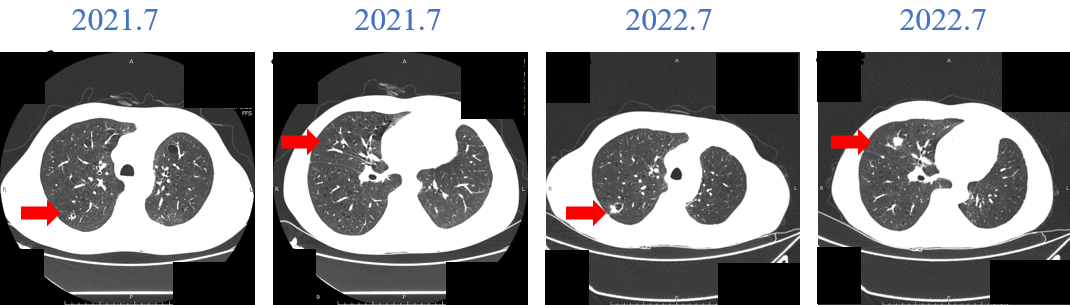
局部进展:2022-11复查示右肺结节较前稍增大。2022-11-15日至2022-11-27行胸部SBRT,GTV1及GTV2处方剂量50Gy/5次。
SBRT后评估:2023年1月复查,右肺结节较前缩小。
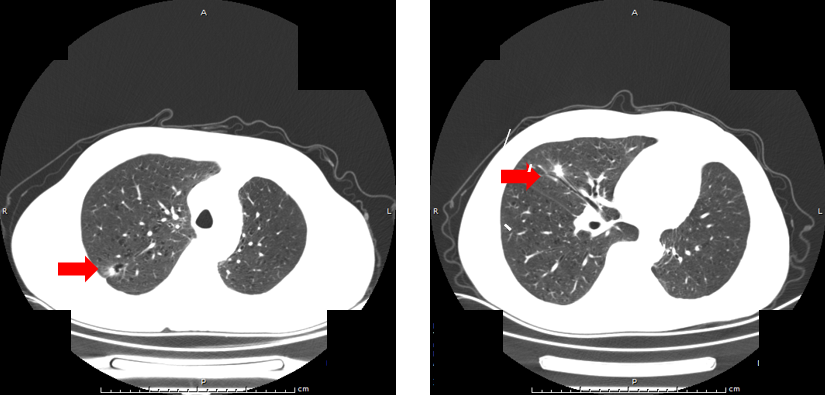
第三阶段:系统治疗转换(2023-04月至2024-6月)
疾病进展:2023年4月复查示右肺结节再次增大。行肺活检及基因检测,未检出敏感基因突变,PD-L1表达15%。
化疗联合免疫治疗:2023年4月至6月,予紫杉醇+铂类方案联合免疫治疗4周期,后于2023-07至2024-06月行免疫治疗单药维持。
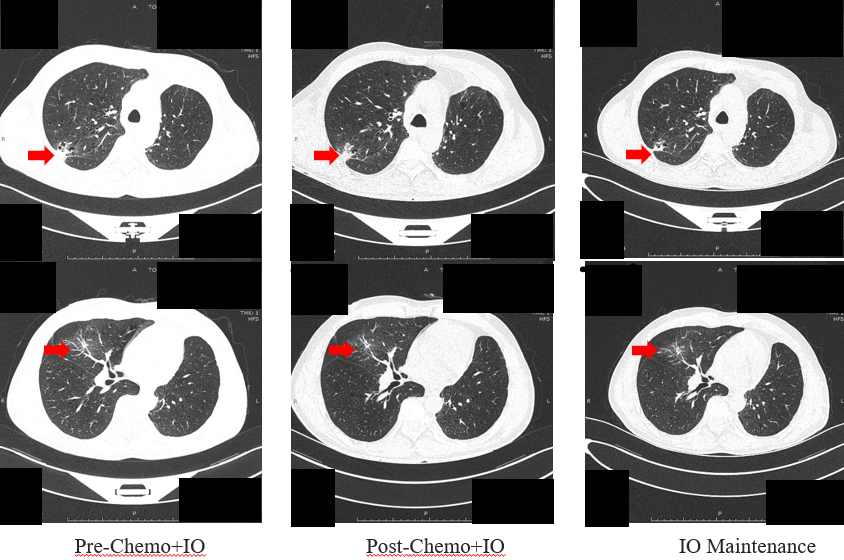
第四阶段:寡进展局部干预(2024-06月–至今)
寡进展:2024-06复查示右肺结节进展(寡进展)。
经MDT讨论,决定行手术治疗。
二次手术:2024-06-23行胸腔镜右中肺叶切除+右上肺部分切除+右下肺部分切除+淋巴结清扫+胸膜粘连松解术。术后病理证实为低分化鳞癌,EGFR突变阴性,PD-L1 15%,各切缘及淋巴结均为阴性。
术后免疫维持:2024-06至2025-06,术后继续免疫治疗维持1年。期间复查未见肿瘤复发转移征象。
本病例讨论点:
1.2次手术治疗的价值是什么?
2. EGFR-TKI对EGFR突变肺鳞癌患者(尤其PD-L1阳性)可1带来哪些获益?
3. 术后辅助免疫治疗具有哪些意义?是否应继续免疫治疗?

帕拉波克拉医院Passakorn Wanchaijiraboon教授:患者因肺癌接受2次术后,基因检测示EGFR突变阳性且PD-L1高表达,由此引出关键临床问题——术后是否应延续免疫治疗?若辅助免疫治疗已满1年,是否仍需继续?完成1年辅助免疫治疗后通常可考虑停药,但仍需结合EGFR突变亚型细致评估。对此类患者,术后EGFR-TKI辅助治疗在达到既定疗程后亦可谨慎终止。鳞癌患者无论PD-L1表达状态如何,似乎均可能从EGFR-TKI治疗中获益。
浙江大学医学院附属第二医院夏旸教授:我曾表过相关文章,旨在明确EGFR突变在此类患者治疗策略中的定位。该研究首先将患者分为“EGFR突变型鳞癌”与“EGFR野生型鳞癌”,随后从临床疗效与分子特征展开分析。基因层面结果显示,EGFR突变型鳞癌的分子谱与EGFR突变腺癌高度相似,而与野生型鳞癌差异显著;疗效层面,突变型鳞癌与突变型腺癌的客观缓解率(ORR)相近,但中位PFS约腺癌的一半左右——在当年使用第一代EGFR-TKI的队列中,EGFR突变型鳞癌患者的中位PFS约5个月左右,而EGFR突变型腺癌可达12个月左右。
上海交通大学附属胸科医院艾星浩教授:患者首次手术达R1切缘,推测与术前支气管镜活检评估不足、肿瘤浸润范围及负荷判断偏差相关,导致手术策略欠精准;首次复发时,联合放疗可延长局部控制,应视为合理干预而非失误,并建议立即行第2次支气管镜活检以明确转移状态、指导后续决策;至于术后辅助免疫治疗,鉴于患者已获深度缓解,目前无证据显示其可进一步获益,故倾向停置或不予追加,维持现有方案即可。
上海交通大学附属胸科医院陆舜教授:首先澄清“同步放化疗”定义:患者此前虽完成3周期吉西他滨,但后续若仅予低剂量顺铂或吉西他滨联合放疗,则非全剂量标准同步方案,疗效不可等同标准治疗;推测首次手术为R1切除,对年轻患者,术后应推荐含足量化疗的辅助放化疗,而非低剂量妥协,若患者意愿强烈,可考虑进一步升级策略。其次,关于“鳞癌伴EGFR突变”获益:初治NGS示鳞癌背景伴低丰度EGFR突变,晚期阶段EGFR-TKI因毒性低可替代化疗,早期辅助可探讨化疗+EGFR-TKI,但其后二次手术标本已转野生型,故既往突变信息仅供参考。
晚期EGFR突变NSCLC多线治疗——病例分享
本病例由浙江大学医学院附属第二医院赵菁教授分享,具体诊疗过程如下:
病史资料
52岁女性患者,因右上肺肿块1周入院。在外院例行体检,胸部CT示:右肺尖段肿块伴双肺多发结节。平素体健,无高血压、糖尿病等慢性病;无肿瘤家族史;无吸烟及被动吸烟史;月经史及婚育史无特殊。
辅助检查
胸部CT(2020-08-05):右上肺尖段巨大肿块,伴两肺多发结节。
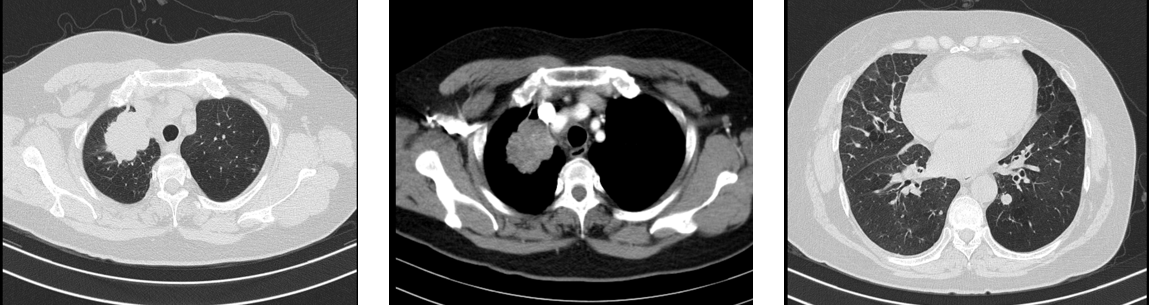
病理诊断(2020-08-05):肺腺癌。
基因检测:EGFR 19del突变。
临床诊断
肺腺癌伴双肺转移(cT2N2M1,IV期)。
诊疗经过
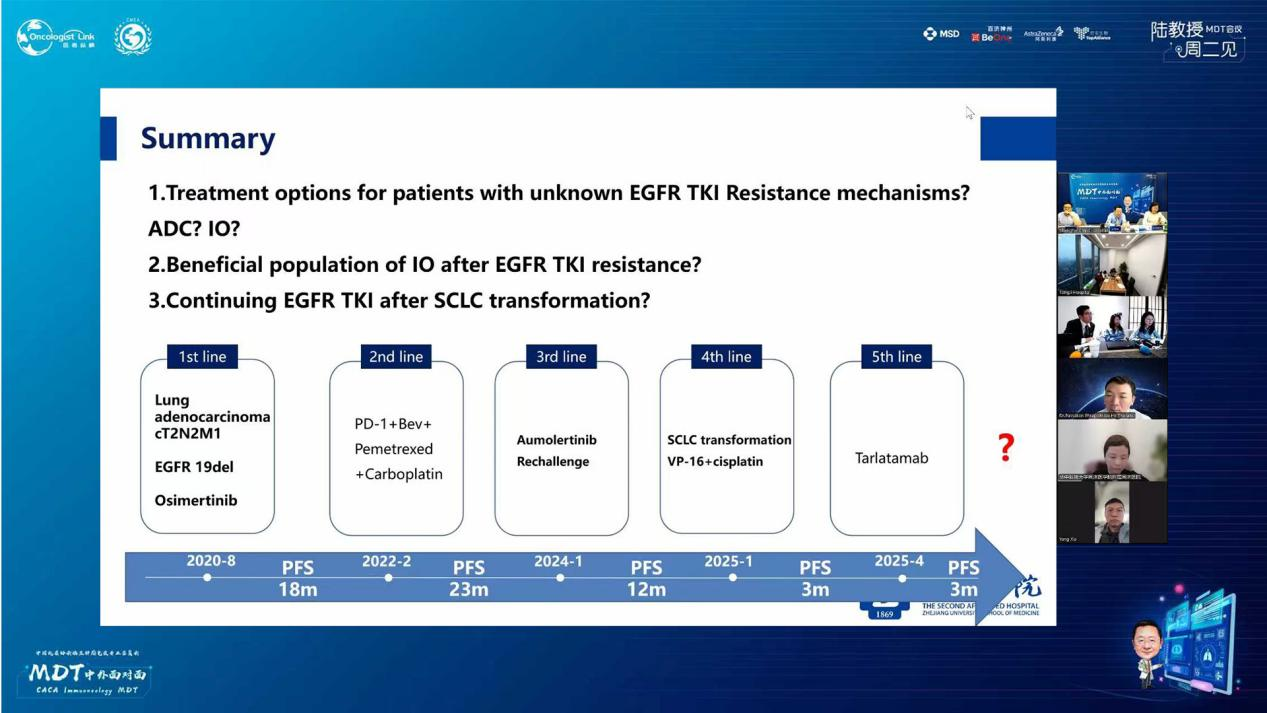
一线治疗(2020-08至2022-02)
方案:奥希替尼80mg QD
疗效评价:PR
PFS:18个月
胸部CT(2022-02):右上肺病灶较前增大,肺内转移灶进展。
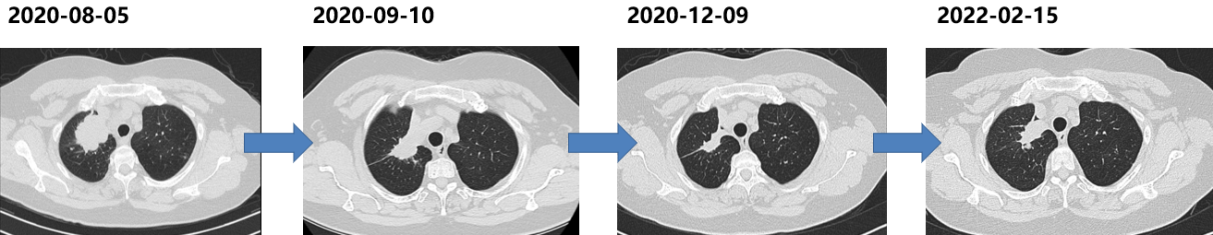
二次活检病理(2022-02-15):肺腺癌。
基因检测:EGFR 19del突变(未发现T790M或其他耐药突变)。
二线治疗(2022-02至2024-01)
依据:耐药机制不明,参考ORIENT-31研究模式。
方案:
诱导期:PD-1单抗+贝伐珠单抗+培美曲塞+卡铂,共6周期。
维持期:PD-1单抗+贝伐珠单抗+培美曲塞。
PFS:23个月。
胸部CT(2024-01-31):肺部病灶进展。
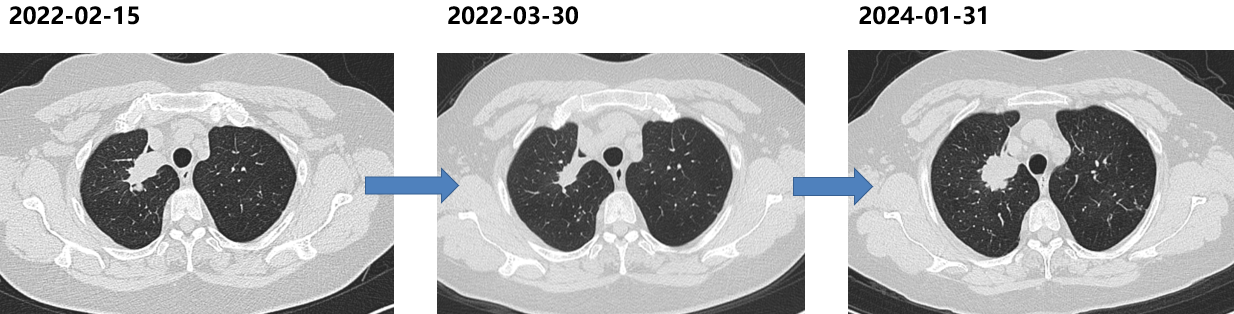
三次活检病理:肺腺癌。
基因检测:EGFR 19del突变。
三线治疗(2024-01至2025-01)
依据:再次活检仍提示腺癌且EGFR 19del阳性,考虑EGFR-TKI再挑战。
方案:
药物:阿美替尼110mg QD。
胸部CT和脑MRI(2025-01-30):肺部病灶进展,右侧脑转移病灶。
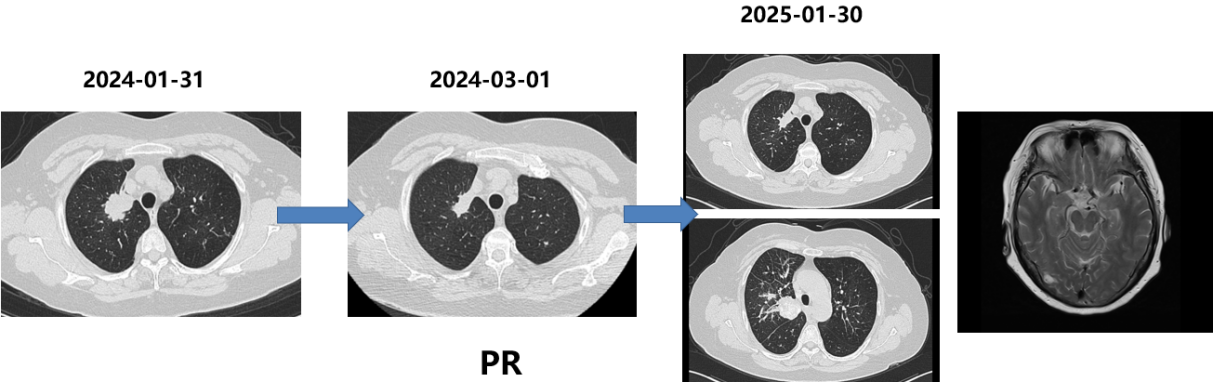
局部治疗放疗(2025-01-30开始):
右侧脑转移灶:SRT,PTV D95/30Gy/5F。
肺部病灶及纵隔淋巴引流区:IMRT(调强放疗),PGTV 60Gy,PTV 54Gy/30F。
胸部CT(2025-03-15):肺部病灶明显增大,实变范围扩大。
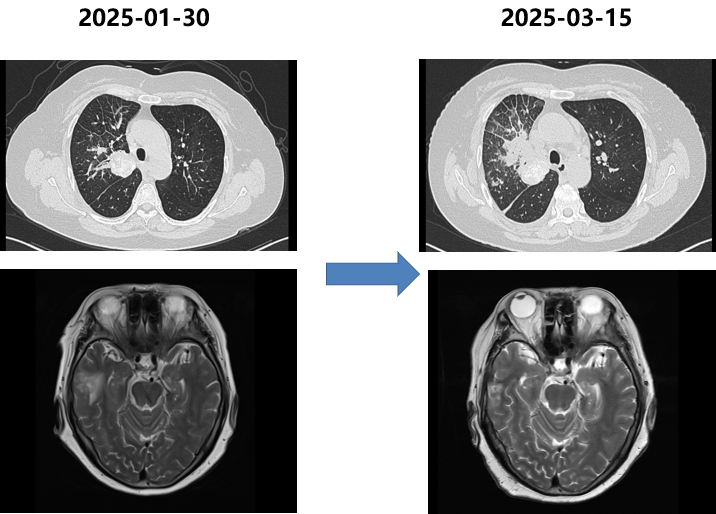
四次活检病理:小细胞神经内分泌癌。
免疫组化:TTF-1(SPT24)(+),NapsinA(-),CK5/6(-),p40(-),INSM1(+),Synaptophysin(突触素)(+),Chromogranin A(嗜铬粒蛋白A)(+),CD56(+),RB1(缺失),p53(+),Ki-67(50%+),SMARCA4/BRG1(+),INI1/SMARCB1(+)。
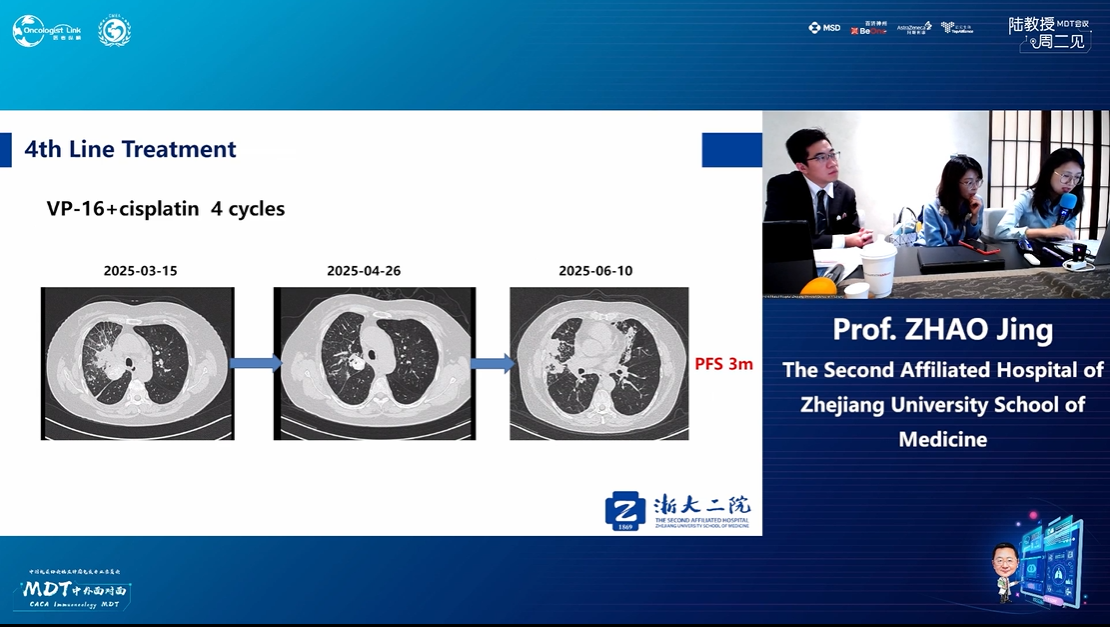
四线治疗(2025-04至2025-06)
依据:病理证实转化为SCLC。
方案:依托泊苷+顺铂,共4周期。
PFS:3个月。
胸部CT(2025-06-10):病灶再次快速进展。
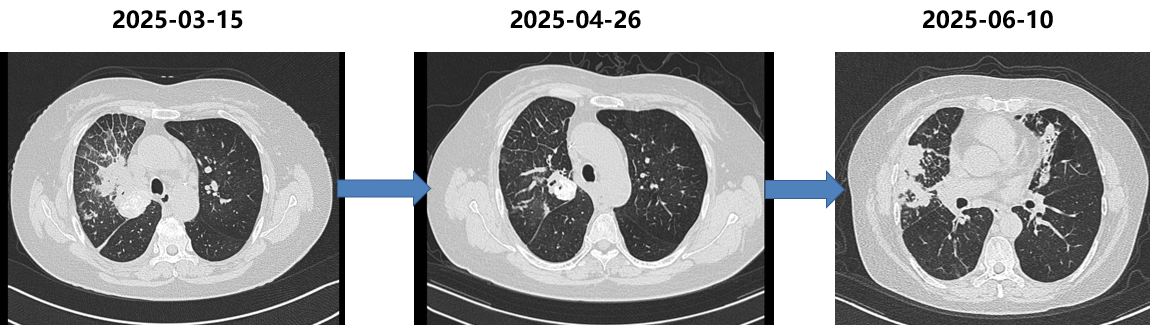
五线治疗(2025-06至今)
依据:SCLC后线治疗,DLL3靶点药物。
方案:塔拉妥单抗1mg D1,10mg D8,D15(阶梯给药)。
PFS:3个月
胸部CT(2025-09-24):病灶再次出现进展。
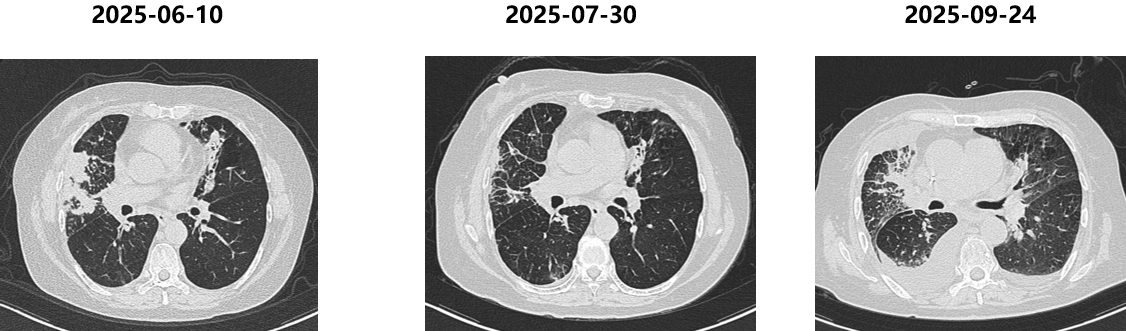
本病例讨论点:
1.EGFR-TKI耐药机制不明患者的治疗选择ADC药物还是免疫治疗?
2.EGFR-TKI耐药后接受免疫治疗的获益人群有哪些?
3.发生SCLC转化后,是否继续使用EGFR-TKI?
帕拉波克拉医院Passakorn Wanchaijiraboon教授:本病例为EGFR突变晚期NSCLC患者,在经EGFR-TKI治疗并出现SCLC转化后,首先启用DLL3靶向双特异性抗体塔拉妥单抗治疗;若条件允许再次活检并进行组织学及分子学评估,可据此精准调整后续策略,同时亦可将拓扑替康等标准化疗方案纳入考量,作为替代或联合手段以优化疗效。
华中科技大学同济医学院附属同济医院张莉教授:本病例接受多线治疗后获得长期PFS,患者很可能属于某种“融合型”分子亚群,可同步从EGFR-TKI与免疫治疗中获得持久缓解,其长期疗效亦印证这一点。对于此类SCLC患者,通过局部干预先行控制局灶病灶,同样有望复制类似的长生存获益;后续仍需密切监测脑转移等潜在播散风险。
上海交通大学附属胸科医院艾星浩教授:对于耐药机制尚未阐明的患者,我院正在开展一项前瞻性Ⅱ期研究,评估“化疗+免疫检查点抑制剂+抗血管生成药物”三联合方案在获得性耐药人群中的疗效与安全性;遗憾的是,目前尚未锁定可精准预测获益的分子标志物,后续需通过单细胞测序、ctDNA动态监测及多组学整合分析进一步挖掘潜在生物标志物。其次,该患者后续治疗选择仍较充裕,除传统含铂双药化疗外,亦可考虑安罗替尼。
上海交通大学附属胸科医院李子明教授:对于EGFR-TKI耐药机制尚未阐明的患者,一线治疗决策尤为关键,TROP2 ADC已积累充分循证数据,为后续治疗奠定坚实基础。其次,EGFR-TKI耐药后哪些亚群可从免疫治疗切实获益仍待明确,尽管部分患者可见PFS延长,但尚缺乏可精准筛选优势人群的组织学与分子特征;临床上已有EGFR-TKI耐药后联合VEGF抑制剂或免疫治疗的探索性研究,其结果有望指导个体化方案。针对发生SCLC转化的患者,是否保留EGFR-TKI尚无共识,在充分评估毒性-获益后尝试EGFR-TKI联合化疗。
上海交通大学附属胸科医院陆舜教授:EGFR-TKI耐药机制主要包括EGFR依赖性二次突变(如C797S)、旁路激活(如MET扩增)及组织学转化(如SCLC转化)。对于EGFR-TKI耐药后T790M阴性且PD-1阳性患者,优先推荐信迪利单抗+贝伐珠单抗+化疗四药联合(ORIENT-31研究显示PFS显著获益)。SCLC转化型耐药中,DLL3高表达(≥75%阳性)亚型可能对DLL3靶向药物敏感,需以DLL3表达为分子准入标准,联合ATR/CHK1或BCL-2抑制剂尚处临床试验阶段。
总结
本期举办的“MDT中外面对面(泰国站)”学术会议上,国内外肺癌领域的权威专家齐聚一堂,针对免疫与靶向治疗的最新演变及MDT模式的深化应用展开多维度的剖析。会议研讨的核心涵盖晚期NSCLC免疫治疗联合化疗、IIIA期NSCLC多线治疗、晚期EGFR突变NSCLC多线治疗,极力推崇基于精准医学的个体化诊疗与MDT协作模式。未来的治疗突破将依托于免疫与靶向药物的深度融合、化疗联合免疫方案的优化设计,以及基于基因组学图谱的精准决策。此次会议不仅为临床复杂病例的处置提供坚实的循证支持,指明科研新方向,更深刻印证MDT在肺癌全病程管理中的核心地位。
排版编辑:肿瘤资讯-Vickey











 苏公网安备32059002004080号
苏公网安备32059002004080号


