胃癌作为我国发病率和死亡率均高居前列的瘤种,其治疗策略和理念不断发展,改变了临床治疗格局。临床医生需持续跟进前沿动态,以指导临床实践。在山东大学齐鲁医院“齐肿内科大查房”第185期活动中,山东大学齐鲁医院的李松教授对2025年6~7月间发表于高影响因子期刊的13项胃癌重磅研究进行了系统性梳理与解读。本次分享涵盖了抗HER2、免疫检查点抑制剂、新兴靶点(Claudin18.2、DKK1等)及非靶向治疗等多个领域,为我们精准把握胃癌治疗的未来方向提供了清晰的“路线图”。
山东大学齐鲁医院肿瘤内科 副主任医师 副研究员
山东大学齐鲁医学院 副教授 硕士生导师
美国内布拉斯加大学医学中心病理系博士
山东大学齐鲁医学院博士后
山东省齐鲁卫生健康杰出青年
CSCO “35 under 35”优秀青年肿瘤医师
山东免疫学会肿瘤分子标志物与靶向治疗专业委员会秘书长
山东免疫学会肿瘤分子标志物与靶向治疗协会青年工作组副主委
抗HER2治疗新进展
近期胃癌抗HER2领域中新型双特异性抗体泽尼达妥单抗(Zanidatamab)的系列研究备受关注。此外,将免疫疗法引入HER2阳性胃癌围手术期治疗也已成为探索热点。
机制方面,泽尼达妥单抗因其能同时结合HER2两个不同结构域,理论上具备更强的阻断效应。近期发表于Nature Communications的一项I期研究,评估了泽尼达妥单抗在经治HER2表达晚期胃癌患者中的安全性与初步疗效。结果显示,该药物无论单用或联合化疗均展现出良好的安全性和抗肿瘤活性。联合组≥3级治疗相关不良事件(TRAE)更高(51% vs 17%),但主要为化疗相关毒性,无治疗相关死亡,安全性可控。疗效方面,单药客观缓解率(ORR)达32.1%,联合化疗后提升至48.6%,中位无进展生存(PFS)两组分别为3.6个月和7.3个月。在经治HER2表达胃癌中,尤其HER2高表达(IHC3+)人群,泽尼达妥单抗联合化疗展现显著抗肿瘤活性。
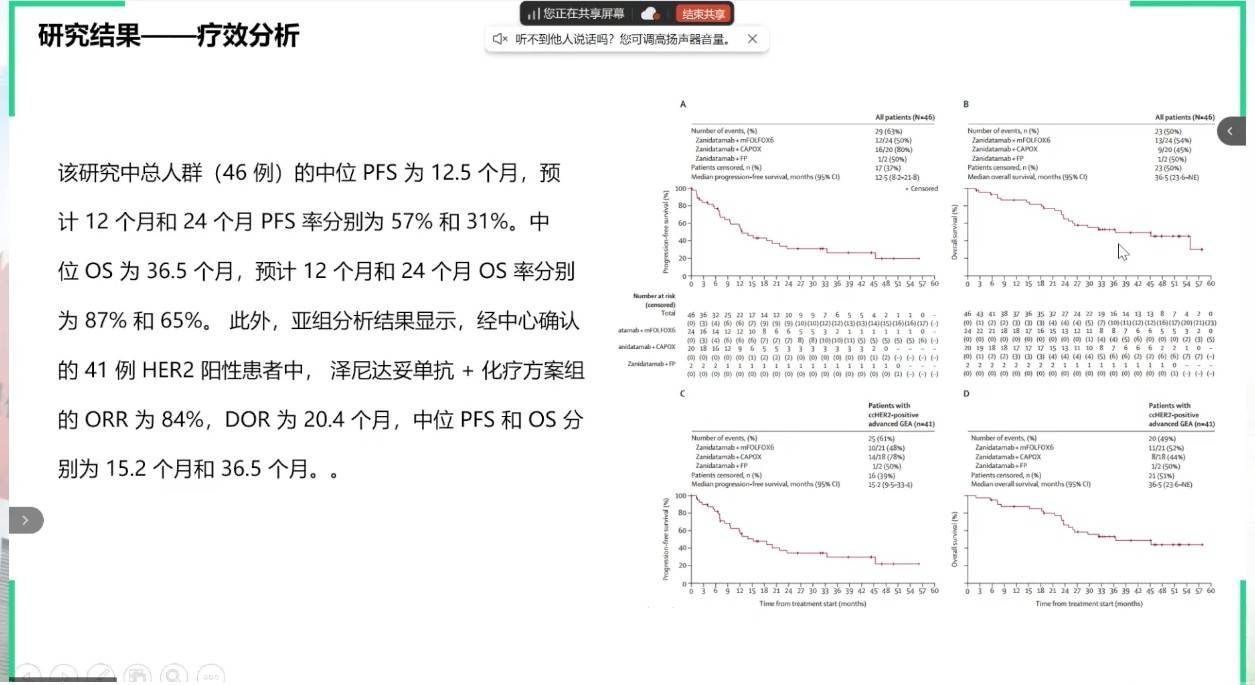
另一项发表于Lancet Oncology的II期研究,进一步评估了泽尼达妥单抗联合化疗一线治疗晚期胃癌的潜力。该方案取得了令人振奋的疗效,在42例可评估疗效的患者中,确认的ORR高达76.2%,而在中心确认为HER2阳性患者中ORR达84%。总人群的中位PFS为12.5个月,中位总生存期(OS)达36.5个月。基于该II期研究结果,研究团队进一步开展了HERIZON-GEA-01(NCT 05152147)研究。这是一项全球性、III期随机临床研究,旨在评估泽尼达妥单抗+化疗联合或不联合PD-1抑制剂替雷利珠单抗对比曲妥珠单抗+化疗一线治疗HER2阳性晚期胃癌的疗效和安全性差异。
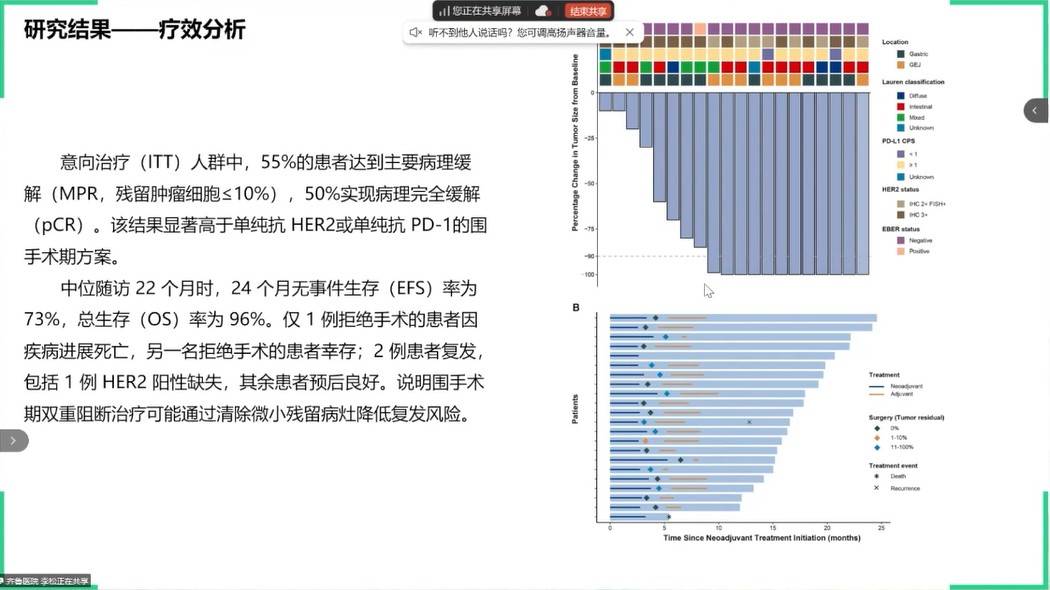
在HER2阳性胃癌围手术期治疗领域,两项研究探索了将免疫检查点抑制剂前移的价值。一项发表于JAMA Oncology上的随机II期研究显示,在曲妥珠单抗联合化疗的基础上,加入抗PD-L1单抗阿替利珠单抗进行围术期治疗,可将局晚期HER2阳性的胃癌患者病理完全缓解(pCR)率从曲妥珠单抗联合化疗组的14.3%,显著提升至38.1%(P=0.08),该研究为HER2阳性局部晚期胃癌患者提供了新的围手术期治疗选择,为临床实践提供了重要参考。
另一项单臂II期研究中,采用了信迪利单抗+曲妥珠单抗+SOX方案的三联围术期方案,也获得了高达50%的pCR率。这两项研究共同提示,在围术期阶段引入免疫治疗,是深化HER2阳性胃癌病理缓解的有效途径。
抗免疫检查点治疗的研究深化
免疫检查点抑制剂在胃癌中的应用,正从广泛探索阶段迈向精准化与个体化。
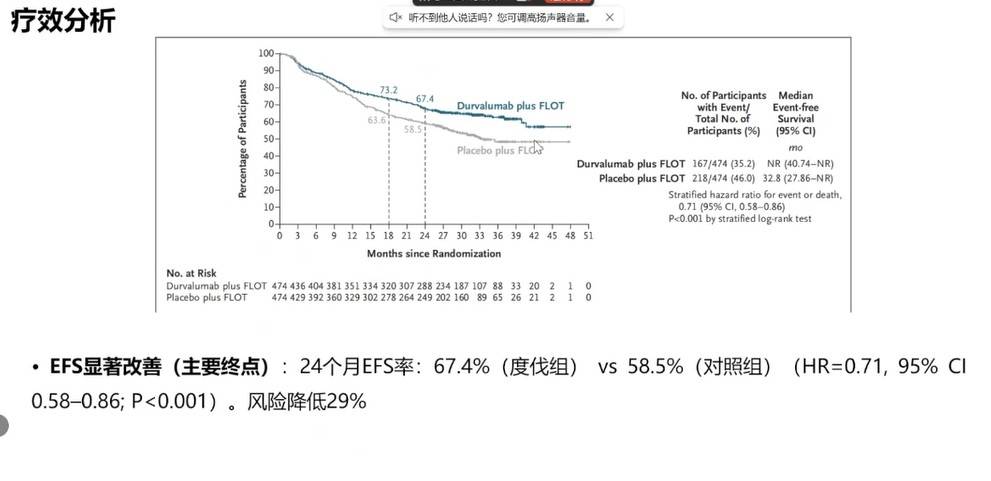
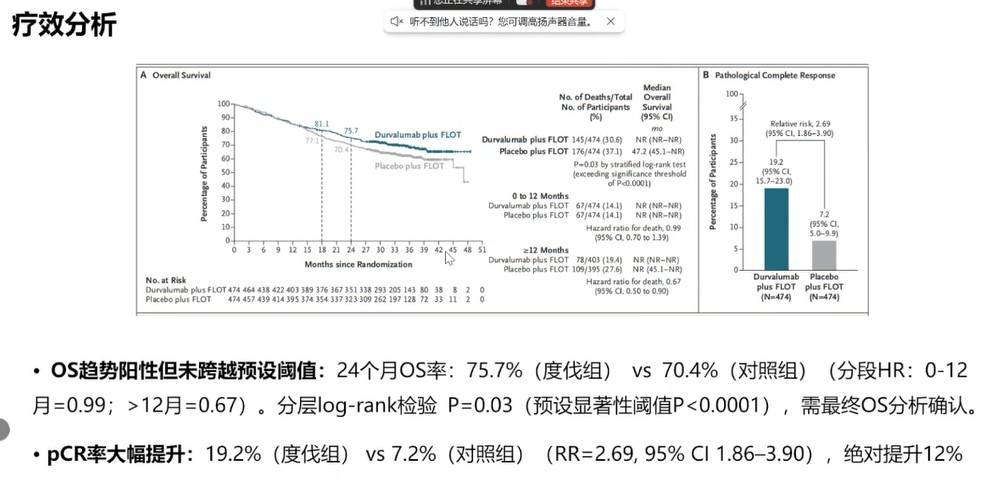
MATTERHORN研究对胃癌围手术期FLOT标准化疗方案进行了优化。这项III期研究证实,在FLOT方案中加入抗PD-L1单抗度伐利尤单抗,可显著改善可切除胃癌或胃食管结合部癌患者的无事件生存期(EFS),24个月EFS率分别为67.4% vs 58.5%(HR=0.71),风险降低29%;同时将pCR率从7.2%提升至19.2%,为围手术期治疗的升级提供了高级别证据。
一篇发表于JCO的重磅Meta分析,为胃食管癌(GEA)免疫治疗的精准人群选择提供了指引。该研究通过整合已发表和重建的生存数据,精细分层后得出结论:免疫联合化疗显著改善晚期胃食管癌生存,尤其在高PD-L1表达(GEA CPS≥1;ESCC TPS≥1%)和MSI-H患者中。低PD-L1表达GEA患者(CPS<1)获益有限,ESCC患者获益较少依赖PD-L1;亚洲患者绝对生存更优,但ICI相对获益与全球一致。
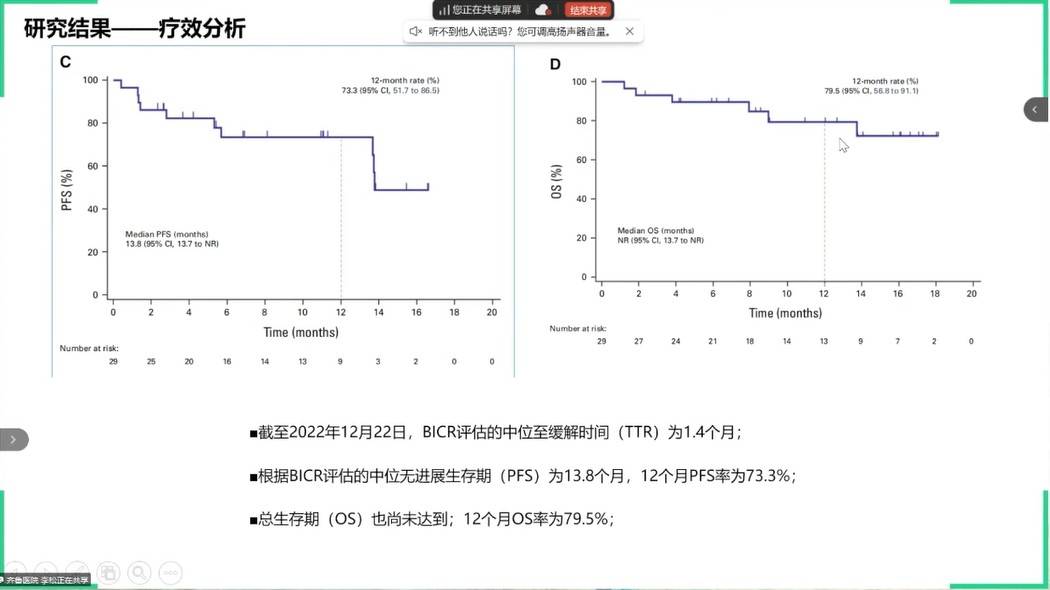
针对MSI-H这一免疫优势人群,发表于JCO的NO LIMIT研究探索了“去化疗”的一线双免方案(纳武利尤单抗+低剂量伊匹木单抗)治疗晚期胃癌或胃食管结合部癌的疗效,确认的ORR为62.1%,疾病控制率(DCR)为79.3%,且疗效持久。中位PFS为13.8个月,中位OS尚未达到。再次确立了双免在这一群体的应用潜力。
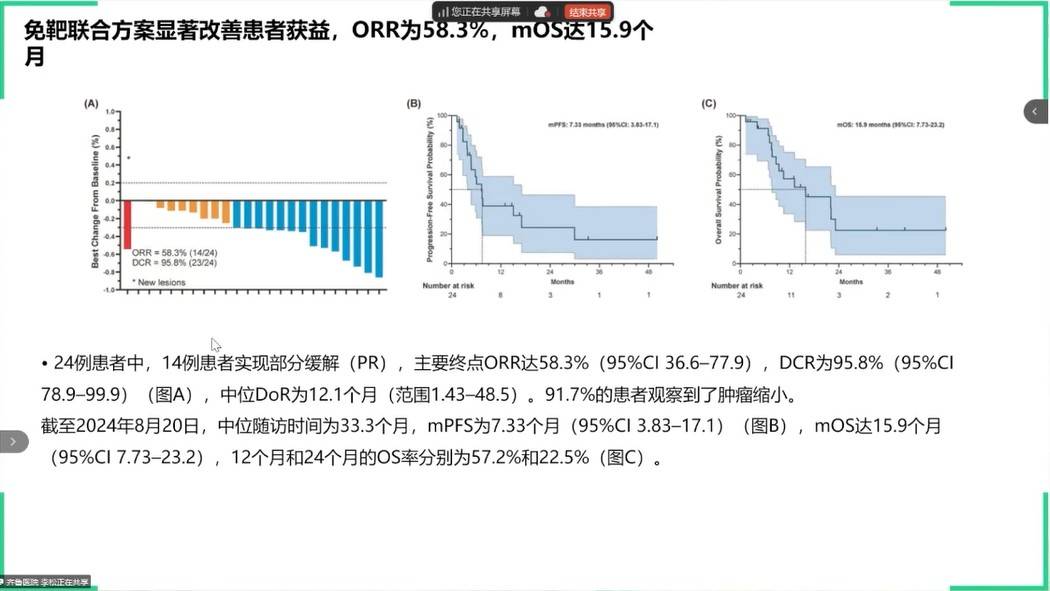
对于临床常见的“体力状况欠佳(ECOG PS 2分)”晚期胃癌患者,APICAL-GC研究验证了“安罗替尼+特瑞普利单抗”去化疗方案作为一线治疗的可行性。该方案取得了58.3%的ORR和15.9个月的中位OS,其疗效数据与强壮患者接受标准免疫联合化疗方案相当,为特殊人群提供了重要的治疗选择;同时也验证了"体能状态匹配策略"的可行性。
此外,基于CheckMate 649研究的大样本生物标志物分析,通过WES和RNA测序等技术,揭示了除PD-L1和MSI状态外,肿瘤微环境的基因表达特征(如血管生成、基质和MAPK信号等)也与免疫疗效密切相关,为理解疗效差异和开发新标志物提供了方向。
新兴靶点治疗的探索
抗Claudin18.2 CAR-T疗法
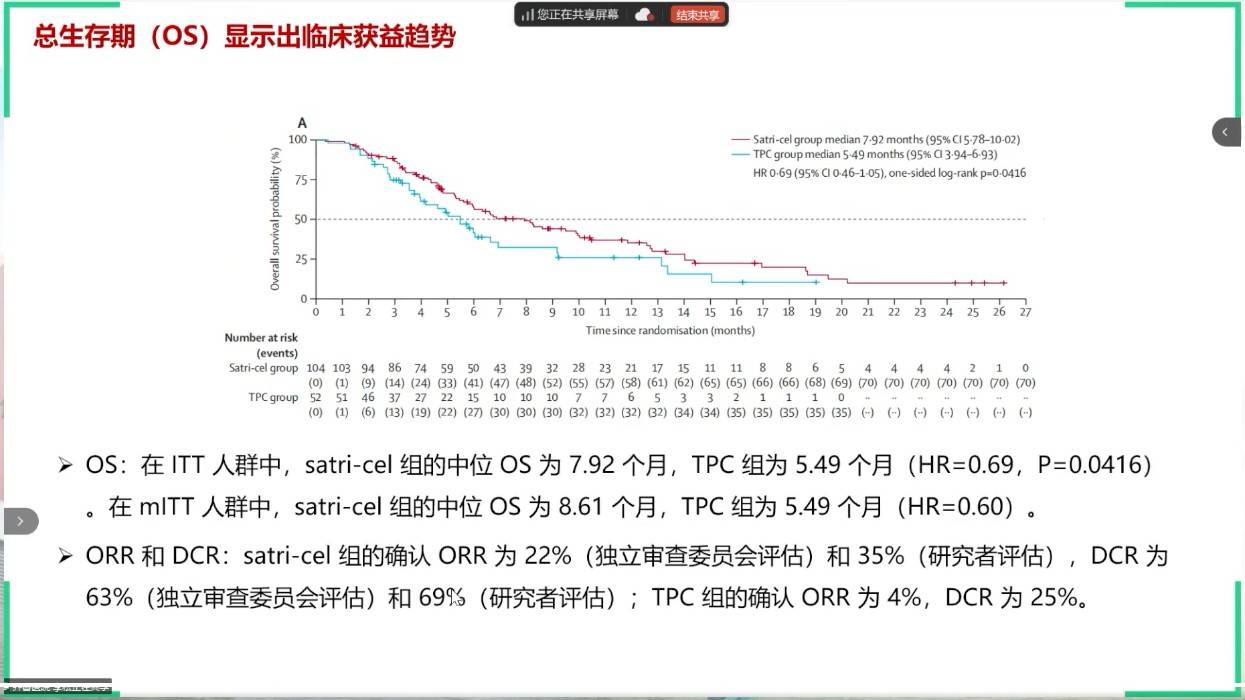
具有里程碑意义的CT041-ST-01研究,是全球首个在实体瘤领域取得成功的随机对照CAR-T试验,发表于Lancet。在经多线治疗的Claudin18.2阳性胃癌患者中,名为satri-cel的CAR-T疗法,相较于标准治疗,显著改善了PFS,并展现出有临床意义的OS获益,将ORR从4%提升至22%。该研究为实体瘤细胞治疗领域带来了重大突破。
抗DKK1治疗
DKK1是一种与免疫抑制相关的蛋白。一项评估抗DKK1抗体DKN-01联合替雷利珠单抗二线治疗DKK1高表达胃食管腺癌的II期研究显示,该方案安全性良好,整体中位PFS和中位OS分别为1.4个月和8.2个月,在PD-L1阳性亚组中的获益更为明显。其PFS曲线呈现出典型的“拖尾效应”,提示该策略可能使一部分患者获得长期获益。
非靶向治疗的优化与挑战
RINDBeRG研究:雷莫西尤单抗再挑战
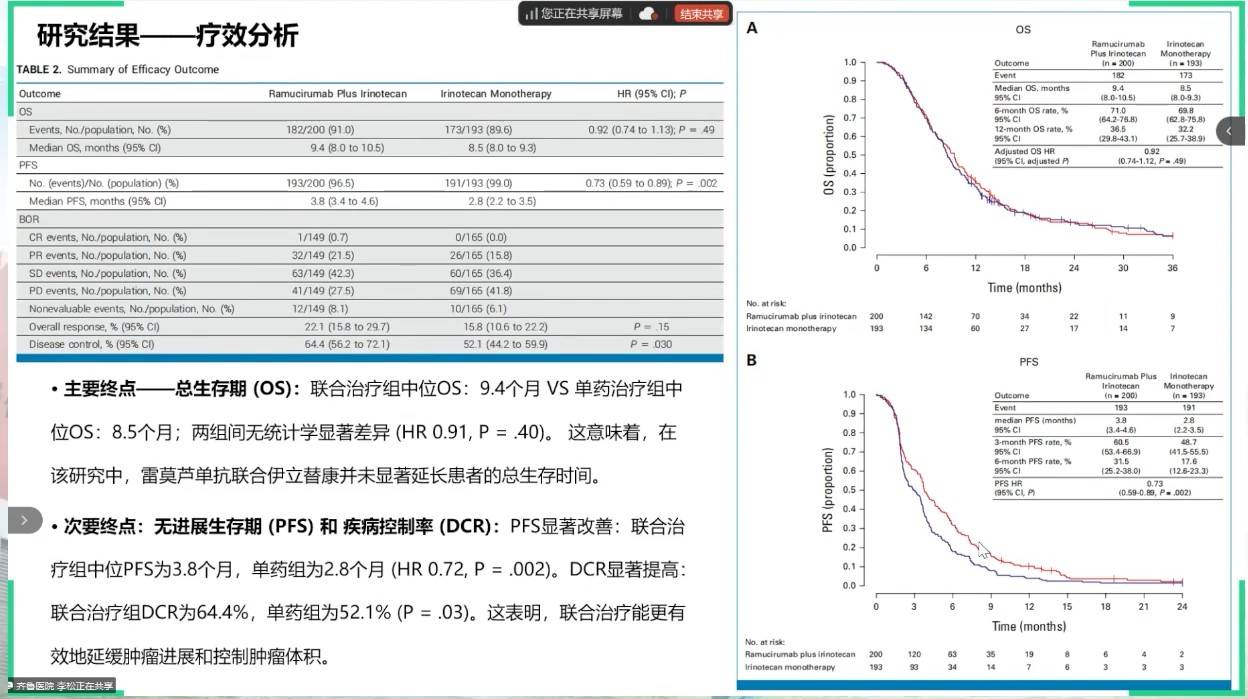
在含抗血管生成药物雷莫西尤单抗的二线方案治疗进展的晚期胃癌患者,继续使用该药联合伊立替康是否仍有价值?RINDBeRG研究对此问题给出了否定的答案。结果显示,继续使用雷莫西尤单抗联合伊立替康,较伊立替康单药并未带来OS获益(9.4个月vs8.5个月,HR=0.91;P=0.40),未达主要研究终点。高比例的后续治疗被认为是稀释生存差异的主要原因。
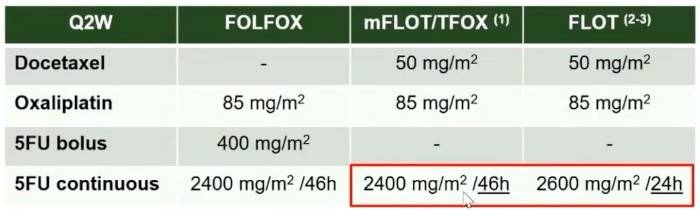
GASTFOX研究:改良FLOT方案(TFOX)一线治疗优化
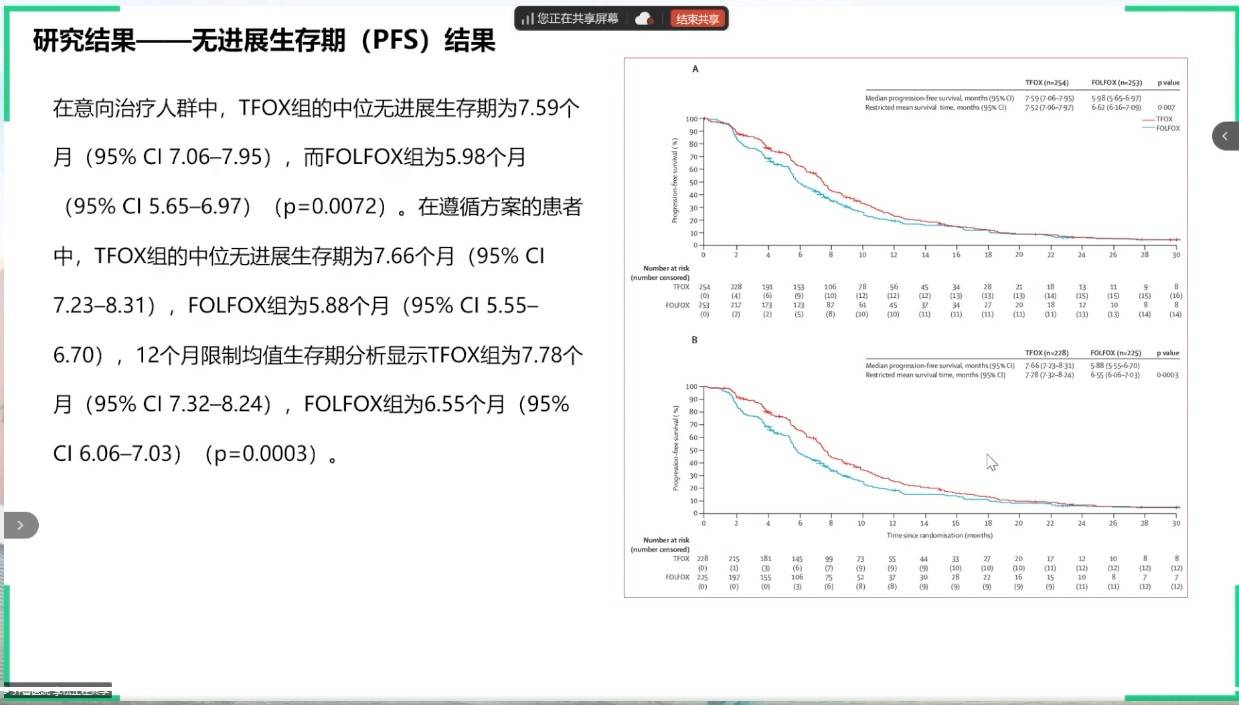
在化疗方案的优化方面,GASTFOX研究对比了改良的FLOT方案(TFOX)与FOLFOX方案在一线HER2阴性胃癌中的疗效。结果证实,TFOX方案在PFS、OS和ORR上均显著优于对照组,且安全性性方面也表现出优势,为一线治疗提供了新的三药化疗组合。
小结
通过对这13项重磅研究的系统梳理,可以清晰地看到胃癌治疗正沿着几条关键路径高速前进。首先是靶向治疗的深化与拓宽,以泽尼达妥单抗为代表的新一代药物不仅提升了传统靶点的疗效,还可能惠及更广泛的人群;而Claudin18.2 CAR-T和抗DKK1抗体的成功探索,则预示着更多新靶点将进入临床视野。其次是免疫治疗的精准化布局,从基于PD-L1、MSI的疗效分层,到针对体力欠佳等特殊人群的策略调整,再到围手术期的全面整合,免疫治疗的应用正变得愈发精细。最后,化疗作为基石仍在不断优化。这些研究共同勾勒出未来胃癌治疗的蓝图,开启了基于精准生物标志物,融合了化疗、靶向、免疫乃至细胞治疗的、高度个体化的多学科综合治疗时代。
排版编辑:肿瘤资讯-AS











 苏公网安备32059002004080号
苏公网安备32059002004080号


