多发性骨髓瘤(MM)是一种在中老年人群中较为高发的恶性肿瘤。由于其疾病特性,MM患者常常出现骨质破坏等问题,并经历骨相关事件(SRE)。这些事件的发生不仅使患者遭受巨大的痛苦,还可能导致长期卧床、活动能力下降,甚至丧失自理能力,给患者及其家庭带来沉重的负担。此外,SRE还与患者的预后密切相关,频繁发生SRE可能提示疾病进展加速,生存期缩短。因此,有效预防和管理SRE成为MM骨保护治疗的主要目标之一。另外,多学科诊疗模式(MDT)已成为肿瘤治疗中的研究热点。将骨保护治疗与MDT相结合也是临床中亟待探索的方向之一。【肿瘤资讯】特别邀请中山大学肿瘤防治中心的夏忠军教授,为我们深入讲解MM骨保护治疗的要点以及未来的发展方向,以下为详细内容。
中山大学肿瘤防治中心血液肿瘤科
中国医药教育学会骨髓瘤专业委员会副主任委员
中国抗癌协会癌症康复与姑息治疗专业委员会委员
中国医学会老年血液病专业委员会委员
广东省抗癌协会姑息与康复专业委员会副主任委员
广东省预防医学会肿瘤防治专业委员会副主任委员
广州抗癌协会化疗专业委员会主任委员
广东省抗癌协会淋巴瘤专业委员会常委
UCOM联盟广东淋巴瘤专业委员会主任委员
广州市医学会血液肿瘤专业委员会副主任委员
破局MM骨相关事件——从延缓骨破坏到提升生存质量的全程管理
夏忠军教授:MM是一种以克隆浆细胞在骨髓中异常增殖为特征的恶性血液肿瘤,常导致骨质破坏等骨骼系统异常,严重影响患者的生存预后。已有研究发现,MM细胞可与骨髓基质细胞相互作用,分泌多种细胞因子,可使骨质吸收增加、成骨过程受阻,进而引发骨质破坏。据统计,约90%的MM患者会出现不同程度的骨质破坏,约80%的初诊患者存在溶骨性损害[1],并且该类患者发生SRE的风险较高。这也使得一些日常行为,如长时间站立、行走,或进行提拉、搬运等,成为可能导致MM患者面临骨折或截瘫风险的高危行为。
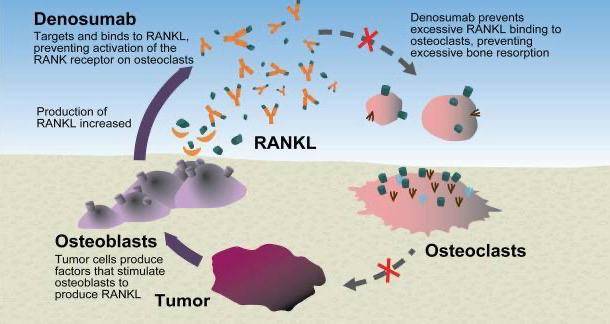
深入研究揭示,MM细胞和骨髓基质细胞直接分泌RANKL激活破骨细胞,同时抑制成骨细胞功能,导致破骨和成骨严重失衡,产生剧烈的骨破坏,且很难修复。这也是MM患者更易发生骨折的原因[2]。由此可见,及时为MM患者开启骨保护治疗对于维持患者的骨健康和改善生存预后至关重要。
目前临床中常用的骨保护药物包括双膦酸盐类药物和新型RANKL抑制剂地舒单抗等。双膦酸盐类药物主要通过抑制甲羟戊酸途径,导致成熟破骨细胞功能受损,减少骨吸收。地舒单抗是一种全人源化IgG2单克隆抗体,具有高特异性和高亲和力,能阻止RANKL与RANK结合,抑制破骨细胞形成和激活,有效延缓SRE发生[3]。
一项中国骨转移性疾病的多中心回顾性流行病学调查显示,在肿瘤患者确诊骨转移后3个月内启动骨保护治疗(如地舒单抗或双膦酸盐类药物),可显著降低SRE发生率(4.0% vs. 42.3%,P<0.05),并减少骨相关并发症的发生频率[4]。另外,在疼痛管理方面,一项III期研究的分析结果显示,骨保护治疗可延缓肿瘤患者的疼痛加剧以及阿片类药物的使用[5],改善患者的生活质量。
总体而言,早期启动骨保护治疗可显著降低SRE,改善患者生活质量,对MM患者的综合治疗具有重要意义。
新药浪潮下的MM骨保护治疗优化——个体化方案的临床实践
夏忠军教授:目前临床中常用的骨保护治疗方案主要包括双膦酸盐类药物和新型 RANKL 抑制剂。尽管双膦酸盐类药物可抑制破骨细胞活性,减少骨质破坏,降低SRE风险,但进入血液的双膦酸盐类药物约60%以原型从肾脏排泄,这使得其在部分MM患者中的应用受到一定限制[6]。相比之下,地舒单抗主要通过网状内皮系统代谢清除。另外,地舒单抗可经皮下注射给药,这为其临床应用提供了便利。
对于临床医生而言,在为 MM 患者选择治疗方案时,应综合考虑患者的情况,如年龄、肾功能、骨病严重程度、合并症等因素,选择更加合适的治疗方案。具体而言,在延缓 SRE 方面,一项针对MM和实体瘤患者的III期研究的分析结果显示,相较于双膦酸盐类药物组,地舒单抗组至首次SRE发生时间更长。另外,地舒单抗组首次发生SRE的风险降低了 17%,多次发生SRE的风险降低了18%,并将研究中首次出现SRE的中位时间延长了8个月以上[7]。在生存期方面,地舒单抗组的无进展生存期(PFS)更长,与双膦酸盐类药物组差异达 10.7 个月(46.1 个月 vs 35.4 个月,P=0.036)[8]。
由于疾病特性,MM患者通常会经历多线治疗,这对患者的肾功能状态等要求较高。而地舒单抗不经肾脏代谢,可为MM患者保留更多肾单位。一项纳入MM患者的 III 期研究显示,地舒单抗组的肾毒性发生率低于双膦酸盐类药物组[9]。对于因双膦酸盐类药物治疗致使肾功能恶化的患者,地舒单抗同样有效。在一项临床研究中,此类患者转用地舒单抗3个月后,其肌酐清除率由治疗前的中位值 40.9 ml/min 上升至 47.5 ml/min,末次随访时达到 52.0 ml/min,差异具有统计学意义[10]。
疼痛对癌症患者的健康相关生活质量(HRQoL)有重大影响,而预防和缓解SRE相关疼痛是其中重要影响因素[11]。一项针对肿瘤患者的III期研究显示,与双膦酸盐类药物组相比,地舒单抗可延缓疼痛恶化,并可减少使用强阿片类药物。在基线无疼痛或轻度疼痛的患者中,地舒单抗可将中度或重度疼痛发生的中位时间缩短 1.8 个月(6.5 个月 vs 4.7 个月;P <0.001)。在高危患者中,使用地舒单抗后,患者至疼痛对身体功能干扰增加的中位时间延长了 1.8 个月(11.1 个月 vs 9.3 个月;P = 0.010)。除此之外,在治疗过程中,定期监测患者的骨病相关指标,如骨密度、骨代谢标志物等,以及病情的变化,及时调整治疗方案[12]。
在MM的骨保护治疗中,地舒单抗具有多方面优势。其不仅在延缓SRE、延长PFS方面表现出色,还能为患者保留更多肾单位,并提高患者的生活质量。临床医生应根据患者的具体情况,合理选择和优化骨保护治疗方案,以实现最佳的治疗效果和预后。
MM骨保护MDT协作新路径——从单科诊疗到多维度骨健康管理体系的构建
夏忠军教授:MM是一种复杂的血液恶性肿瘤,常累及多个系统。随着MDT的兴起,将骨保护治疗与MDT模式相结合成为未来MM综合治疗的重要发展方向。
MDT模式通过整合血液科、骨科、肾内科、放疗科、病理科、影像科等多学科专业力量,为MM患者提供全面、个体化的治疗方案。在MM的诊断、治疗决策、并发症管理以及随访等各个环节,MDT模式能够确保患者得到最优化的医疗服务。
骨保护治疗是MM综合治疗的重要组成部分。如刚刚提到的,MM相关SRE不仅影响患者的生活质量,还可能影响其生存期。因此,在MDT模式下,骨保护治疗应与化疗、靶向治疗、免疫治疗等抗肿瘤治疗同步进行,以实现最佳治疗效果。
具体而言,在制定治疗方案前,MDT团队应全面评估患者的骨髓瘤病情、骨质状况、肾功能、疼痛程度等。基于这些评估结果,MDT团队共同制定个体化的骨保护治疗方案,如选择双膦酸盐类药物或地舒单抗等。在治疗过程中,各学科也应密切协作,及时调整治疗方案。同时,定期进行影像学和实验室检查,评估骨质破坏的进展情况和治疗效果,为后续治疗提供依据。在治疗结束后,MDT团队需要继续对患者进行长期随访。通过多学科随访,及时发现并处理可能出现的问题,确保MM患者得到持续的优质护理。
随着对MM发病机制的深入研究和新的骨保护药物及技术的不断涌现,骨保护治疗与MDT模式的结合将更加紧密和高效。同时,MDT模式的不断优化和完善,将为MM患者带来更好的治疗效果和生活质量,改善预后。
综上所述,将骨保护治疗与MDT模式相结合是未来MM治疗的重要发展方向。通过多学科的协作与整合,能够为MM患者提供全面、个体化、精准的治疗方案,有效预防和治疗骨质破坏及相关并发症,提高患者的生活质量和生存期。
1. 中国抗癌协会血液肿瘤专业委员会, 中华医学会血液学分会. 中国多发性骨髓瘤骨病诊治指南(2022年版) [J] . 中华血液学杂志, 2022, 43(12) : 979-985. DOI: 10.3760/cma.j.issn.0253-2727.2022.12.002.
2. LeBlanc R, Bergstrom DJ, Côté J, et al. Management of Myeloma Manifestations and Complications: The Cornerstone of Supportive Care: Recommendation of the Canadian Myeloma Research Group(formerly Myeloma Canada Research Network) Consensus Guideline Consortium[J]. Clin Lymphoma Myeloma Leuk. 2022;22(1):e41-e56.
3. 安加维®(地舒单抗注射液)说明书.
4. Yang Y, Ma Y, Sheng J, Huang Y, Zhao Y, Fang W, Hong S, Tian Y, Xue C, Zhang L. A multicenter, retrospective epidemiologic survey of the clinical features and management of bone metastatic disease in China. Chin J Cancer. 2016 Apr 25;35:40. doi: 10.1186/s40880-016-0102-6. PMID: 27112196; PMCID: PMC4845386.
5. Cadieux B, Coleman R, Jafarinasabian P, Lipton A, Orlowski RZ, Saad F, Scagliotti GV, Shimizu K, Stopeck A. Experience with denosumab (XGEVA®) for prevention of skeletal-related events in the 10 years after approval. J Bone Oncol. 2022 Feb 7;33:100416. doi: 10.1016/j.jbo.2022.100416. PMID: 35242510; PMCID: PMC8857591.
6.骨质疏松症药物治疗的药学监护
7.Lipton A., Fizazi K., Stopeck A.T., Henry D.H., Brown J.E., Yardley D.A., Richardson G.E., Siena S., Maroto P., Clemens M., Bilynskyy B., Charu V., Beuzeboc P., Rader M., Viniegra M., Saad F., Ke C., Braun A., Jun S. Superiority of denosumab to zoledronic acid for prevention of skeletal-related events: a combined analysis of 3 pivotal, randomised, phase 3 trials. Eur. J. Cancer. 2012;48(16):3082–3092. doi: 10.1016/j.ejca.2012.08.002.
8. HENRY D H, COSTA L, GOLDWASSER F, et al. Randomized, double-blind study of denosumab versus zoledronic acid in the treatment of bone metastases in patients with advanced cancer (excluding breast and prostate cancer) or multiple myeloma [J]. Journal of clinical oncology : official journal of the American Society of Clinical Oncology, 2011, 29(9): 1125-32.
9. Raje N, et al. Lancet Oncol. 2018;19:370-81.
10.Yamasaki M, Yuasa T, Uehara S, Fujii Y, Yamamoto S, Masuda H, Fukui I, Yonese J. Improvement of renal function by changing the bone-modifying agent from zoledronic acid to denosumab. Int J Clin Oncol. 2016 Dec;21(6):1191-1195. doi: 10.1007/s10147-016-1019-4. Epub 2016 Jul 11. PMID: 27402103; PMCID: PMC5124438.
11. Van Poznak C., Somerfield M.R., Barlow W.E., Biermann J.S., Bosserman L.D., Clemons M.J., Dhesy-Thind S.K., Dillmon M.S., Eisen A., Frank E.S., Jagsi R., Jimenez R., Theriault R.L., Vandenberg T.A., Yee G.C., Moy B. Role of bone-modifying agents in metastatic breast cancer: an American Society of Clinical Oncology-Cancer Care Ontario focused guideline update. J. Clin. Oncol. 2017;35(35):3978–3986. doi: 10.1200/JCO.2017.75.4614.
12.von Moos R., Body J.J., Egerdie B., Stopeck A., Brown J.E., Damyanov D., Fallowfield L.J., Marx G., Cleeland C.S., Patrick D.L., Palazzo F.G., Qian Y., Braun A., Chung K. Pain and health-related quality of life in patients with advanced solid tumours and bone metastases: integrated results from three randomized, double-blind studies of denosumab and zoledronic acid. Support. Care Cancer. 2013;21(12):3497–3507. doi: 10.1007/s00520-013-1932-2.
排版编辑:肿瘤资讯-LBJ











 苏公网安备32059002004080号
苏公网安备32059002004080号


