近年来,HER3靶向治疗在肺癌领域取得迅速突破和崛起。HER3在多种癌症中高表达,与肿瘤侵袭性、转移能力及耐药性密切相关;尤其在EGFR突变非小细胞肺癌(NSCLC)中,HER3表达上调可能与EGFR-TKI耐药相关。随着对HER3靶点的深入探索及新药研发的快速推进,针对HER3的靶向药物,包括抗体偶联药物(ADC)和双特异性抗体(简称双抗)逐渐崭露头角,展现出巨大潜力。其中,HER3-DXd作为全球首款靶向HER3的ADC,在临床试验中取得积极成果,为HER3靶向治疗开辟了新路径。本文系统梳理HER3靶向药物相关研究进展和未来方向。
专家简介
北京大学肿瘤医院胸部肿瘤内二科 科主任
北京肿瘤防治研究会副会长
北京肿瘤防治研究会肺癌分委会主任委员
中国老年学学会老年肿瘤专业委员会分子靶向委员会副主任委员
中国老年学学会老年肿瘤专业委员会肺癌委员会委员
CSCO血管靶向治疗专家委员会委员
中国抗癌协会化疗专业委员会委员
中国抗癌协会老年专业委员会执行委员
国家药监局药品审评专家
HER3具有致癌作用,是极具潜力的治疗靶点
人表皮生长因子受体3(HER3)是表皮生长因子受体(EGFR)/人表皮生长因子受体(HER)家族中唯一缺乏活性激酶结构域(KD)的成员,这使得它必须与其他受体结合才能发挥致癌作用。当HER3通过配体依赖性(NRG1/HRG)或非依赖性方式激活时,可以与其他受体(最有力的结合伙伴是HER2)结合,通过PI3K–AKT–mTOR信号通路,调节多种生物学功能(如生长、存活等)。HER3已被发现在多种癌症类型(尤其是乳腺癌和非小细胞肺癌)中促进肿瘤发生、肿瘤生长和药物耐受性[1]。
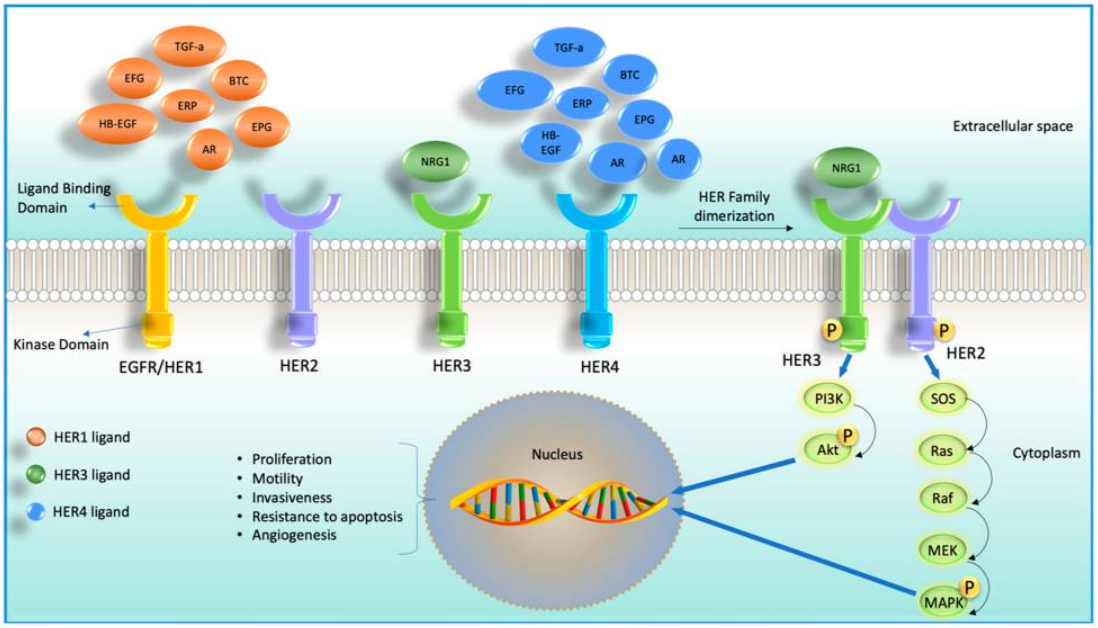
HER3在包括NSCLC、乳腺癌、结直肠癌等多种恶性实体瘤中高表达,在83%的原发性NSCLC中观察到HER3的过表达[2,3],HER3过表达与NSCLC患者的转移进展、无复发生存期缩短、预后差相关[3]。与EGFR野生型NSCLC相比,EGFR突变NSCLC患者中HER3的表达更高[4]。HER3在NSCLC中广泛过表达,且体外和转化研究表明,HER3信号通路的激活与EGFR-TKI的获得性耐药相关。一线EGFR-TKI耐药后,肿瘤患者组织样本HER3的表达增加。HER3被认为是EGFR突变NSCLC治疗中非常有吸引力的潜在治疗靶点。
系列研究验证HER3-DXd优异疗效和良好耐受性,III期研究已达PFS终点
首创新一代HER3-DXd引领创新潮流
HER3-DXd(U3-1402)是全球首款新一代HER3 ADC药物,由靶向HER3的完全人源化抗HER3免疫球蛋白G1单克隆抗体patritumab,通过基于四肽的稳定可裂解连接子与拓扑异构酶I抑制剂DXd共价偶联而成。连接子在血浆中稳定;有效载荷被释放时,全身半衰期短;这两个特性有助于降低全身毒性风险[5-8]。
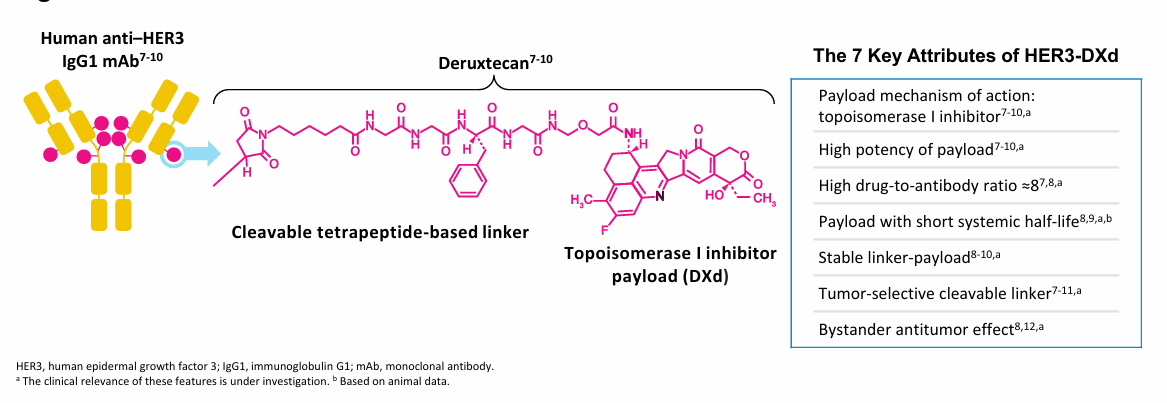
HER3-DXd选择性地与肿瘤细胞表面的HER3结合,被肿瘤细胞内化并运输到溶酶体,连接子被肿瘤细胞表面表达上调的溶酶体酶裂解,从而释放有效载荷DXd进入细胞核并造成DNA损伤,最终导致肿瘤细胞死亡。DXd亦可穿透细胞膜,产生旁观者效应,可导致肿瘤微环境中HER3表达肿瘤细胞和周围肿瘤细胞的死亡。
值得注意的是,目前大多数处于开发和临床应用阶段ADC的药物抗体比(DAR)通常在2-4。当DAR超过6时,ADC的连接子和偶联化学的不稳定性可能会导致其疗效下降及毒性增加。然而,HER3-DXd利用经过临床验证的高效 deruxtecan 技术平台成功克服了这一限制,使DAR高达8,且在稳定性和均一性方面得到显著提升。与德曲妥珠单抗(DS-8201,T-DXd)类似,在接受U3-1402治疗的动物模型中,DXd在血浆中的暴露水平极低,几乎可以忽略不计[6]。
系列研究设计严谨,多次结果证实HER3-DXd优异疗效和良好耐受性
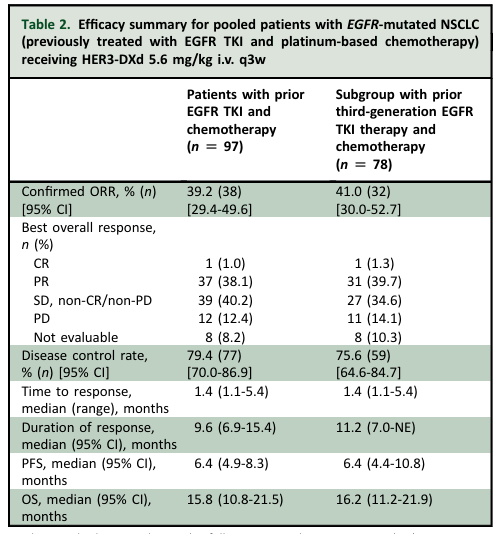
I期U31402-A-U102是一项多中心、开放标签的剂量递增/扩展I期研究,旨在评估HER3-DXd用于EGFR-TKI进展的EGFR突变局部晚期或转移性NSCLC患者的安全性和有效性。既往结果显示,每3周静脉注射HER3-DXd 5.6 mg/kg具有可耐受和可管理的安全性,并有临床意义的疗效,确认的客观缓解率 (ORR) 为 39%,中位缓解持续时间(DoR)为7.0个月。2024年于权威期刊ANNALS OF ONCOLOGY更新的结果显示,在接受过EGFR-TKI和含铂化疗的总人群中,确认的ORR为39.2%,中位DoR为9.6个月,中位总生存期(OS)为15.8个月。在78例曾接受三代 EGFR-TKI和含铂化疗的患者中,确认的ORR为 41.0%,中位DoR为11.2个月,中位OS为16.2个月[9]。
基于U31402-A-U102研究既往的初步优异结果,后续开展的II 期HERTHENA-Lung01研究,旨在进一步评估5.6mg/kg固定剂量HER3-DXd、递增剂量方案3.2-6.4mg/kg HER3-DXd用于EGFR-TKI和含铂化疗经治的EGFR突变NSCLC患者的疗效和安全性[10]。主要终点是盲法独立中心审查(BICR)评估的ORR,关键次要终点是DoR。
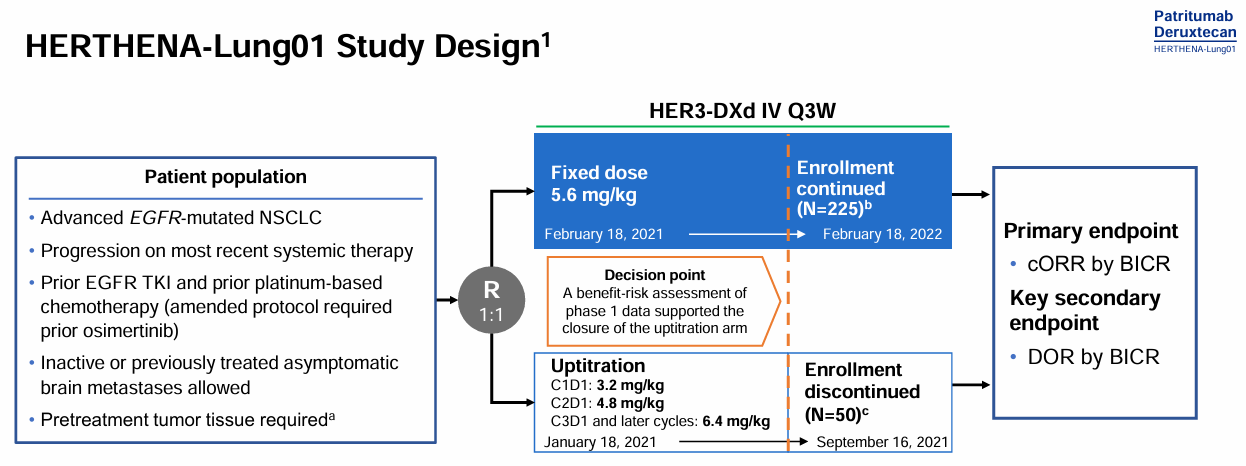
基线特征显示,47%患者为亚裔,有中枢神经系统(CNS)转移史患者占51%,有脑转移和肝转移患者分别占比32%、33%;100%、100%的患者既往接受过EGFR-TKI、化疗,既往接受三代EGFR-TKI的患者占93%,既往接受免疫治疗患者占40%;既往有73.3%的患者接受过3线及以上的治疗。
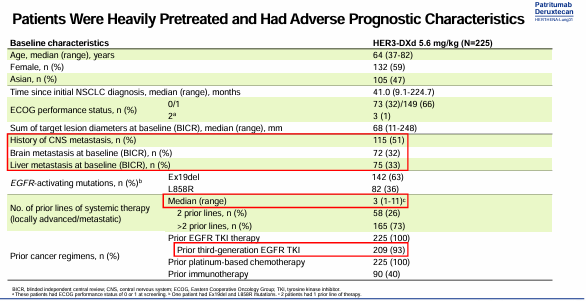
疗效结果显示,总人群中5.6mg/kg HER3-DXd组患者确认的ORR为29.8%,其中1例完全缓解(CR),29.3%的患者达到部分缓解(PR),44%的患者达到疾病稳定(SD),疾病控制率(DCR)为73.8%;中位DoR为6.4个月,中位PFS为5.5个月,中位OS为11.9个月。在既往接受三代EGFR-TKI和含铂化疗亚组中,ORR达到29.2%,DCR为72.7%,中位PFS和中位OS分别为5.5个月和11.9个月。
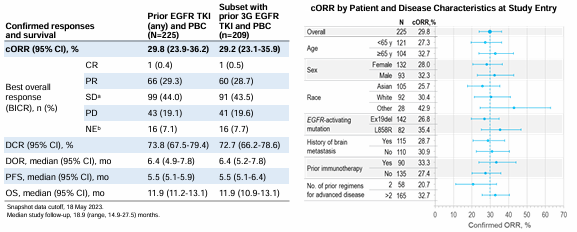
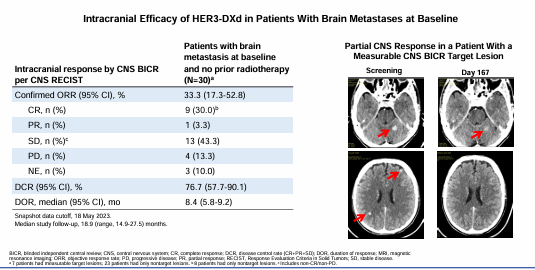
根据不同的EGFR-TKI耐药类型,EGFR通路依赖性、非EGFR通路依赖性、EGFR通路依赖和非依赖性三类患者的ORR分别为32.4%、27.2%、37.5%。在有脑转移且未接受放疗的30例患者中,患者确认的CNS ORR为33.3%,有30%的患者达到CR,CNS DCR为76.7%。
安全性方面,HER3-DXd在重度经治的EGFR突变NSCLC患者中,显示出可管理和可耐受的安全性,与既往研究一致。
III期HERTHENA-Lung02已达到PFS主要终点
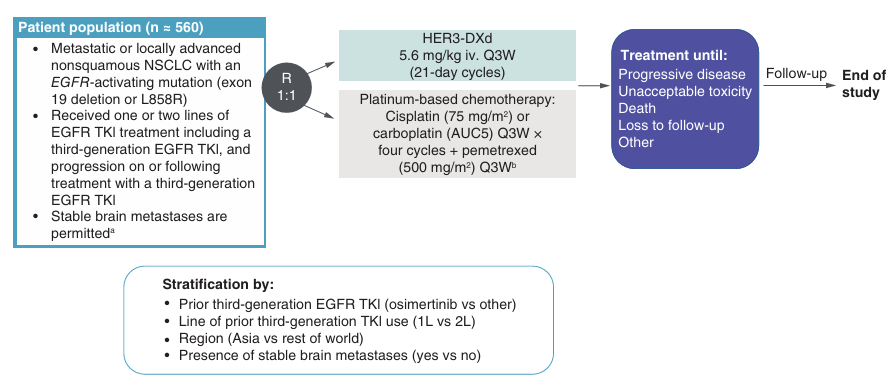
HERTHENA-Lung02是一项全球性、多中心、随机开放标签的III期试验,旨在评估HER3-DXd对比含铂化疗用于三代EGFR-TKI治疗后进展EGFR突变NSCLC患者的疗效和安全性。患者将以1:1的比例随机分配接受HER3-DXd 5.6 mg/kg或含铂化疗方案。主要终点为BICR按RECIST 1.1标准评估的PFS。此项III期研究已达到PFS阳性结果,期待研究结果的正式公布。
小结:
HER3-DXd是全球首款靶向HER3的ADC,在重度经治的EGFR突变NSCLC患者中显示出具有临床意义的疗效和获益,且在颅内和不同耐药患者人群中均显示优异的疗效和获益;HER3-DXd单药治疗显示出良好的耐受性和安全性。
未来研究布局:
基于HER3-DXd在多项临床研究中显示出积极的阳性结果,未来研究将进一步探索HER3-DXd在其他领域,包括KRAS突变人群、驱动基因阴性晚期NSCLC等患者群体的疗效结果,并将进一步验证HER3-DXd在脑转移患者中的有效性和安全性。此外其他针对HER3靶点的ADC均在积极研发和开展中。
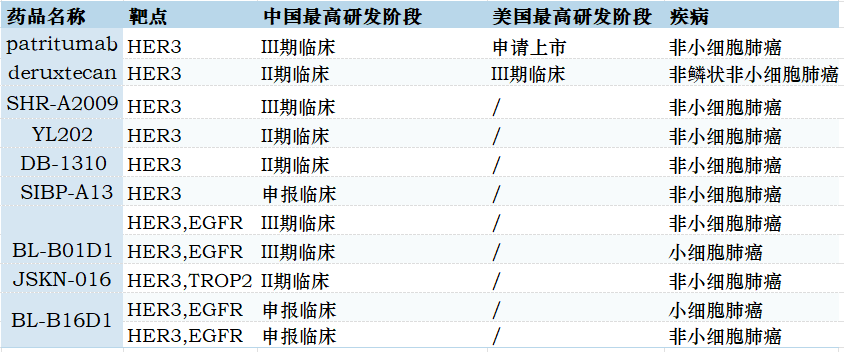
靶向HER3双抗药物的研发和多样化探索
双抗类药物展现潜力
为克服单克隆抗体单药靶向HER3的局限性和耐药机制,双抗也在临床试验中展现出潜力。其中最具前景的是靶向HER2和HER3的双抗Zenocutuzumab(MCLA-128)。该药物通过阻滞NRG1与HER3结合所介导的信号通路,抑制肿瘤细胞的增殖,并将自然杀伤(NK)细胞募集至肿瘤床,增强抗肿瘤活性。
eNRGy试验是一项多中心、开放标签、多队列的临床研究,旨在评估Zenocutuzumab在NRG1融合阳性实体瘤患者中的疗效和安全性。该试验共纳入64例NRG1融合突变的NSCLC患者和30例NRG1融合突变的胰腺导管腺癌(PDAC)患者,所有患者均为接受标准治疗后病情进展的患者。结果显示,在NSCLC患者中,Zenocutuzumab的总体ORR为33%,中位DoR为7.4个月。在PDAC患者中,ORR为40%。基于eNRGy试验结果,FDA加速批准Zenocutuzumab上市,用于NRG1基因融合的NSCLC和PDAC患者。值得一提的是,双抗与ADC的联合可能是未来有潜力的发展方向,有研究显示,HER2×PRLR 双抗与HER2 ADC联合使用可增强ADC的细胞毒活性。
双抗与ADC的机制与临床定位
治疗性抗体的优势在于能够与靶抗原产生强大且特异性的结合,从而最大限度地提升疗效和安全性;抗体还能阻断蛋白质之间的相互作用,这种能力通常是小分子药物所不具备的。然而很少有疾病完全依赖于单一靶点及信号通路,癌细胞往往会下调靶分子的表达,或发展出旁路激活通路,从而导致耐药的发生。为克服传统治疗性抗体的局限性并增强其疗效,研究人员设计并应用多种工程化和修饰方法来改造传统的免疫球蛋白分子结构。其中,最引人注目的当属双抗和ADC。
双抗的发展和临床定位可能集中于肿瘤治疗、免疫调节和其他疾病领域。在肿瘤治疗领域,双抗通过同时结合两种不同的靶点发挥协同治疗的效果,临床优势在于增强疗效和精准治疗,能够克服单靶点治疗的局限性,减少对正常细胞的损伤。
ADC的发展和临床定位主要集在抗肿瘤领域和难治性癌症的治疗。ADC通过将细胞毒性药物与靶向肿瘤细胞的抗体结合,实现对肿瘤细胞的选择性杀伤,同时尽量减少对正常组织的损害。ADC的临床优势在于高效性、选择性,能够将高浓度的细胞毒性药物直接递送到肿瘤细胞,减少对正常细胞的毒性,而降低副作用[11]。
未来展望
双抗在联合疗法与个体化治疗方面的探索前景广阔。双抗与免疫检查点抑制剂、靶向药物或新型疗法等的协同,有望进一步增强抗肿瘤效果并克服耐药性。未来,在新型靶点开发、结构优化等领域的深入探索,将推动双抗成为肿瘤免疫治疗的重要力量。
ADC药物已展现出广阔的前景,未来ADC通过进一步优化设计、探索新型载药和连接子等,将进一步拓展适应症人群,将在泛瘤种领域释放更大潜力。目前已有初步研究显示,ADC与免疫检查点抑制剂等策略的联合,能够增强抗肿瘤疗效。随着ADC在后线领域临床研究的成功,ADC正逐渐从后线向一线甚至围手术期领域扩展。另外,生物标志物的探索也将成为ADC药物发展的重要方向,有效的生物标志物将大幅提升患者的疗效和获益。
结语
全球首款靶向HER3的ADC药物HER3-DXd在NSCLC治疗领域取得了突破性进展,其III期临床试验HERTHENA-Lung02已达到PFS主要终点,将为重度经治EGFR突变NSCLC患者提供重要的后线治疗新选择。此外,HER3-DXd在脑转移患者中展现出初步的优异颅内疗效,为这一难治性患者群体带来了新的希望。HER3靶向疗法有望重塑癌症治疗格局,通过在联合疗法、难治性脑转移患者、泛瘤种应用和精准治疗等领域深度探索,ADC和双抗将为更多患者带来新希望和新选择。
[1]Majumder A. HER3: Toward the Prognostic Significance, Therapeutic Potential, Current Challenges, and Future Therapeutics in Different Types of Cancer. Cells. 2023 Oct 25;12(21):2517. doi: 10.3390/cells12212517. PMID: 37947595; PMCID: PMC10648638.
[2]Li Q, Zhang R, Yan H, Zhao P, Wu L, Wang Het al. Prognostic significance of HER3 in patients with malignant solid tumors. Oncotarget 2017;8:67140–51
[3]Scharpenseel H, Hanssen A, Loges S, Mohme M, Bernreuther C, Peine Set al. EGFR and HER3 expression in circulating tumor cells and tumor tissue from non-small cell lung cancer patients. Sci Rep 2019;9:7406.
[4]Kawano O, Sasaki H, Endo K, Suzuki E, Haneda H, Yukiue Het al. ErbB3 mRNA expression correlated with specific clinicopathologic features of Japanese lung cancers. J Surg Res 2008;146:43–8.
[5]Hashimoto Y , KoyamaK , KamaiYet al. A Novel HER3-Targeting antibody–drug Conjugate, U3-1402, Exhibits Potent Therapeutic Efficacy through the Delivery of Cytotoxic Payload by Efficient Internalization. Clin. Cancer Res.25(23), 7151–7161 (2019).
[6]Koganemaru S , KubokiY , KogaYet al. U3-1402, a Novel HER3-Targeting antibody–drug Conjugate, for the Treatment of Colorectal Cancer. Mol. Cancer Ther.18(11), 2043–2050 (2019).
[7]Ogitani Y , AidaT , HagiharaKet al. DS-8201a, A Novel HER2-Targeting ADC with a Novel DNA Topoisomerase I Inhibitor, Demonstrates a Promising Antitumor Efficacy with Differentiation from T-DM1. Clin. Cancer Res.22(20), 5097–5108 (2016).
[8]Yonesaka K , TakegawaN , WatanabeSet al. An HER3-targeting antibody–drug conjugate incorporating a DNA topoisomerase I inhibitor U3-1402 conquers EGFR tyrosine kinase inhibitor-resistant NSCLC. Oncogene38(9), 1398–1409 (2019).
[9]Yu HA, Baik C, Kim DW, et al. Translational insights and overall survival in the U31402-A-U102 study of patritumab deruxtecan (HER3-DXd) in EGFR-mutated NSCLC. Ann Oncol. 2024 May;35(5):437-447.
[10]Yu HA, Goto Y, Hayashi H, et al. HERTHENA-Lung01, a Phase II Trial of Patritumab Deruxtecan (HER3-DXd) in Epidermal Growth Factor Receptor-Mutated Non-Small-Cell Lung Cancer After Epidermal Growth Factor Receptor Tyrosine Kinase Inhibitor Therapy and Platinum-Based Chemotherapy. J Clin Oncol. 2023 Dec 10;41(35):5363-5375. doi: 10.1200/JCO.23.01476. Epub 2023 Sep 10. PMID: 37689979; PMCID: PMC10713116.
[11]Shim H. Bispecific Antibodies and Antibody-Drug Conjugates for Cancer Therapy: Technological Considerations. Biomolecules. 2020 Feb 26;10(3):360. doi: 10.3390/biom10030360. PMID: 32111076; PMCID: PMC7175114.
排版编辑:肿瘤资讯-邓文普











 苏公网安备32059002004080号
苏公网安备32059002004080号


