肺癌仍然是全球健康领域的重大挑战,其主要原因在于其高度的分子异质性,这为肺癌的有效治疗带来了障碍。在这一背景下,EGFR突变型非小细胞肺癌(NSCLC)已成为精准肿瘤学领域的一个重要研究方向。在中国NSCLC患者中,EGFR突变的发生率约为50%。其中,最常见的突变类型为外显子19缺失(ex19-Del)和外显子21 L858R点突变(ex21-L858R),而外显子20插入(ex20ins)突变则是继上述两种突变之后的第三大常见突变类型[1]。但是相较于EGFR经典突变,这类EGFR ex20ins突变患者治疗选择有限,常规EGFR-TKI疗效不佳,患者预后差,因此全球范围都在加速这类疾病的药物研发进程,力图早日攻克这一临床难题。基于此,【肿瘤资讯】将在本篇对EGFR ex20ins突变的分子结构和作用机制进行深度解析。
EGFR家族的结构和信号转导机制
表皮生长因子受体(Epidermal Growth Factor Receptor, EGFR)基因位于人第7号染色体的短臂p12-13上,含有28个外显子(图1A)。其编码的EGFR蛋白是ERBB受体酪氨酸激酶家族的重要成员之一。EGFR信号通路在调控细胞增殖、分化、分裂、存活以及肿瘤发生发展中发挥关键作用。作为重要的致癌驱动因子,EGFR家族成员在多种恶性肿瘤中均被发现存在异常激活,包括但不限于胶质母细胞瘤、胃癌、乳腺癌以及NSCLC等多种实体瘤[1, 2]。
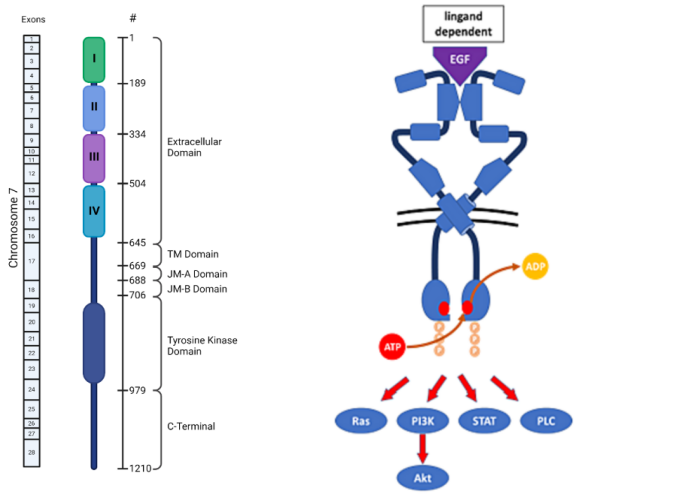
A. 人EGFR结构域及其对应编码外显子;B. 野生型EGFR通过配体结合诱导二聚化,依赖酪氨酸激酶活化和自磷酸化触发下游信号通路激活。
EGFR是一种单链跨膜蛋白,其结构由三部分组成:胞外结构域(N端),穿膜结构域和胞内结构域(C端)。胞外结构域包含622个氨基酸,由四个亚结构域组成:I结构域(氨基酸1-133位)、II结构域(氨基酸134-312位)、III结构域(氨基酸313-445位)和IV结构域(氨基酸446-621位)。胞内结构域含有542个氨基酸,由三个亚结构域组成:近膜端结构域(约含有50个氨基酸)、酪氨酸激酶结构域(含有250个氨基酸)和C 末端尾部(含有229个氨基酸),C末端尾部包含自磷酸化基序。
EGFR的活性受配体调节,EGF、TGF-β或表皮调节蛋白等配体通过与细胞外结构域结合,诱导其构象变化。EGFR的激活需要通过二聚化来实现(图1B),这种二聚化可以是同源二聚体(由相同EGFR家族成员组成)或异源二聚体(由不同EGFR家族成员组成),这种受体的可塑性使其能够响应多种信号[3]。
在二聚化构象中,EGFR酪氨酸激酶结构域能在ATP的存在下磷酸化,并触发细胞质调节域中特定酪氨酸残基的自动磷酸化,从而可以激活下游主要的信号通路(图1B),包括细胞增殖、存活、生长和发育。其中,两条主要的细胞内信号传导途径是:RAS-RAF-MEK-MAPK途径:该途径调控基因转录、细胞周期从G1期向S期的进展以及细胞增殖;PI3K-Akt途径:该途径激活抗凋亡和促存活的信号级联反应[4]。
激酶结构域由外显子18-23编码,其中外显子20编码C螺旋(C-helix)结构域及其后的磷酸结合环(P-Loop)。C螺旋是激酶活性调节的关键组分(图2A):在非活性状态下,C螺旋向外旋转(图2B);而在活性状态下,C螺旋向内旋转并具有催化活性(图2C)[5]。
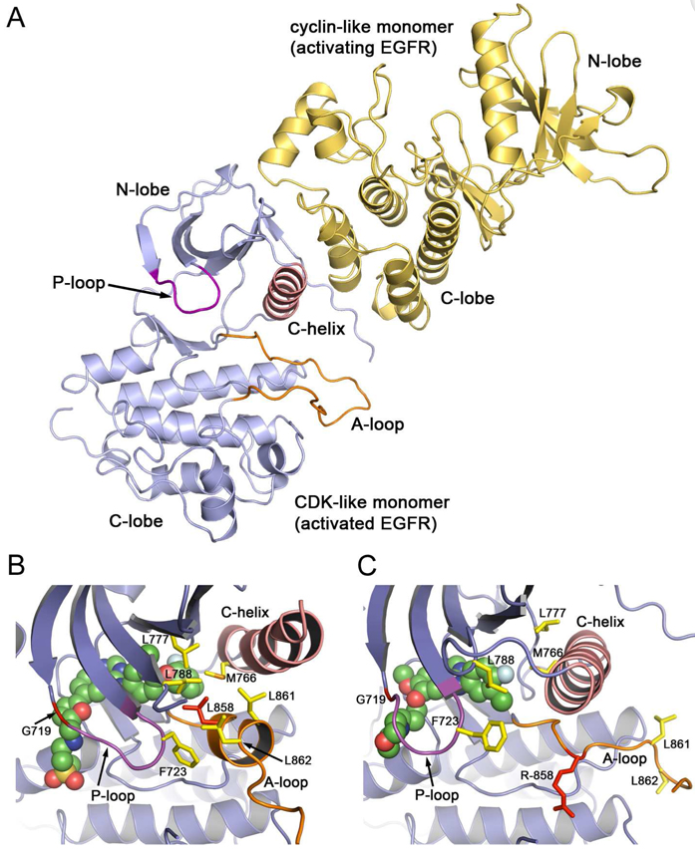
图2 通过配体介导的二聚化或致癌突变激活EGFR激酶的结构基础。
A. 当配体与受体的细胞外结构域结合时(未显示),细胞内激酶结构域形成不对称二聚体构象;B. 激酶结构域非活性状态;C. 激酶结构域活性状态。
EGFR ex20ins分子结构和作用机制
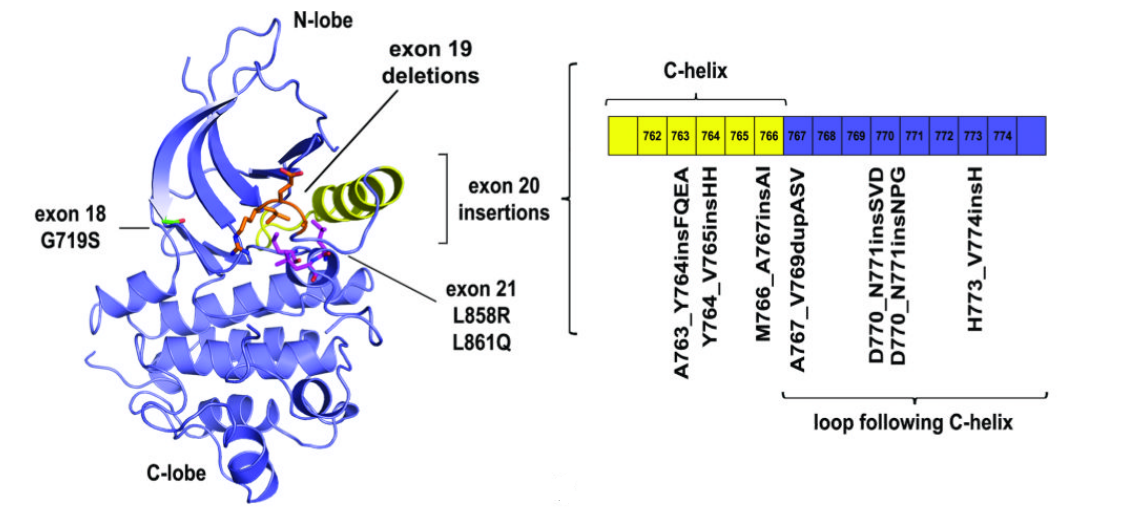
EGFR ex20ins突变在罕见EGFR突变中较为常见,占所有EGFR突变的比例高达4%[6]。EGFR ex20ins发生于EGFR外显子20上,涉及3-21个碱基对的框内插入和(或)复制,可被表征为EGFR酪氨酸激酶结构域中第761与775位氨基酸(参与组成结构域中的α-C螺旋和C螺旋后的P-loop)间1-7个氨基酸的插入或复制,进而导致EGFR通路的异常激活和细胞生长、增殖的失调[7]。插入位点与氨基酸序列的复杂性造就了EGFR ex20ins的强异质性。迄今为止,已有超过170种EGFR ex20ins变异被报道,其中约90%发生在C-螺旋后的P-Loop,另有少部分位于C-螺旋的C末端(氨基酸761-766)(图3)。EGFR ex20ins P-Loop内插入突变可进一步分为P-Loop近端(氨基酸767-772)(占ex20ins的66%-72%)与P-Loop远端(氨基酸773-775)(占ex20ins的27%-28%)[8]。我国共检测到了85种不同EGFR ex20ins突变亚型,其中P-Loop插入突变的占比高达94.7%,最常见的三种分子亚型分别为A767_V769dup、S768_D770dup和N771_H773dup,分别占所有突变亚型的25.1%、17.6%和4.8%,以1-3个氨基酸插入最常见[9]。
EGFR ex20ins导致C-螺旋后环的长度增加,这种结构变化不仅稳定了EGFR单体的二聚化并诱导其组成性激活[10],还显著改变了ATP结合口袋的构象,使得α-C螺旋和P - Loop转移至药物结合口袋,形成明显的空间位阻,导致药物结合口袋缩小,并增强了ATP结合口袋对ATP的亲和力进而导致传统的EGFR-TKIs结合受阻(图4)[11]。
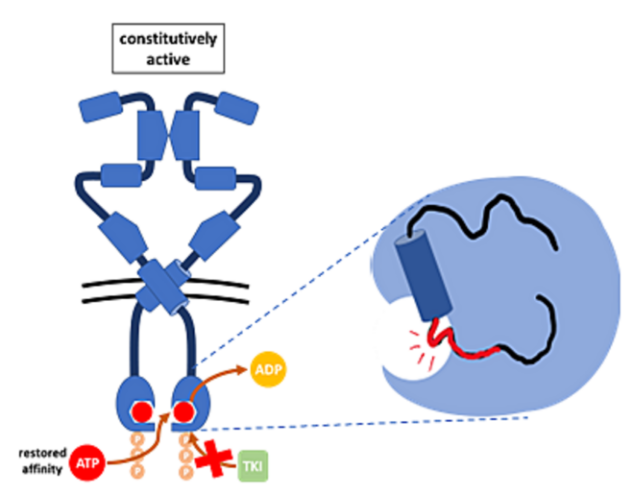
另外,EGFR ex20ins插入位点的不同也会影响EGFR-TKIs对EGFR ex20ins NSCLC的治疗效果,传统EGFR-TKIs对极少数位于α-C-螺旋内的突变亚型有一定疗效,而对位于P-Loop内的突变亚型疗效则十分有限[12-14]。因此,新的治疗手段旨在通过设计新的TKI或从细胞外侧抑制受体来克服这些构象变化。
EGFR ex20ins突变流行病学,临床与病理特征
EGFR ex20ins突变多见于无吸烟史、腺癌、女性以及亚裔患者[15],相较EGFR经典突变,其年轻化趋势明显[16]。在转移灶方面,EGFR ex20ins突变NSCLC最常见转移部位依次为骨转移、脑转移和肝脏转移[16],约39%的患者确诊时即有脑转移[17]。由于对传统TKI的原发耐药性及其他非靶向治疗的疗效欠佳,EGFR ex20ins突变被视为不良预后因素[18],中位无进展生存期(PFS)仅为EGFR经典突变患者的一半[16]。在晚期EGFR突变型肺癌长期生存者的预后模型中,EGFR ex20ins突变与初诊时存在中枢神经系统(CNS)、肾上腺或肝转移具有相似的预后[19, 20]。
尽管ALK、ROS1、BRAF、HER2、MET和KRAS等驱动基因突变通常呈现互斥性,但EGFR扩增、TP53、RB1和CDKN2A/B等基因变异可与ex20ins突变共存[21]。因此,同时存在其他基因变异、EGFR ex20ins突变的内在异质性以及PD-L1表达状态的影响,进一步增加了EGFR ex20ins突变NSCLC预后的不确定性,并可能影响治疗决策的制定[22]。
总结
EGFR蛋白结构由胞外结构域、穿膜结构域和胞内结构域组成,其激活通过二聚化实现,进而触发信号通路调控细胞活动。胞内结构域中的激酶结构域由EGFR外显子18-23编码,外显子20编码C螺旋结构域及其后的P-Loop,C螺旋是激酶活性调节的关键。EGFR ex20ins突变发生于外显子20,涉及碱基对的插入和(或)复制,导致氨基酸序列改变,引起EGFR通路异常激活。这种突变使C螺旋后环长度增加,稳定了EGFR单体的二聚化并诱导组成性激活,同时改变了ATP结合口袋的构象,导致药物结合口袋缩小,使得传统EGFR-TKIs结合受阻。此外,EGFR ex20ins插入位点的不同也影响治疗效果,传统EGFR-TKIs对位于α-C螺旋内的突变亚型有一定疗效,而对P-Loop内的突变亚型疗效有限。
总之,EGFR ex20ins突变的结构变化是导致其与EGFR经典突变存在疗效差异的关键,深入理解其分子机制有助于开发新的治疗手段,克服现有药物的局限性。针对这类患者如何检测和治疗,请持续关注后续文章。
[1] Vivanco I, Robins HI, Rohle D, Campos C, Grommes C, Nghiemphu PL, et al. Differential sensitivity of glioma- versus lung cancer-specific EGFR mutations to EGFR kinase inhibitors. Cancer Discov 2012 May;2(5):458-71.
[2] Arteaga CL, Sliwkowski MX, Osborne CK, Perez EA, Puglisi F, Gianni L. Treatment of HER2-positive breast cancer: current status and future perspectives. Nat Rev Clin Oncol 2011 Nov;9(1):16–32.
[3] Dorta-Suárez M, de Miguel M, Amor-Carro O, Calderón JM, González-Ortega M, Rodríguez-Abreu D. The state of the art of EGFR exon 20 insertions in non-small cell lung cancer: Diagnosis and future perspectives. Cancer Treat Rev. 2024 Mar;124:102671. doi: 10.1016/j.ctrv.2023.102671. Epub 2023 Dec 20. PMID: 38281403.
[4] Wee P, Wang Z. Epidermal growth factor receptor cell proliferation signaling pathways. Cancers (Basel) 2017 May;9(5).
[5] Eck MJ, Yun CH. Structural and mechanistic underpinnings of the differential drug sensitivity of EGFR mutations in non-small cell lung cancer. Biochim Biophys Acta 2010 Mar;1804(3):559–66.
[6] Arcila ME, Nafa K, Chaft JE, Rekhtman N, Lau C, Reva BA, et al. EGFR exon 20 insertion mutations in lung adenocarcinomas: prevalence, molecular heterogeneity, and clinicopathologic characteristics. Mol Cancer Ther 2013 Feb;12 (2):220–9.
[7] Yasuda H, Park E, Yun CH, et al. Structural, biochemical, and clinical characterization of epidermal growth factor receptor (EGFR) exon 20 insertion mutations in lung cancer. Sci Transl Med. 2013 Dec 18;5(216):216ra177. doi: 10.1126/scitranslmed.3007205. Erratum in: Sci Transl Med. 2014 Feb 26;6(225):225er1. PMID: 24353160; PMCID: PMC3954775.
[8] EGFR 20外显子插入突变非小细胞肺癌规范化诊疗中国专家共识(2024版). 中国肺癌杂志. 卷 27, 编号 7 (2024).
[9] Robichaux JP, Elamin YY, Tan Z, et al. Mechanisms and clinical activity of an EGFR and HER2 exon 20-selective kinase inhibitor in nonsmall cell lung cancer. Nat Med, 2018, 24(5): 638-646. doi: 10.1038/ s41591-018-0007-9
[10] Qin Y, Jian H, Tong X, et al. Variability of EGFR exon 20 insertions in 24 468 Chinese lung cancer patients and their divergent responses to EGFR inhibitors. Mol Oncol, 2020, 14(8): 1695-1704. doi: 10.1002/1878-0261.12710
[11] Lowder MA, Doerner AE, Schepartz A. Structural Differences between Wild-Type and Double Mutant EGFR Modulated by Third-Generation Kinase Inhibitors. J Am Chem Soc 2015 May;137(20):6456–9.
[12] Wang M, Yang JC, Mitchell PL, et al. Sunvozertinib, a selective EGFR inhibitor for previously treated non-small cell lung cancer with EGFR exon 20 insertion mutations. Cancer Discov, 2022, 12(7): 1676-1689.
[13] Wang M, Yang JC, Mitchell PL, et al. Sunvozertinib, a selective EGFR inhibitor for previously treated non-small cell lung cancer with EGFR exon 20 insertion mutations. Cancer Discov, 2022, 12(7): 1676-1689.
[14] Robichaux JP, Le X, Vijayan RSK, et al. Structure-based classification predicts drug response in EGFR-mutant NSCLC. Nature, 2021, 597(7878): 732-737.
[15] Oxnard GR, Lo PC, Nishino M, et al. Natural history and molecular characteristics of lung cancers harboring EGFR exon 20 insertions. J Thorac Oncol, 2013, 8(2): 179-184. doi: 10.1097/ JTO.0b013e3182779d18
[16] Pan B, Liang J, Shi H, et al. Epidemiological characteristics and therapeutic advances of EGFR exon 20 insertion mutations in nonsmall cell lung cancer. Thorac Cancer, 2023, 14(33): 3247-3258. doi: 10.1111/1759-7714.15127
[17] Cardona AF, Rojas L, Zatarain-Barrón ZL, et al. EGFR exon 20 insertion in lung adenocarcinomas among Hispanics (geno1.2-CLICaP). Lung Cancer, 2018, 125: 265-272. doi: 10.1016/j.lungcan.2018.10.007
[18] Wang F, Li C, Wu Q, Lu H. EGFR exon 20 insertion mutations in non-small cell lung cancer. Transl Cancer Res [Internet]. 2020 Apr 1 [cited 2023 Jun 22];9(4): 2982–91.
[19] Piotrowska Z, Yu HA, Yang JCH, Koczywas M, Smit EF, Tan DSW, et al. Safety and activity of CLN-081 (TAS6417) in NSCLC with EGFR Exon 20 insertion mutations (Ins20). J Clin Oncol 2021; 39(15\_suppl): 9077.
[20] Guti ́errez L, Royuela A, Carcereny E, Lo ́pez-Castro R, Rodríguez-Abreu D, Massuti B, et al. Prognostic model of long-term advanced stage (IIIB-IV) EGFR mutated non-small cell lung cancer (NSCLC) survivors using real-life data. BMC Cancer 2021 Aug;21(1):977.
[21] Fang W, Huang Y, Hong S, Zhang Z, Wang M, Gan J, et al. EGFR exon 20 insertion mutations and response to osimertinib in non-small-cell lung cancer. BMC Cancer 2019;19(1):595.
[22] Kron A, Scheffler M, Ihle M, Michels S, Süptitz J, Prang D, et al. EGFR exon 20 insertions in non-small cell lung cancer (NSCLC): Impact of TP53 mutation status and value of immune checkpoint blockade (ICB). ESMO. 2022
排版编辑:肿瘤资讯-明小丽











 苏公网安备32059002004080号
苏公网安备32059002004080号


