乳腺癌是一种高度异质性的恶性肿瘤。不同亚型乳腺癌的治疗方案、生存预后存在一定差异。随着人表皮生长因子受体2阳性(HER2+)及三阴性乳腺癌治疗方案的不断优化发展,激素受体阳性(HR+)/ HER2-亚型乳腺癌预后的优势已不再显著[1]。辅助内分泌治疗是HR+/HER2-早期乳腺癌的标准治疗方案之一,然而研究数据与临床实践显示,尽管接受了标准辅助内分泌治疗,仍有部分患者会复发[2]。为贯彻分层诊疗理念,精准识别HR+/HER2-早期乳腺癌高复发风险人群,【肿瘤资讯】特邀四川大学华西医院罗婷教授解析HR+/HER2-早期乳腺癌复发风险因素,以期为临床实践提供指导。
四川大学华西医院乳腺疾病中心副主任
四川省学术和技术带头人后备人选
中国临床肿瘤学会(CSCO)理事
中国临床肿瘤学会(CSCO)青年专家委员会常委
中国临床肿瘤学会乳腺癌(CSCO BC)专委会委员
中国抗癌协会乳腺癌专委会(CBCS)委员
中国抗癌协会乳腺癌整合防筛专委会秘书长
长江学术带乳腺联盟(YBCSG)副主任委员
四川省国际医学交流促进会乳腺肿瘤专委会主委
四川省抗癌协会乳腺癌专委会副主委
四川省医师协会乳腺专业分会副会长
四川省预防医学会乳腺疾病预防与控制分会常委、青委主委
四川省肿瘤学会乳腺肿瘤专委会副主委
第三届“人民好医生·金山茶花计划”乳腺癌领域杰出贡献奖
暗藏危机,HR+/HER2-早期乳腺癌面临复发风险挑战
在中国,乳腺癌是女性发病率第2的恶性肿瘤,据统计,2022年中国乳腺癌发病人数为35.7万人[3]。其中,超过90%为早期乳腺癌患者[4]。HR+/HER2-是乳腺癌中最常见的分子亚型,约占所有乳腺癌的70%[1]。辅助内分泌治疗是HR+/HER2-早期乳腺癌标准治疗方案之一。然而,美国真实世界研究显示,II-III期HR+/HER2-早期乳腺癌患者接受辅助内分泌治疗±化疗后,5年、10年的复发风险(ROR)分别为26.1%、45.0%[5]。中国国家癌症数据库的统计数据显示,中国I-III期HR+/HER2-乳腺癌的3年和5年无复发生存(RFS)率分别为87.3%和77.5%[6]。越来越多的真实世界研究和临床实践证实,HR+/HER2-早期乳腺癌经单纯辅助内分泌治疗后复发风险仍不容小觑。
对于HR+/HER2-早期乳腺癌,远处转移是复发的主要形式[7]。HR+/HER2-早期乳腺癌一旦发生远处转移,则会发展为无法治愈的疾病[8]。因此,精准识别HR+/HER2-早期乳腺癌高复发风险人群,有助于为患者制定个性化治疗方案,抓住早期治愈良机,改善患者生存预后。
循证溯源,辨析HR+/HER-早期乳腺癌复发风险的因素
国内外指南对于复发风险的界定已充分表明乳腺癌复发风险与多个因素相关,临床实践中需要综合考量、权衡其对预后的影响,避免过度治疗或治疗不足。在已知的风险因素中,淋巴结转移、肿瘤大小、组织学分级、Ki-67水平、多基因检测评分与HR+/HER2-早期乳腺癌复发风险高度相关[9]。本期将逐一分析不同风险因素的循证医学证据,探寻HR+/HER2-早期乳腺癌高复发风险人群的“边界”。
淋巴结转移
淋巴结转移是影响早期乳腺癌复发风险非常重要的独立预后因素[10,11]。2024美国临床肿瘤学会(ASCO)年会的一项研究显示,淋巴结阴性(N0)、1-3个淋巴结转移(N1)、4-9个淋巴结转移(N2)的I-III期HR+/HER2-早期乳腺癌患者接受辅助内分泌治疗±化疗后,3年复发率分别为5%、6%、13%[10]。一项荟萃分析结果表明,N0、N1和N2的HR+/HER2-早期乳腺癌患者的5年复发率分别可达6%、10%和22%,而20年复发率分别可达22%、31%和52%[11]。以上两个研究数据显示,随着淋巴结转移数量增多,HR+/HER2-早期乳腺癌复发风险也升高。尽管淋巴结转移对于HR+/HER2-早期乳腺癌复发风险的影响毋庸置疑,但这并非是唯一需要考量的风险因素。
肿瘤大小
在早期乳腺癌诊断中,淋巴结转移、肿瘤大小都是TNM分期的关键指标,多项研究证实肿瘤大小对HR+/HER2-早期乳腺癌复发风险的影响。一项纳入46027位I-III期HR+/HER2-乳腺癌患者的研究显示,肿瘤大小>5cm可显著增加患者的复发风险,3年、5年复发率分别为21%和28%[12]。另一项研究也得出了相似的结论,即肿瘤大小≥5cm的HR+/HER2-早期乳腺癌患者复发风险显著升高[13]。对于肿瘤大小2-5cm的患者,如果存在其他高危因素,如淋巴结转移,则复发风险也显著升高[14]。荟萃分析结果显示,肿瘤大小2-5cm伴N0、N1、N2的HR+/HER2-乳腺癌患者经内分泌治疗后5年复发率分别为19%、26%、41%[14]。因此,在HR+/HER2-早期乳腺癌患者复发风险评估时,肿瘤大小是重要的考量指标。
组织学分级
组织学分级同样是影响乳腺癌预后的独立风险因素之一,且与肿瘤生物学行为、临床结局密切相关[15]。在HR+/HER2-乳腺癌患者中,组织学分级较高可显著升高复发风险[10]。一项研究显示,在淋巴结阴性的HR+/HER2-乳腺癌患者中,组织学1级、2级、3级患者经单纯辅助内分泌治疗后10年复发率分别为7%、14%、31%[15]。另一项长期随访研究中,组织学1级患者的整体生存预后较好;组织学3级患者的复发风险高,生存结局较差;而组织学分级2级的患者虽然在疾病随访早期展现出较好的结局,但长期随访显示这部分患者存在持续复发和长期生存预后受损的趋势[15]。这证实,组织学分级2级、3级的HR+/HER2-乳腺癌患者均存在不容忽视的复发风险。
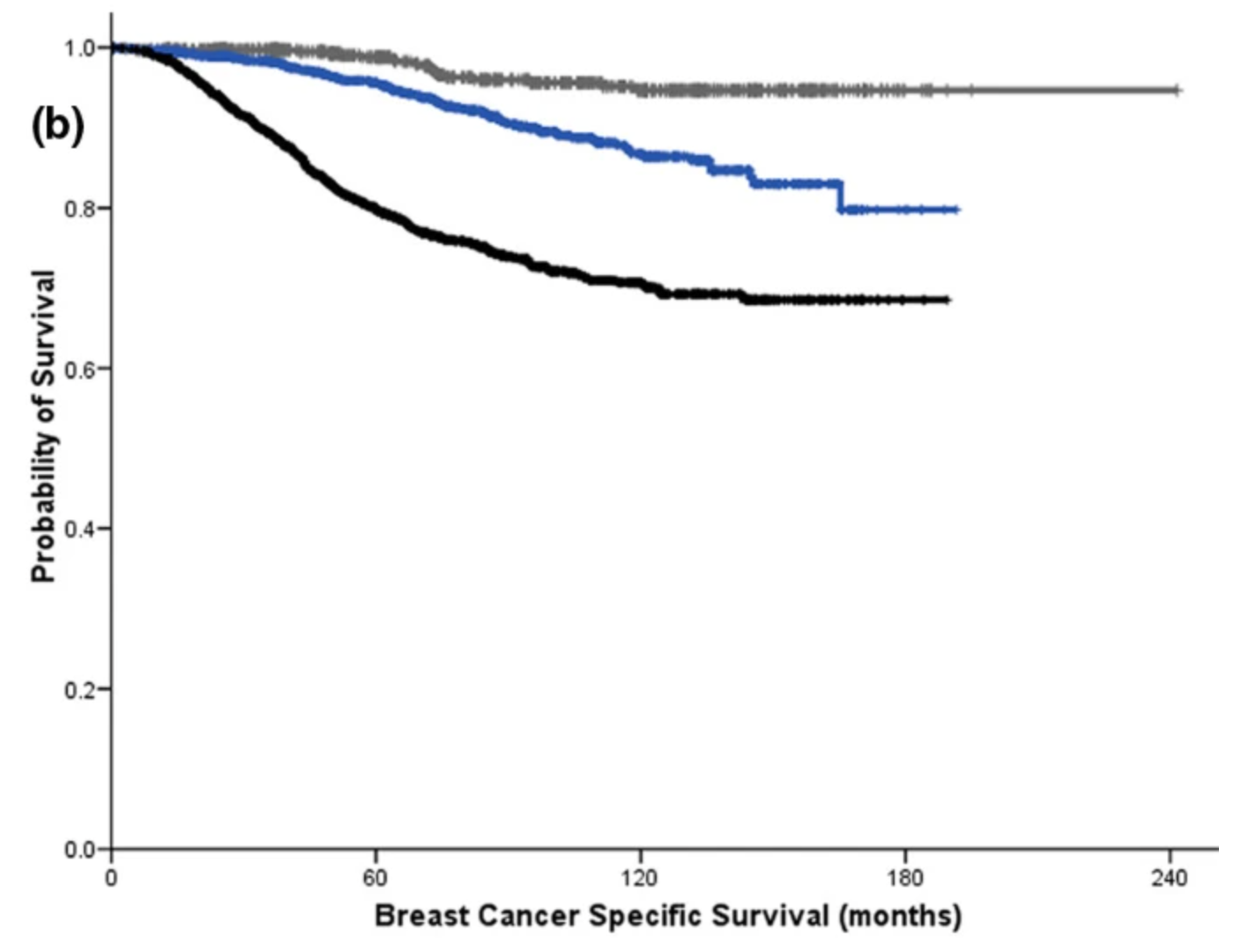
Ki-67
Ki-67是一种反应肿瘤细胞增殖速度的生物标志物,其高表达与乳腺癌生长、转移风险增加相关。研究证实,Ki-67表达水平高与HR+/HER2-早期乳腺癌预后不良相关[16]。一项研究显示,在HR+/HER2-早期乳腺癌患者中,相较Ki-67<20%患者,Ki-67≥20%患者的5年远处复发率(17.6% vs 25.9%)和10年远处复发率(28% vs 35.5%)显著增高[16]。另一项单中心回顾性研究显示,Ki-67<10%、Ki-67 10%-19%、Ki-67≥20%的HR+/HER2-早期乳腺癌的5年无病生存(DFS)率分别为90%、89%、77%[17]。以上数据证实,Ki-67表达水平有助于识别预后不良的HR+/HER2-早期乳腺癌患者。
多基因检测
多基因检测是通过分析多个与肿瘤发生、发展相关基因来预测评估HR+/HER2-早期乳腺癌患者复发风险。oncotype DX复发评分系统是目前临床使用最广泛的多基因表达谱检测工具,在预测乳腺癌预后、远期复发和指导临床治疗方面提供了重要信息[18]。在TAILORx研究中,将oncotype RS评分≥26定义为高危[19]。该研究的长期随访结果显示,多基因检测高危的HR+/HER2-早期乳腺癌患者尽管接受了辅助化疗和内分泌治疗,仍有较高的复发、死亡风险[19]。此外,MammaPrint、EndoPredict、PAM50等多基因检测工具在识别乳腺癌复发风险方面的临床价值均已得到研究证实[18]。在HR+/HER2-早期乳腺癌诊疗方面,多基因检测或将进一步识别具有高复发风险特征的人群,为个体化治疗提供指导。
综上所述,HR+/HER2-早期乳腺癌的复发风险与临床病理因素、多基因检测评分密切相关。然而,单个因素或不同因素组合究竟是否会导致HR+/HER2-早期乳腺癌复发风险升高仍需结合更多循证医学证据来判断。2024圣安东尼奥乳腺癌国际会议(SABCS)公布的中国国家癌症数据库回顾性研究显示,HR+/HER2-早期乳腺癌伴以下特征之一:①所有淋巴结阳性;②N0合并肿瘤大小T3-T4;③N0且肿瘤大小T2,合并高危复发因素(G3,或G2伴Ki-67≥20%,或G2伴多基因检测高危)患者的复发风险约是其余早期患者的3倍(HR=2.90,95%CI 2.08-4.04)[20]。这项研究证实中国具有高复发风险特征的HR+/HER2-早期乳腺癌人群不仅包含淋巴结阳性的患者,还包括淋巴结阴性但合并其他高危因素的患者,多因素共同考量帮助识别规避早期复发风险。
运筹帷幄,助力HR+/HER2-早期乳腺癌患者走向治愈
近年来,随着手术、放疗以及内分泌治疗等辅助治疗方案的升级,疾病管理的规范,HR+/HER2-早期乳腺癌患者的治愈率逐步得到改善,但不管是N+还是N0伴高危因素的患者复发风险都存在不容忽视的威胁与隐患。临床中即便是N0的患者仍需进一步考量多种复发风险因素,综合分析全面评估,从而更好地制定个体化辅助治疗策略,帮助患者走向治愈。
审批码KIS0040495-89455,有效期为2025-02-25至2026-02-24,资料过期,视同作废
[1] https://seer.cancer.gov/statfacts/html/breast-subtypes.html
[2] Holleczek, Bernd et al. Risk of loco-regional recurrence and distant metastases of patients with invasive breast cancer up to ten years after diagnosis - results from a registry-based study from Germany. BMC cancer vol. 19,1 520. 30 May. 2019.
[3] 邬昊, 吕青. 全球及中国乳腺癌的流行病学趋势及防控启示:2018–2022年《全球癌症统计报告》解读. 中国普外基础与临床杂志, 2024, 31(7): 796-802.
[4] Zeng H, et al. Lancet Public Health. 2021;6(12):e877-e887. 4. Benitez Fuentes JD, et al. JAMA Oncol. 2024;10(1):71-78.
[5] Joyce O'Shaughnessy, et al.2022 SABCS P3-03-12.
[6] Li Q, Jiang MX, Liu JX, et al. Evaluation of the Early Risk of Recurrence in HR+/HER2- Early Breast Cancer Patients A Retrospective Study Based on the Chinese National Cancer Database. SanAntonio: SABCS abstract,2024:P3-12-09.
[7] Real-world (RW) risk of recurrence among patients (pts) diagnosed with stage II-III HR+/HER2- early breast cancer (EBC) treated with endocrine therapy (ET) in the US.
[8] Cescon DW, et al. Therapeutic Targeting of Minimal Residual Disease to Prevent Late Recurrence in Hormone-Receptor Positive Breast Cancer: Challenges and New Approaches. Front Oncol. 2022 Feb 10;11:667397.
[9] Zambelli A, Gallerani E, Garrone O, et al. Working tables on Hormone Receptor positive (HR+), Human Epidermal growth factor Receptor 2 negative (HER2-) early stage breast cancer: Defining high risk of recurrence. Crit Rev Oncol Hematol. 2023;191:104104.
[10] Giuseppe Curigliano, et al. 2024 ASCO abstract 541.
[11] Pan H, Gray R, Braybrooke J, Davies C, Taylor C, McGale P, Peto R, Pritchard KI, Bergh J, Dowsett M, Hayes DF; EBCTCG. 20-Year Risks of Breast-Cancer Recurrence after Stopping Endocrine Therapy at 5 Years. N Engl J Med. 2017 Nov 9;377(19):1836-1846.
[12] Zhou J, et al. Population-based recurrence rates among older women with HR-positive, HER2-negative early breast cancer: Clinical risk factors, frailty status, and differences by race. Breast. 2021 Oct;59:367-375.
[13] Nelson DR, et al. Breast cancer-specific mortality in early breast cancer as defined by high-risk clinical and pathologic characteristics. PLoS One. 2022;17(2):e0264637. Published 2022 Feb 25. doi:10.1371/journal.pone.0264637
[14] Foldi J, et al. Defining Risk of Late Recurrence in Early-Stage Estrogen Receptor-Positive Breast Cancer: Clinical Versus Molecular Tools. J Clin Oncol. 2019;37(16):1365-1369.
[15] Rakha EA, et al. Breast cancer prognostic classification in the molecular era: the role of histological grade. Breast Cancer Res. 2010;12(4):207.
[16] Martín M, et al. Long-term outcomes of high-risk HR-positive and HER2-negative early breast cancer patients from GEICAM adjuvant studies and El Álamo IV registry. Breast Cancer Res Treat. 2023;201(2):151-159. doi:10.1007/s10549-023-07002-1
[17] Fasching, Peter A et al. Prognostic effect of Ki-67 incommon clinical subgroups of patients with HER2-negative, hormone receptor-positive early breast cancer. Breast cancer research and treatment vol. 175,3(2019):617-625.
[18] 张莉华等. 激素受体阳性乳腺癌常用复发风险预测工具研究现状. 中国临床医学.2024年6月,第31卷,第3期. DOI:10.12025/j.issn.1008-6358.2 024.20231824.
[19] Iles K, Roberson ML, Spanheimer P, et al. The impact of age and nodal status on variations in oncotype DX testing and adjuvant treatment. NPJ Breast Cancer. 2022;8(1):27. Published 2022 Mar 1. doi:10.1038/s41523-022-00394-1
[20] Li Q, Jiang MX, Liu JX, et al. Evaluation of the Early Risk of Recurrence in HR+/HER2- Early Breast Cancer Patients A Retrospective Study Based on the Chinese National Cancer Database. SanAntonio: SABCS abstract, 2024: P3-12-09.
排版编辑:肿瘤资讯-CYX











 苏公网安备32059002004080号
苏公网安备32059002004080号


