表皮生长因子受体(EGFR)20号外显子插入(ex20ins)是EGFR的第三大突变亚型,该突变类型具有恶性程度高、异质性强、预后差的特点,传统治疗手段疗效有限。好消息是,近日,国家药品监督管理局(NMPA)正式批准埃万妥单抗联合化疗用于经检测确认携带EGFR ex20ins突变的局部晚期或转移性NSCLC成人患者的一线治疗,该方案在III期临床试验中被证实疗效优于化疗且安全性可控,是目前EGFR ex20ins突变NSCLC领域唯一*获得此类数据支持的一线治疗方案,革新了EGFR ex20ins突变NSCLC一线治疗格局。肿瘤资讯特邀北京大学肿瘤医院赵军教授分享关于EGFR ex20ins突变NSCLC一线治疗的独到见解,并深入解读此次获批对于中国人群的意义。
北京大学肿瘤医院胸部肿瘤中心副主任、肿瘤内科教研室主任、伦理委员会副主任委员
北京市医学奖励基金会肺癌青年委员会主任委员
北京科创医学发展基金会肺癌专委会主任委员
北京肿瘤学会肺癌专委会副主任委员
北京抗癌协会早癌筛查专委会肺癌学组组长
中国医师协会肿瘤多学科诊疗专业委员会委员
中国医药创新促进会抗肿瘤药物临床研究专业委员会委员
中国抗癌协会呼吸内镜分会委员
精准医学与肿瘤康复专委会常委
中国老年学会老年肿瘤专业委员会委员
国家技术标准创新基地医疗健康大数据专业委员会委员
中国肺癌杂志青年编委
肿瘤防治研究杂志编委
中国肿瘤临床杂志审稿专家
从困境到曙光,纵览EGFR ex20ins突变NSCLC治疗发展历程
随着对 NSCLC 认识的逐步深入,NSCLC 治疗已进入基于驱动基因的分子分型时代。EGFR 突变是 NSCLC 最常见的驱动基因,其中,EGFR ex20ins作为EGFR的第三大突变亚型,在我国,EGFR ex20ins占所有NSCLC突变类型的0.3%-2.9%,占EGFR突变的2%-5%[1]。EGFR ex20ins异质性强,迄今为止,已报道了超过100种EGFRex20ins突变亚型[1]。大多数EGFR ex20ins突变患者对传统EGFR‐TKI疗效不佳,预后较差[1]。既往EGFR ex20ins患者缺乏针对性的治疗手段,主要参照驱动基因阴性NSCLC的标准治疗。但研究发现,中国人群EGFR ex20ins突变NSCLC患者一线含铂化疗的ORR仅19.2%,中位PFS为6.4个月,患者获益有限[2]。临床仍存在极大的未被满足的治疗需求。
近年来,针对EGFR ex20ins的特异性靶向药物的研发发展迅速,但EGFR ex20ins精准治疗之路却几度折戟沉沙。其中,莫博赛替尼是一种选择性靶向EGFR ex20ins突变的EGFR-TKI,基于其单臂EXCLAIM研究结果获批二线治疗适应证[3]。但是莫博赛替尼由于III期EXCLAIM-2研究未达到主要研究终点PFS,不符合FDA授予的附条件批准上市,因而全球退市[4]。另一款靶向EGFR ex20ins的EGFR-TKI舒沃替尼在II期、单臂WU-KONG 6研究展现出治疗潜力,经独立评审委员会(IRC)评估的ORR为61%[5]。基于该研究,舒沃替尼获批二线治疗适应证。但EGFR ex20ins突变晚期NSCLC的一线治疗尚存空白,临床迫切需要安全有效的一线治疗手段。
好消息是,全人源EGFR/MET双特异性抗体埃万妥单抗在III期PAPILLON研究取得突破[6],宣告EGFR ex20ins NSCLC的一线治疗正式进入靶向治疗时代,为EGFR ex20ins突变晚期NSCLC患者带来了治疗曙光。
双靶共济,破茧新生:PAPILLON研究开启EGFR ex20ins突变NSCLC一线治疗新纪元
埃万妥单抗是首个完全人源化、同时靶向EGFR和MET的双特异性IgG1抗体,具有独特的作用机制,包括配体阻断、受体降解以及通过其优化的Fc结构域参与免疫效应细胞作用,为患者带来潜在的长期缓解及生存获益。
PAPILLON研究是首个针对EGFR ex20ins突变晚期NSCLC初治人群对照标准含铂双药化疗获得阳性结果的III期研究,旨在评估埃万妥单抗联合化疗相较于化疗一线治疗EGFR ex20ins突变晚期NSCLC的疗效和安全性,主要终点为无进展生存期(PFS)[6]。结果显示,相较于单纯化疗,埃万妥单抗联合化疗一线治疗可显著延长PFS近一倍(11.4 vs 6.7个月,HR=0.40,95%CI 0.30-0.53;P<0.001),降低患者疾病进展或死亡风险达60%,且两组PFS曲线在早期即出现明显分离,提示联合治疗方案起效迅速。两组18个月PFS率为31% vs 3%,埃万妥单抗联合化疗组中1/3的患者在治疗1年半后仍无疾病进展或死亡,显示出其疗效的“长拖尾效应”。另外,亚洲亚组、中国亚组中显示出同样的PFS获益趋势(亚洲:11.5 vs 5.6个月,HR=0.34,95%CI 0.23-0.49;P<0.001)(中国:12.3 vs 6.7个月,HR=0.47,95%CI 0.26-0.85;P=0.011),与总体人群结果相似[7,8]。安全性方面,埃万妥单抗联合化疗在总体人群和中国人群中因埃万妥单抗相关不良反应而至治疗中止率分别为7%和0%[6,8],整体安全性可控。
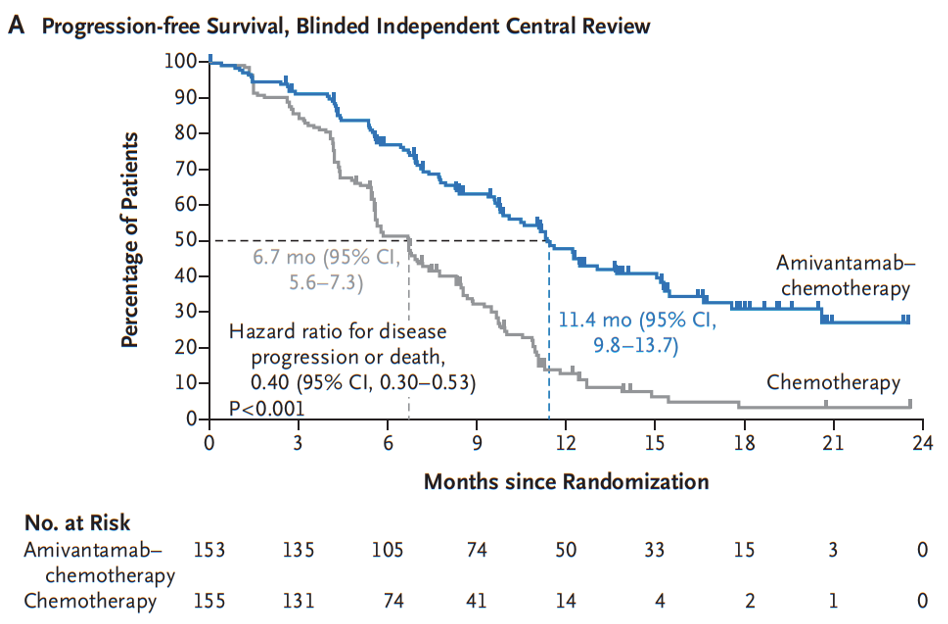
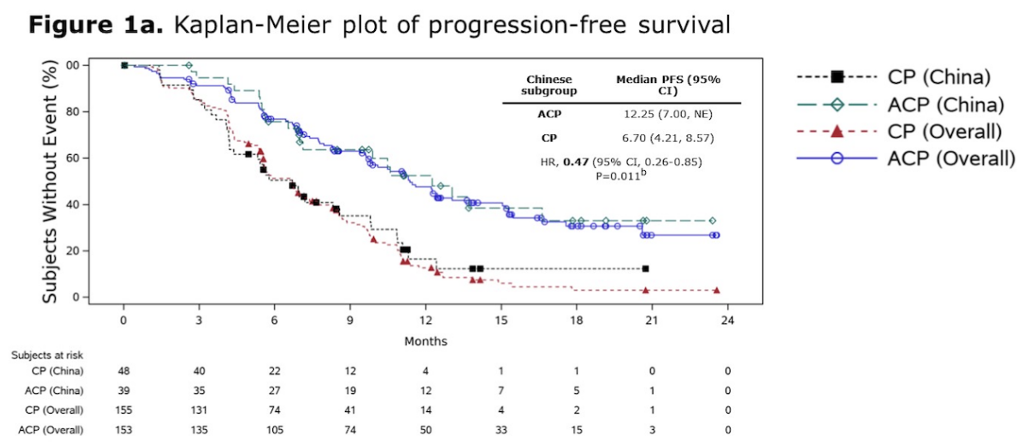
基于埃万妥单抗联合化疗方案具有良好的疗效、持久的缓解和可控的安全性,埃万妥单抗联合含铂双药化疗已被《NCCN非小细胞肺癌临床实践指南(2025.3版)》列为EGFR ex20ins突变晚期NSCLC患者的一线治疗优选[9]。而此次获批的EGFR ex20ins突变NSCLC的一线治疗是埃万妥单抗相关方案在中国获批的第一个适应症,强势开启了EGFR ex20ins突变NSCLC中国人群一线治疗新篇章。
埃万妥单抗国内获批上市,为EGFR ex20ins突变NSCLC患者带来治疗新希望
近日,埃万妥单抗联合化疗在中国首次获批适应症,用于经检测确认携带EGFR ex20ins突变的局部晚期或转移性NSCLC成人患者的一线治疗,为我国EGFR ex20ins突变NSCLC治疗格局带来了重大改变。既往,针对EGFR ex20ins突变晚期NSCLC批准的适应证大多为二线及后线治疗,EGFR ex20ins突变晚期NSCLC患者一线治疗存在大量未满足的需求。埃万妥单抗联合化疗作为国内首个针对EGFR ex20ins突变局部晚期或转移性NSCLC一线治疗的获批方案,填补了该领域的治疗空白,为中国EGFR ex20ins突变晚期NSCLC患者带来了一线靶向治疗选择。此次埃万妥单抗联合化疗一线治疗适应证的获批,也标志着我国EGFR ex20ins突变NSCLC的治疗进入了一个全新的阶段。该方案的出现使得这类患者有了更多的治疗机会,提高了治疗可及性。这不仅意味着患者的生存期得以延长,也体现了我国精准治疗领域的不断进步。期待未来,随着更多精准治疗药物的研发和临床应用,推动EGFR ex20ins突变的治疗进入更加精准和规范的新时代。
精准医疗再升级,规范化检测助力EGFR ex20ins治疗更进一步
随着越来越多的EGFR ex20ins治疗药物获批进入临床,EGFR ex20ins的精准检测显得愈发重要。《EGFR 20外显子插入突变非小细胞肺癌规范化诊疗中国专家共识(2024版)》建议,EGFR ex20ins可采用聚合酶链式反应(PCR)和二代测序(NGS)进行检测[1]。而在我国临床实际应用中,由于检测成本和可及性等因素,初次检测使用PCR技术的情况更为多见。但由于EGFR ex20ins的强异质性,PCR检测对EGFR ex20ins不同亚型的检测覆盖率只有19%-58%,使得PCR检测对EGFR ex20ins有较高的漏检率[1]。相较于PCR,NGS检测几乎可以全面覆盖EGFR ex20ins的不同亚型,敏感性及特异性更优。因此,基于组织样本的NGS是目前优选的检测手段[1]。且对于PCR检测驱动基因全阴性的患者,建议在条件允许的情况下使用NGS进行复测。
未来,医学研究领域应建立针对EGFR ex20ins的大数据平台,以便全面了解中国EGFR ex20ins阳性患者的临床病理特征和分子流行病学特征,从而为临床诊疗提供更精准的治疗;其次,研究人员还应进一步探讨液体活检等分子检测技术在治疗动态监测中的应用,力求优化患者从诊断到治疗的全程管理策略。相信随着精准检测的进一步探索,以及更多临床研究的持续推进,埃万妥单抗相关方案将实现更为深入和广泛的应用。同时,随着临床治疗和管理经验的不断积累,也将进一步推动EGFR ex20ins突变NSCLC患者实现高质量长生存的目标。
[1] 吴凤英,周斐.EGFR 20外显子插入突变非小细胞肺癌规范化诊疗中国专家共识(2024版)[J].中国肺癌杂志,2024,27(07):485-494.
[2] Yang G, Li J, Xu H, et al. EGFR exon 20 insertion mutations in Chinese advanced non-small cell lung cancer patients: Molecular heterogeneity and treatment outcome from nationwide real-world study. Lung Cancer. 2020;145:186-194.
[3] Gonzalvez F, Vincent S, Baker TE, et al. Mobocertinib (TAK-788): A Targeted Inhibitor of EGFR Exon 20 Insertion Mutants in Non-Small Cell Lung Cancer. Cancer Discov. 2021;11(7):1672-1687.
[4] Jänne PA, Wang BC, Cho BC, et al. First-Line Mobocertinib Versus Platinum-Based Chemotherapy in Patients With EGFR Exon 20 Insertion-Positive Metastatic Non-Small Cell Lung Cancer in the Phase III EXCLAIM-2 Trial. J Clin Oncol. Published online January 29, 2025.
[5] Wang M, Fan Y, Sun M, et al. Sunvozertinib for patients in China with platinum-pretreated locally advanced or metastatic non-small-cell lung cancer and EGFR exon 20 insertion mutation (WU-KONG6): single-arm, open-label, multicentre, phase 2 trial. Lancet Respir Med. 2024;12(3):217-224.
[6] Zhou C, Tang KJ, Cho BC, et al. Amivantamab plus Chemotherapy in NSCLC with EGFR Exon 20 Insertions. N Engl J Med. 2023;389(22):2039-2051.
[7] Caicun Zhou, et al. Amivantamab plus chemotherapy vs chemotherapy as a first-line treatment among Asian patients with EGFR exon 20 insertion-mutated advanced non-small cell lung cancer (NSCLC): PAPILLON subgroup analysis.2023 ESMO ASIA. 513MO.
[8] Ke-Jing Tang, Baogang Liu, Yu Yao, et al. Amivantamab plus chemotherapy vs chemotherapy as first-line treatment among patients with EGFR exon 20 insertion–mutated advanced non-small cell lung cancer (NSCLC): PAPILLON Chinese subgroup analysis. 2024 ASCO, 8606.
[9] NCCN非小细胞肺癌临床实践指南.2025.v3.
*截至发布日期
CRC Code: EM-176620
Approved Date: 2025-02-19
✅ “本资料仅用于医学、科学交流,可能涉及尚未在中国获批的产品和适应症。强生创新制药不支持、不鼓励任何未被批准的药品/适应症使用。”
✅ “本资料中涉及的AE/SS/PQC已按照公司的要求上报。”(适用于含AE/SS/PQC的资料)











 苏公网安备32059002004080号
苏公网安备32059002004080号


