文章摘要
III期不可切除非小细胞肺癌患者治疗策略以根治性放化疗为主。然而在该治疗模式下,驱动基因阳性的III期患者治疗需求远远没有被满足。
免疫治疗和靶向治疗都分别是非小细胞肺癌治疗重要的研究与实践方向。对于原发性MET 高拷贝数扩增合并 PD-L1 高表达的III期非小细胞肺癌患者,靶向、免疫或靶免联合治疗的价值都缺乏成熟经验,MET抑制剂联合PD1抑制剂的疗效值得探索,但联合用药安全性需高度关注。本文分享一例MET抑制剂赛沃替尼联合PD1抑制剂信迪利单抗治疗的NSCLC患者,旨在为临床实践提供具有参考价值的经验与启示。
非小细胞肺癌(NSCLC)中MET 异常包括 MET 基因第 14 号外显子跳跃突变(METex14 跳突)、MET基因扩增、MET 基因点突变(主要是激酶区突变)、MET 基因融合及 MET 蛋白过表达等。其中,原发 MET 基因扩增的发生率为 1%-5%,通常与较高的组织学分级、较晚的临床分期以及不良预后有关 [1]。有研究显示,MET-TKI在GCN扩增的患者中存在积极的疗效,尤其是GCN>10的患者,且疗效应答与MET扩增的拷贝数密切相关 [2-4]。
PDL1的表达水平与PD1抑制剂的疗效相关性已经临床研究及真实世界数据的反复验证。国内外指南一致推荐,PDL1>50%的患者可推荐PD1或PDL1抑制剂单药治疗。身体状况许可的患者推荐PD1的联合治疗方式。
此次分享人民医院胸外科一例III期不可切NSCLC患者的治疗。该患者确诊时明确为NSCLCIII期,经多学科诊疗团队(MDT)讨论,胸外科指出手术需要右肺中下叶切除,不排除右全肺切除的可能,建议新辅助治疗后重新评估手术可能。基因特征上,该患者同时存在 MET高拷贝数扩增和PD-L1高表达,伴有SMARCA4表达缺失。经MDT讨论,予以赛沃替尼联合信迪利单抗治疗。治疗早期肿瘤出现快速缓解,实现影像完全缓解(CR),但最终因出现4级免疫相关不良反应(免疫相关肺炎和肝炎)停药。积极处理后不良反应得以快速控制并良好转归,末次随访至2024年12月10日,患者仍持续临床CR状态,中位无进展生存期(PFS)达21个月。希望该病例的经验能为III期驱动基因阳性NSCLC患者的临床诊治提供更多思路。
病例介绍
基本信息:男性,66岁
主诉:痰中带血15天,发现肺占位 10 天。
辅助检查:
2023年3月1日出现咳嗽咳痰,痰中带血,3月5日行胸部 CT 检查示右肺下叶占位,长径约6.6cm。完善PET-CT 检查示右肺下叶背段占位,大小约 8.0*4.1*9.1 cm,考虑恶性。SUVmax 12.1,7组淋巴结放射性摄取增高,SUVmax 3.0。
2023年3月6日行 EBUS-TBNA,(右肺肿物)穿刺病理为:淋巴细胞背景中可见巢片状肿瘤成分,细胞异型明显,核分裂象易见。免疫组化结果:CK7(+),CK20(-),CK5/6(-),P40(-),p63(+),NapsinA(+),TTF-1(+),SMARCA4(-),Ki-67(80%+)。PD-L1 TC 80%。考虑为非小细胞肺癌,腺癌可能。(R4、7组)淋巴结未见明确恶性证据。
2023年3月27日二代测序(NGS)检测示:MET GCN = 16.79,SMARCA4 Pq788*,TMB 5.01Muts/M,PD-L1 TPS 70%,CPS 70。
入院诊断:右肺下叶非小细胞肺癌 腺癌可能 (cT4N0M0 IIIA期);MET扩增(GCN 16.79)SMARCA4缺失。
诊疗经过
1、多科协作,综合评估
患者局部晚期NSCLC诊断明确,经MDT讨论,符合新辅助治疗指征,决定予患者新辅助治疗后重新评估手术可行性。对于新辅助治疗方案的选择,治疗团队考虑到患者PDL1高表达,原发MET高拷贝数扩增,高Ki67指数,伴有SMARCA4缺失,分子类型特殊,预后不佳,患者及家属治疗态度积极,手术意愿强烈,存在极高的靶向和免疫双向获益,超出常规治疗疗效可能。但风险和获益并存,经与家属反复讨论并签署知情同意,决定尝试赛沃替尼联合信迪利单抗联合治疗,旨在通过精准靶向和PD-1抑制剂的联合治疗,实现协同增效快速控制肿瘤,争取最大根治手术机会。
2、治疗启动,迅速起效
患者于2023年3月31日使用赛沃替尼400 mg QD联合信迪利单抗 200mg q21d治疗。治疗开始10天后即4月11日,患者主诉咳嗽性状改变,余未诉特殊不适。立即复查肺CT,发现病灶已明显缓解,疗效评估为 PR(图 1)。肿瘤的快速深度响应,显示该联合治疗方案对肿瘤治疗的有效控制,因此于4月20日进行原方案第2周期治疗,意欲争取达到病理完全缓解(PCR),奠定良好长期预后基础。
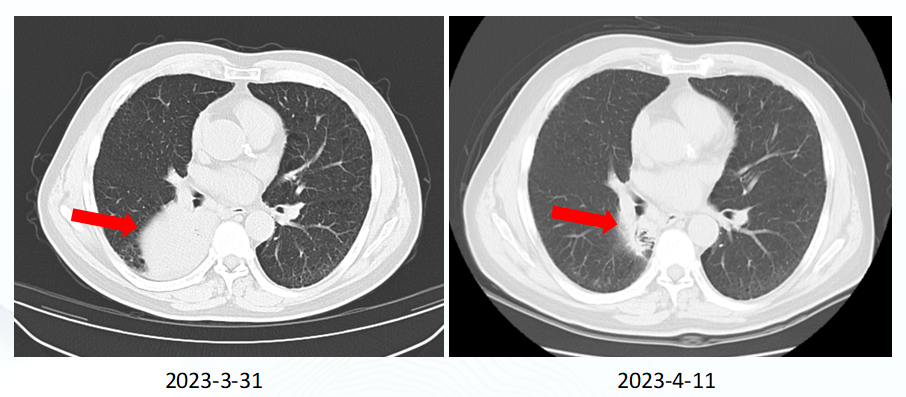
图 1. 患者治疗前后 CT 检查结果
3、隐患初现,快速应对
2023年5月11日,患者常规复查发现肝功能异常(丙氨酸氨基转移酶:1609U/L↑,天门冬氨酸氨基转移酶:680 U/L↑, γ-谷氨酰转肽酶:139U/L↑,乳酸脱氢酶:563U/L↑,总胆红素:25.4umol/L↑,直接胆红素:11.8umol/L↑),结合患者病史及治疗情况,团队考虑该肝功能异常状况和免疫治疗有关,诊断为4级免疫性肝炎。对此,医疗团队迅速制定并实施了针对性的治疗措施,即刻停止抗肿瘤治疗,给予甲泼尼龙激素治疗,并同时启用保肝药物进行肝脏功能的保护与修复。经过持续的积极治疗与密切监测,至 2023年6月20日,患者的肝功能各项指标成功恢复至正常范围。
4、祸不单行,命悬一线
影像缓解后经MDT再次评估,符合手术指征,拟择期手术。2023年6月25日,患者等待手术期间无明显诱因突发高热,Tmax 40°C,同时伴有咳喘,予以经验性抗感染治疗3天无好转,完善感染相关指标检测,结果提示降钙素原正常,甲型/乙型流感病毒阴性,新冠病毒阴性,CMV、EB、腺病毒核酸检测阴性。血气分析:pH 7.437,PaO 256.6mmHg↓,PaCO 239.9mmHg,SaO 290.5%↓,提示I型呼吸衰竭。复查肺CT示:新发双肺弥漫磨玻璃密度影(图2)。
综合患者的用药史、临床表现、实验室检查及影像学特征,考虑为重度免疫相关性肺炎。针对这一严重的免疫不良反应,胸外科联合呼吸科治疗团队,立即给予甲泼尼龙激素冲击治疗,期间依据患者疾病的动态变化及症状表现,联合免疫球蛋白及吗替麦考酚酯等药物治疗,同时给与预防性抗感染治疗,以及高流量吸氧等支持治疗措施,全方位保障患者的呼吸功能与机体代谢需求。经过近一个月的系统治疗与精心护理,患者的病情逐渐趋于稳定,并于2023年7月20日顺利出院。

图 2. 患者免疫性肺炎控制过程的检查结果
5、雨过天晴,持久获益
自2023年7月起,鉴于患者前期出现的严重免疫不良反应,医疗团队决定停止患者的抗肿瘤治疗,继续进行肺间质纤维化等遗留不良反应治疗和密切随访工作。在后续的随访期间,多次进行肺部 CT 复查,复查结果显示患者达到临床CR状态,同时,肺间质纤维化的病变程度也呈现出逐渐好转的趋势。患者的体力状况及生活质量与治疗前相比,几乎恢复至正常水平。直至2024 年12月10日进行的末次影像随访,患者的治疗效果依然维持在CR状态,且未发现任何肿瘤复发或转移的迹象。
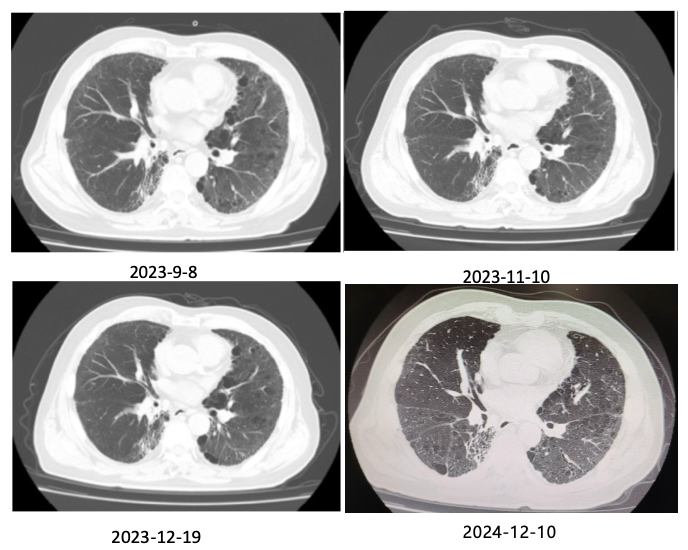
图 3. 患者历次随访 CT 检查结果

病例提供专家
常戈鋆教授:局部晚期NSCLC合并原发 MET 扩增及 PD-L1高表达,免疫联合靶向治疗起效快速且获益持久。
MET 扩增指 MET 基因拷贝数(GCN)增加,包括局部扩增和多体 2 种形式。作为原发性肿瘤驱动基因变异之一,尽管 MET 扩增在NSCLC中的发生率较低,但常与患者的不良预后有关 [1]。此外,既往研究表明,与非 MET 扩增患者相比,MET 扩增患者中 PD-L1 表达阳性、PD-L1表达≥50%的患者比例均显著更高(93% vs. 41%,P<0.0001;50% vs. 27%,P=0.020) [5]。
对于MET扩增,根据PathVysion评价标准,MET/CEP7<1.8为阴性;1.8-2.2 为低表达;2.2-5.0 为中表达;≥5.0 为高表达 [6]。在治疗方面,多项临床研究数据均提示 MET抑制剂可能为原发 MET 基因扩增的晚期 NSCLC 患者带来获益,且 MET 扩增程度越高,肿瘤应答率越高 [2,4]。本病例中,患者初诊即发现MET高拷贝数扩增,GCN 16.79,是少见的原发性MET扩增案例。
SMARCA缺失型胸部肿瘤是一种高侵袭性的恶性肿瘤,不同于传统NSCLC,预后差,侵袭性强,通常伴发远处转移,中位总生存期仅为4-7个月 [7,8]。SMARCA4-UT 是由于SMARCA4 基因失活突变导致的 SMARCA4(BRG1)蛋白表达缺失,形态表现为横纹肌样或低分化表型,多不伴有 EGFR、ALK 等常见敏感突变,鉴于其独特的临床、病理和遗传学特征,2021版胸部肿瘤WHO分类将其单独命名为“胸部 SMARCA4 缺失的未分化肿瘤(SMARCA4-UT)” [9-10]。SMARCA4缺失型NSCLC的发生率约为5%,目前多数研究认为其和SMARCA-UT仍属于不同的肿瘤分型,常规治疗无效,免疫治疗可能存在一定获益,但作为一种少见肿瘤,目前仅有少数个案或小样本的临床病例报道,对其知之甚少 [11-14]。本病例中,该患者为SMARCA4缺失型NSCLC,倾向腺癌,伴有MET高拷贝数扩增及PD-L1高表达。
患者首诊为不可切除的 IIIA 期非小细胞肺癌,伴有SMARCA4缺失,同时存在原发 MET高拷贝数扩增(GCN = 16.79)和 PD-L1 高表达(TC 80%,TPS 70%),为了争取患者的手术机会,经MDT讨论和患者知情沟通,决定使用赛沃替尼联合免疫疗法进行新辅助治疗。经联合治疗后,患者病灶迅速退缩实现PR。此后患者发生肝功能衰竭、发热、重症肺炎等严重免疫治疗相关不良反应,发热不除外靶向药物副作用,经对症治疗后恢复正常。患者继续接受原方案治疗后实现CR,至最后一次随访时PFS为21个月,提示MET抑制剂联合免疫疗法对于此类患者可能存在较好的疗效,对临床中原发 MET 高拷贝数扩增合并 PD-L1高表达肺癌患者的治疗具有参考价值,同时需要注意到患者出现了多脏器多系统的免疫相关不良反应。该患者虽经及时控制,但一度发生I型呼吸衰竭、肺间质纤维化,危及生命,警示我们在使用类似联合方案时需高度重视患者随访。
病例点评专家
燕翔教授:Ⅲ期NSCLC是高度异质性的一类群体,最为需要MDT团队的参与决策。近年来,肿瘤免疫治疗在晚期NSCLC治疗中取得了巨大进展,PACIFIC研究改变了局部晚期不可切除NSCLC的临床实践,然而同步或续贯放化疗后只有约70%患者有机会进一步接受免疫巩固治疗,实践中仍然存在着未满足的临床需求 [15]。因此,对于无法切除的III期小细胞肺癌,临床上仍在探索是否可以通过有效的新辅助治疗进行“缩瘤降期”,达到最大化的肿瘤控制,将“不可切除”转化为“可根治性切除”,为患者争取更大的生存获益。
概念验证性的Ⅱ期研究TRAILBLAZER研究纳入107例MDT确认不可切除的III期NSCLC,进行了Ⅲ期NSCLC不同治疗模式的1V1 PK [16]。研究数据显示,经过免疫联合诱导治疗,25%患者得以成功转化并接受了R0切除术,MPR率为44%,pCR率26%。同时,数据还表明,可手术患者的PFS显著优于非手术患者(29个月vs14个月,P = 0.007),证实了局部晚期不可切除NSCLC转化治疗的临床价值。
在免疫治疗获益人群方面,尽管多项研究表明,不同PD-L1表达水平的患者均可从新辅助和或辅助免疫治疗中获益,但PD-L1高表达(≥50%)患者依然是受益最大的群体。Impower010研究显示,阿替利珠单抗术后辅助免疫可显著改善PD-L1≥1%患者的DFS (HR,0.66),尤其是PD-L1>50%患者(HR=0.43) [17]。同样,在KEYNOTE-671和CheckMate 816研究中,PD-L1高表达(≥50%)亚组患者从新辅助免疫疗法中获益更多 [18,19]。那么,既然如此,在围手术期治疗阶段,PD-L1高表达患者是否仅仅需要单免疫治疗呢?CTONG1804研究结果显示,PD-L1高表达NSCLC接受单免疫(纳武利尤单抗)新辅助治疗的pCR率仅为16.7%,显著低于免疫联合治疗(纳武利尤单抗联合白紫+卡铂)41.7%的PCR率 [20]。PD-L1高表达NSCLC无疑是围手术期免疫治疗的最佳人群,但如果想要达到最佳疗效,也许免疫联合治疗,仍不失为上上策。
对于驱动突变阳性的患者来说,相比化疗而言,靶向治疗显然更为精准高效。LAURA研究改写了III期不可切除NSCLC患者的治疗格局,再次证实了靶向治疗仍然是敏感突变患者长期获益的最有效治疗 [21]。对于MET突变晚期NSCLC,MET TKI 赛沃替尼展示了其优异疗效。2024 年欧洲肺癌大会(ELCC)中公布的 IIIb 期确证性研究结果显示,赛沃替尼治疗MET ex14 跳突晚期 NSCLC患者,一线治疗的疾病控制率(DCR)为92.0%,中位无进展生存期(PFS)为13.7个月,后线治疗DCR为92.4%,中位 PFS 为 11.0个月 [22]。基于赛沃替尼的优异表现,使之成为MET突变NSCLC新辅助治疗的希望,临床个案病例显示赛沃替尼新辅助治疗起效迅速,肿瘤深度缓解,且安全性良好,具有极大潜力 [23,24]。
然而,对于MET TKI联合免疫治疗,目前尚缺乏研究数据。MET TKI和免疫抑制剂的联合仍具有诸多不确定风险。在本病例中,患者MET基因高拷贝数扩增,GCN为16.79, 远高于5的阈值,既往数据提示此类患者亦可从 MET-TKI 治疗中获益;PD-L1高表达(TC 80%,TPS 70%),又提示该患者属于新辅助免疫治疗的优势人群。对于该例 III 期不可切存在转化潜力的局部晚期NSCLC,我们需要在缩瘤的同时尽可能争取 pCR,以达到R0切除同时最大可能延长生存,因此谨慎使用了 MET 抑制剂联合 PD-1 的新辅助治疗。事实证明的确疗效显著,但毒性明显。
在本病例中,患者出现4级免疫性肝炎,后续又出现4级免疫性肺炎并引发呼吸衰竭,经过多学科团队积极处理相关不良反应后好转出院,但免疫性肺炎导致患者出现了严重的肺纤维化,损害了患者本身较弱的肺功能,综合考虑手术对肺功能的损伤后取消了患者手术计划,后续持续使用了尼达尼布抗纤维化。本例患者接近2年的病程中,抗肿瘤治疗仅持续了2个月,迅速达到深度缓解,后因重度不良反应停药,但在随后随访中判定为临床CR并保持长期缓解,至今随访已达21个月仍未发现疾病复发进展。
本案例在疾病诊断时、治疗过程中以及并发生的处理过程中,外科、肿瘤内科、病理科、影像科、呼吸科积极参与,依靠MDT的力量实现了疾病的精准诊断、个体化治疗,更实现了irAE的早监测、早处理、规范用药,使疾病得到快速缓解、长期疗效维持的同时,更使irAE得到了及时的处理及良好的转归,提示了MDT诊疗模式在肺癌诊疗全程管理中不可替代的地位和作用。
[1] 中华医学会病理学分会,国家病理质控中心,中华医学会肿瘤学分会肺癌学组,等. 非小细胞肺癌MET临床检测中国专家共识[J]. 中华病理学杂志,2022,51(11):1094-1103.
[2] Wolf J, Seto T, Han JY, et al. Capmatinib in MET Exon 14-Mutated or MET-Amplified Non-Small-Cell Lung Cancer. N Engl J Med. 2020;383(10):944-957.
[3] Sequist LV, Han JY, Ahn MJ, et al. Osimertinib plus savolitinib in patients with EGFR mutation-positive, MET-amplified, non-small-cell lung cancer after progression on EGFR tyrosine kinase inhibitors: interim results from a multicentre, open-label, phase 1b study. Lancet Oncol. 2020;21(3):373-386.
[4] Camidge DR, Otterson GA, Clark JW, et al. Crizotinib in Patients with MET-Amplified NSCLC[J]. J. Thorac. Oncol. 2021, 16, 1017–1029.
[5] Domènech M, Muñoz Marmol AM, Mate JL, et al. Correlation between PD-L1 expression and MET gene amplification in patients with advanced non-small cell lung cancer and no other actionable oncogenic driver[J].Oncotarget. 2021 Aug 31;12(18):1802-1810.
[6] 俞晓晴, 徐艳珺, 范云. c-MET 通路和抑制剂在非小细胞肺癌中的研究进展[J]. 中国肺癌杂志. 2017, 20(4): 287-292.
[7] Sauter JL, Graham RP, Larsen BT, Jenkins SM, Roden AC, Boland JM. SMARCA4-deficient thoracic sarcoma: a distinctive clinicopathological entity with undifferentiated rhabdoid morphology and aggressive behavior. Mod Pathol. 2017. 30(10): 1422-1432.
[8] Yoshida A, Kobayashi E, Kubo T, et al. Clinicopathological and molecular characterization of SMARCA4-deficient thoracic sarcomas with comparison to potentially related entities. Mod Pathol. 2017. 30(6): 797-809.
[9] Nicholson AG, Tsao MS, Beasley MB, et al. The 2021 WHO Classification of Lung Tumors: Impact of Advances Since 2015. J Thorac Oncol. 2022. 17(3): 362-387.
[10] Rekhtman N, Montecalvo J, Chang JC, et al. SMARCA4-Deficient Thoracic Sarcomatoid Tumors Represent Primarily Smoking-Related Undifferentiated Carcinomas Rather Than Primary Thoracic Sarcomas. J Thorac Oncol. 2020. 15(2): 231-247.
[11] Shi L, Lin L, Ding Y, Zeng Y, Chen X. Case report: A rapid response to immunotherapy in a thoracic SMARCA4-deficient undifferentiated tumor with respiratory failure. Front Oncol. 2022. 12: 1020875.
[12] Utsumi T, Taniguchi Y, Noda Y, Fukai M, Kibata K, Murakawa T. SMARCA4-deficient undifferentiated tumor that responded to chemotherapy in combination with immune checkpoint inhibitors: A case report. Thorac Cancer. 2022. 13(15): 2264-2266.
[13] Lin YT, Li CF, Wu HC, Jan YH, Kuo YH. Case report: Heterogenous SMARCA4-deficient thoracic non-small cell lung carcinoma with various responses to nivolumab. Front Immunol. 2023. 14: 1131448.
[14] Kawachi H, Kunimasa K, Kukita Y, et al. Atezolizumab with bevacizumab, paclitaxel and carboplatin was effective for patients with SMARCA4-deficient thoracic sarcoma. Immunotherapy. 2021. 13(10): 799-806.
[15] Spigel DR, Faivre-Finn C, Gray JE, et al. Five-Year Survival Outcomes From the PACIFIC Trial: Durvalumab After Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer [published correction appears in J Clin Oncol. 2022 Jun 10;40(17):1965.
[16] Zhou Q, Pan Y, Yang X, et al. Neoadjuvant SHR-1701 with or without chemotherapy in unresectable stage III non-small-cell lung cancer: A proof-of-concept, phase 2 trial. Cancer Cell. 2024;42(7):1258-1267.e2.
[17] Felip E, Altorki N, Zhou C, et al. Overall survival with adjuvant atezolizumab after chemotherapy in resected stage II-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase III trial. Ann Oncol. 2023;34(10):907-919.
[18] Spicer JD, Garassino MC, Wakelee H, et al. Neoadjuvant pembrolizumab plus chemotherapy followed by adjuvant pembrolizumab compared with neoadjuvant chemotherapy alone in patients with early-stage non-small-cell lung cancer (KEYNOTE-671): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2024;404(10459):1240-1252.
[19] Awad MM, Forde PM, Girard N, et al. Neoadjuvant Nivolumab Plus Ipilimumab Versus Chemotherapy in Resectable Lung Cancer. J Clin Oncol. Published online January 8, 2025.
[20] Liu SY, Dong S, Yang XN, et al. Neoadjuvant nivolumab with or without platinum-doublet chemotherapy based on PD-L1 expression in resectable NSCLC (CTONG1804): a multicenter open-label phase II study. Signal Transduct Target Ther. 2023;8(1):442.
[21] Lu S, Kato T, Dong X, et al. Osimertinib after Chemoradiotherapy in Stage III EGFR-Mutated NSCLC. N Engl J Med. 2024;391(7):585-597.
[22] Lu S, et al. A phase IIIb study of savolitinib in patients with locally advanced or metastatic NSCLC harboring MET exon 14 mutation. ELCC 2024. 1MO.
[23] Li R, Liu X, Xu Y, et al. Remarkable pathological response to neoadjuvant tepotinib in lung adenocarcinoma with MET exon 14 skipping mutation: A case report. Thorac Cancer. 2024;15(32):2339-2343.
[24] Chen L, Chen JF, He JT, Rong H, Zhuang X, Peng J. Neoadjuvant savolitinib targeted therapy for stage IIIB-N3 lung adenocarcinoma harboring mesenchymal-epithelial transition exon 14 skipping mutation: a case report and literature review. Anticancer Drugs. 2024;35(5):445-449.
排版编辑:肿瘤资讯- Vicky











 苏公网安备32059002004080号
苏公网安备32059002004080号


