作者:骆玥君,黄真,刘巍峰
骨与软组织肉瘤是起源于间质与结缔组织细胞的恶性肿瘤,主要包括恶性骨肿瘤和软组织肉瘤两大类,是一类异质性极高、病理亚型多和治疗难度较大的恶性肿瘤。近年来,随着各种分子检测、高通测序、靶向药物和免疫治疗的蓬勃发展,骨与软组织肿瘤的药物治疗也涌现出良好的前景。本文旨在盘点2024年骨与软组织肿瘤药物治疗进展,以期为相关医务工作者梳理治疗及研究思路,协助将最新药物治疗更好地应用到临床实践中。
一、 新辅助治疗前沿探索
新辅助治疗作为骨与软组织肉瘤治疗中重要的一环,其对缩小肿瘤体积/降期,提高手术的彻底性和保肢率有着至关重要的作用,2024年多项临床研究探索了不同的新辅助治疗方案在骨与软组织肉瘤中疗效和安全性。
1. 骨肉瘤方面:新辅助化疗为骨肉瘤经典治疗手段,随着靶向及免疫药物的不断涌现,尤其抗血管生成小分子TKI在晚期骨与软组织肉瘤中的疗效获得认可,骨肉瘤的联合新辅助治疗的领域探索尤其在国内备受关注。2024年ASCO会议上公布了一项华西医院牵头的单臂、多中心II期临床试验(ALTER-S002)最新随访结果,安罗替尼联合多柔比星和顺铂应用于IIB期肢体骨肉瘤新辅助治疗,入组患者的12个月和24个月无事件生存期(EFS)率分别达到84.18%与73.43%,保肢手术率达80.39%,在接受手术治疗后有12例患者(23.53%)出现复发和转移,24个月的总生存期(OS)率达到了95.92%;而在安全性方面,主要的不良反应包括骨髓抑制和高血压,其中3级以上不良反应发生率为82.69%,展示了TKI联合经典化疗在骨肉瘤新辅助治疗领域的潜在可行性[1]。
 ALTER-S002试验EFS生存分析图[1]
ALTER-S002试验EFS生存分析图[1]
2.软组织肉瘤方面:蒽环类药物联合异环磷酰胺作为软组织肉瘤不论在新辅助、辅助和晚期软组织肉瘤患者中均为基石药物,仍然在接受其他方案的挑战。
GD方案(吉西他滨联合紫杉醇)为较常见的晚期软组织肉瘤二线方案,仍在尝试往术前新辅助治疗领域进行探索。一项比较AI方案(多柔比星联合异环磷酰胺)和GD方案在肢体和躯干软组织肉瘤新辅助治疗的随机对照临床研究的最终结果公布,AI方案和GD方案的5年OS率分别为90%与76.1%(HR 2.67,95% CI 1.23-5.8),5年PFS率分别是65.2%与57.4%(HR 1.33,95% CI 0.81-2.18),与既往临床研究结果类似,GD方案未表现出与AI方案相当的疗效,但是在不良反应事件方面GD方案毒性更低,对于化疗不能耐受、年龄偏大、对蒽环类药物有用药顾忌患者,可作为一个备选方案 [2]。
2024年ASCO会议中公布了最新的根据病理亚型选择特异性方案的软组织肉瘤新辅助化疗疗效(ISG-STS1001)探索结果,该研究一共纳入了未分化多形性肉瘤UPS、平滑肌肉瘤LMS、恶性外周神经鞘瘤MPNST、滑膜肉瘤SS和黏液样脂肪肉瘤MLPS五种类型肉瘤,比较了EI方案与不同肉瘤亚型个体化方案的疗效,结果提示EI方案依旧是软组织肉瘤的标准方案。同时,该研究还评估了236例具有可测量病灶患者的生存预后,基于RECIST疗效评价标准,其中28例患者实现PR,192例患者达到SD和13例患者PD,相较于PD、SD患者,PR患者获得更好的生存预后。在亚型方面,MLPS生存预后最佳,MPNST患者预后最差[3]。
一项针对四肢和肢体STS的新辅助放疗与手术伴或不伴帕博丽珠单抗治疗的多中心、随机Ⅱ期临床试验中,一共纳入143例患者,所有患者随机分为新辅助放疗与手术组(SOC组)和新辅助帕博丽珠单抗同步放疗然后手术与辅助帕博丽珠单抗组(EXP组)。帕博丽珠单抗给药方案为(200 mg,IV,Q3W,3剂)在放疗之前、期间和之后给药,最多14个辅助周期。EXP组和SOC组2年DFS率分别为72.5% VS 54.5%(P=0.042),两组患者LRFS、DDFS以及OS无统计学差异。亚组分析中发现病理分级在3级以上的患者中,两组之间的DFS差异更为显著。同时EXP组和SOC组3级以上不良反应率分别为52% VS 26%(P=0.002)[4]。
二、术后辅助治疗
术后辅助治疗是骨与软组织肉瘤非常重要的辅助手段,是有效减少复发及转移风险的有效手段,一项由复旦大学附属肿瘤医院牵头的安罗替尼用于软组织肉瘤术后辅助治疗的II期临床研究中,入组患者随机分为安慰剂和试验组,随访结果显示安罗替尼能有效降低53%(HR 0.47,P=0.0445)的软组织肉瘤术后复发风险,同时试验组和安慰剂组1年和2年DFS分别为88% VS 64%、77% VS 58%。同时亚组分析结果表明粘液纤维肉瘤和未分化多形性肉瘤获益最多。目前中位DFS尚未成熟,期待长期随访结果给患者实现更多的生存获益[5]。
三、晚期治疗
骨与软组织肿瘤晚期和复发患者的治疗方案一直是临床上亟待突破的临床难题,如何有效改善晚期复发肉瘤患者的临床生存预后是当下的重点研究方向。2024年国内外多家医院及研究中心发表了多项相关临床试验结果。
1、化疗联合免疫/靶向治疗的探索:抗血管生成TKI联合化疗是晚期骨与软组织肉瘤晚期的常用探索方案,免疫联合化疗或靶向是另外一个热门领域。
一项针对复发和难治性骨肉瘤的多中心随机临床研究中,探究异环磷酰胺+依托泊苷(IE方案),联合或不联合阿帕替尼的治疗效果。本研究共入组81例患者,其中28例为IE方案,53例IE联合阿帕替尼方案,联合组PFS为5.5个月vs 3.4个月(p=0.001),ORR为32.1%(IE方案组为25%),DCR 可达90.6%(IE方案组60.7%),3级以上不良事件发生率69.8% VS 64.3%,最常见的毒性反应为白细胞及粒细胞下降[6]。
由华西医院开展的探究艾瑞布林联合安罗替尼在化疗失败或无法接受化疗的晚期软组织肉瘤中的治疗效果的研究中,给药方案为艾瑞布林1.1mg/m2 d1,8 联合 安罗替尼12mg d1-14 Q3W,完成6-8个周期联合治疗后使用安罗替尼单药维持。在29例可评估疗效的患者中,ORR为20.7%,DCR为82.8%,24周PFR为65.5%,中位PFS为7.52个月,目前中位OS尚未成熟 [7]。
韩国开展的PD-L1单抗联合多柔比星一线治疗软组织肉瘤的Ⅰ/Ⅱ期临床研究中,一共纳入44例患者,ORR为31.7%,其中1例CR、12例PR,中位PFS为8.2个月,中位OS为24.1个月。3-4级以上毒性反应主要是骨髓抑制和贫血 [8]。
北京积水潭医院联合复旦中山医院开展的多中心、II期临床试验中,重点探究了对于蒽环类药物或者安罗替尼治疗失败后的晚期肉瘤患者应用小分子TKI药物索凡替尼联合吉西他滨方案的疗效。在蒽环类化疗失败的队列中,共17例入组,64.7%有肺转移,ORR为17.65%,DCR为82.35%,中位PFS为4.37个月,值得注意的是肺转移的患者中位PFS获益更多达11.66个月,优于非肺转移患者的3.7个月。在安罗替尼治疗失败的队列中,中位PFS是3.25个月,8周PFR为87.5% [9]。安罗替尼在国内已获得软组织肉瘤二线治疗适应症,此研究为二线治疗失败后的患者提供一个选择方案。
一项浙江大学附属第二医院开展的一项多中心回顾性研究中,针对既往接受过TKI药物治疗失败后,探究后线治疗应用呋喹替尼为基础方案的骨与软组织肉瘤患者的疗效。一共纳入2个中心的124例患者,其中骨肉瘤56例(45.2%),尤文肉瘤28例(22.6%),软骨肉瘤7例(5.6%),软组织肉瘤33例(22.6%)。后线治疗方案中,18例应用呋喹替尼单药方案、24例联合白蛋白紫杉醇治疗,31例联合伊立替康或者拓扑替康,15例联合抗PD-1/L1免疫治疗。最终22例实现PR、78例患者实现SD,中位PFS和中位OS分别为4.4个月和11.4个月[10]。
在一项针对尤文肉瘤接受抗血管TKI治疗的荟萃分析中,一共纳入10项研究共包含191例患者,其中约有48.6%患者为2线治疗后,分析结果提示总ORR为30.1%,DCR为66.8%,中位PFS为4.4(3.5-16)个月,在所有TKI药物中,安罗替尼的ORR为63.6%,与其他TKI药物相比最高,但是其DCR则与其他TKI药物无差异。同时,与TKI单药方案相比,TKI联合化疗有更高的ORR(p=0.04)和DCR(p=0.05)[11]。
2、靶向药物单药治疗
一项探究索凡替尼应用于骨软组织肉瘤标准化疗失败后单臂多中心Ⅱ期临床试验更新了最新随访结果。该研究中46.4%患者为2线治疗后,主要的病理亚型包括脂肪肉瘤(11例)、平滑肌肉瘤(8例)、滑膜肉瘤(4例)、纤维肉瘤(4例)和其他类型。在41例可评估疗效的患者队列中,结果显示21周的无进展率51.22%,总ORR为11.2%,总DCR为86.4%,2线治疗的ORR为19.05%(1例CR,3例PR)。中位随访9.92个月,2线治疗患者中位PFS为6.8个月,2线后治疗患者中位2.7个月。亚组分析中,LMS的中位PFS为7.13个月,LPS为3.78个月;同时未接受过安罗替尼治疗的患者PFS更长(4.4 VS 3.2个月)。在治疗毒性方面,14例患者出现3级以上的不良反应,主要为高血压、蛋白尿和高脂血症等 [12]。
3、新型化疗组合探寻
羟氯喹为4-氨基喹啉衍生物类抗疟药,在骨与软组织肉瘤中鲜少应用。GD方案为晚期骨肉瘤患者常用二线方案,但疗效报道差别较大。由MD Anderson开展的吉西他滨、多西他赛联合羟氯喹对晚期骨肉瘤治疗作用的研究中,在纳入的31例患者中,中位OS为12.7个月,ORR为13%,其中1例达CR、3例达PR、13例SD和11例PD。3例治疗周期超过4个月的患者最终接受了转移灶手术切除,均实现病理完全缓解,该新型治疗方案对晚期骨肉瘤患者治疗显示了一定的潜力,尤其是化疗后获得根治性手术切除的获益病例[13]。
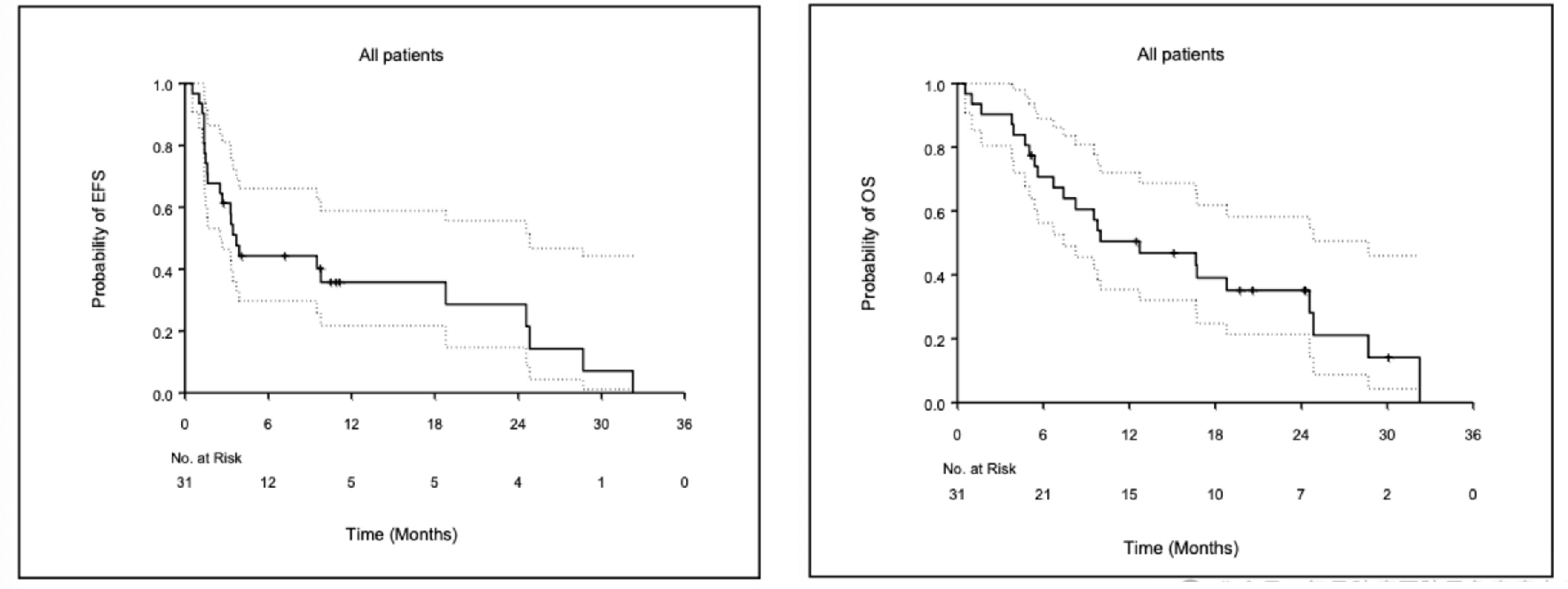 吉西他滨、多西他赛联合羟氯喹方案EFS以及OS分析图[13]
吉西他滨、多西他赛联合羟氯喹方案EFS以及OS分析图[13]临床上一线治疗失败的复发和转移的尤文肉瘤患者预后极差,进展快、生存期短,治疗亟待更多治疗上的突破。一项曲贝替定联合低剂量伊立替康用于复发尤文肉瘤的Ⅱ期临床试验结果提示,该研究共纳入18例患者,5例患者实现PR,ORR率达28%,相较于传统治疗方案表现出较高的ORR率,同时无毒性相关死亡发生,在晚期尤文肉瘤标准治疗失败后的治疗提供了一个选择机会[14]。
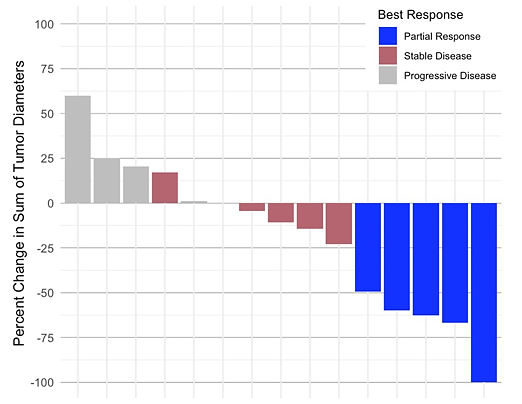
曲贝替定联合低剂量伊立替方案治疗反应瀑布图[14]
4、靶向联合免疫治疗的探究
一项舒凡替尼和纳武利尤单抗联合在晚期去分化软骨肉瘤的II期临床试验结果显示,患者中位PFS为5.6个月,中位OS为10.3个月,展现出良好的疗效和耐受性,期待后续的随访结果带来更多的惊喜 [15]。
国内开展探索信迪利单抗联合安罗替尼应用于治疗失败后的肉瘤中的单臂II期临床研究,共入组54例患者,总ORR达到30.95%,DCR76.19%,中位PFS为5.1个月,目前中位OS尚未成熟,同时还发现三级淋巴结构(TLS)阳性的患者疗效更佳,其ORR和PFS获益更多[16],也有助于探寻预测免疫治疗疗效标记物,更好地在众多软组织肉瘤亚型中筛选出免疫治疗有效人群。
2024ASCO中一项国外开展的瑞戈非尼联合抗PD-L1在TLS阴性的软组织肉瘤的单臂多中期临床研究中,一共入组49例TLS阴性的软组织肉瘤患者,疗效方面在中位随访7.1个月后,ORR为9.4%,CBR为48.8%,6个月PFS为16.3%,中位PFS为2.1个月,中位OS达15.1个月。在毒性反应方面,3级以上毒性反应71.4%,因毒性停药的比例为8%。同时研究还发现患者在治疗后,肿瘤微环境中CD8+T细胞浸润增加,所有患者治疗后的样本中多种免疫细胞浸润增加,初步证实了瑞戈非尼对肉瘤肿瘤微环境存在一定的免疫激活作用[17]。
在一项软骨肉瘤的PD-1单抗(Nivolumab)联合sunitinib应用于去分化软骨肉瘤的Ⅱ期临床研究中,在纳入的23例疗效评估队列中,患者中位PFS为5.6个月,6个月无进展率为10/23(CR+PR+SD,46%),未达到研究预设终点[15]。
5、新型药物的尝试
MSKCC牵头开展的WEE1抑制剂Azenosertib联合吉西他滨应用于复发难治性骨肉瘤的一期临床爬坡研究中,该研究共纳入31例患者,目前MTD剂量设置为Azenosertib 150mg QD d1-5 QW+Gem 800mg/m2,其中17/28患者达到61%,18周EFS率为39%,在安全性方面,3级以上不良反应主要为骨髓抑制,无4级不良反应发生[18]。
2024年ASCO会议上公布了一种靶向B7-H3的抗体偶联药物(HS-20093)应用于复发和难治性骨肉瘤的最新II期临床研究结果,结果提示ORR达17.4%,DCR达87%,展现出较好的抗肿瘤疗效和可接受的毒性,最常见的3级以上不良反应主要是骨髓抑制。期待ADC药物能够给骨肉瘤的治疗带来更多的惊喜 [19]。
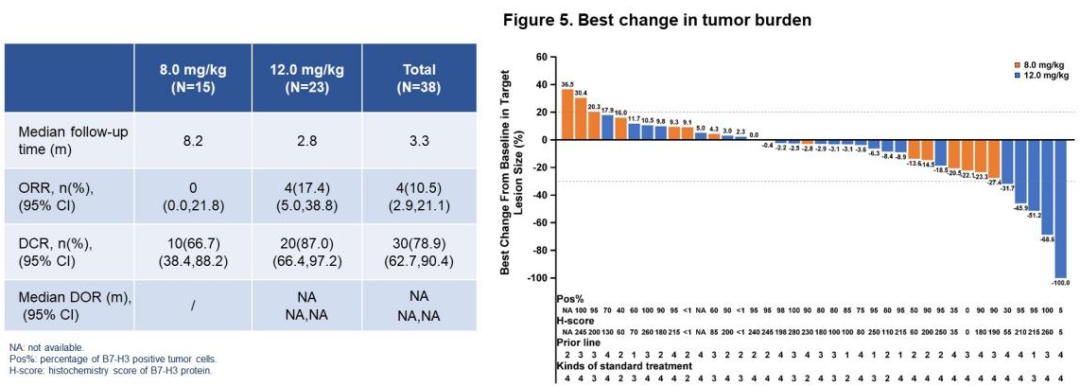
HS-20093药物治疗反应瀑布图[19] 北京大学肿瘤医院联合中山大学肿瘤中心牵头一项开放标签的探索TCR-T细胞免疫治疗在晚期软组织肉瘤应用的单臂Ⅰ期临床研究,目前该研究纳入8名患者,初步的研究结果提示最佳缓解率达50%(基于RECIST1.1标准),同时中位无进展生存期约5.9个月,该研究仍在长期随访中。现有的随访数据也表现出较好的潜力,为TCR-T细胞疗法后续的临床研究带了极大的鼓舞 [20]。
EZH2抑制剂在上皮样肉瘤疗效探索的Ⅱ期临床试验中,共入组17例患者。其中9例患者接受过抗PD-1治疗,6例接受过抗血管药物治疗,在最终14例的疗效评估队列中,9例实现了12周仍未进展,达到了研究预设的终点,包括3例达到PR,8例达 SD。安全性方面,大部分为较轻的不良反应,主要包含血液学不良反应 [21]。
一项4-1BB激动剂(LVGN6051)联合安罗替尼肉瘤后线治疗的Ⅰb/Ⅱ期临床研究中,一共纳入39例患者,在30例可评价的患者中,DCR为83.3%,其中包含2例PR和23例SD,ORR率为6.7%,目前所有PR和接近PR的患者目前都在继续接受治疗中,期待后续随访结果报道[22]。
最新晚期肢体软组织肉瘤中瘤内注射结合系统治疗的研究中,探究了瘤内注射SQL生物聚合物联合多柔比星前体(SQP33)静脉注射的疗效,该方案能够使药物靶向肿瘤精准释放,提高疗效,降低毒性,一共纳入14例患,DCR为71%,ORR为14.3%,最常见的不良反应为恶心乏力,血液毒性较低 [23]。
核输出XPO1抑制剂联合PD-L1单抗(Atezolizumab)在晚期软组织肉瘤中的Ⅱ期临床试验中,共纳入6例患者,包括2例硬化性上皮样纤维肉瘤、1例LMS、1例血管肉瘤、1例ASPS和1例去分化脂肪肉瘤,目前未发生因毒副反应终止治疗,未发生4-5级毒副反应,不良反应为1-2级,主要包括恶心和乏力等,目前所有患者仍在随访观察中 [24]。
最新的探究溶瘤病毒OH2联合PD-1单抗(HX008)在晚期肉瘤中的Ⅱ期研究中,一共纳入26例患者,其中7例OH2单药,19例应用联合治疗方案,两组患者的ORR分别为0%与16.7%,DCR分别是14.3%和50%,中位PFS分别是1.4和2.1个月,中位OS分别为4.5和22.3个月。其中血管肉瘤和纤维肉瘤疗效最佳,1例AS治疗周期已超过1年 [25]。
表观遗传药物异柠檬酸脱氢酶1抑制剂(IDH1抑制剂,Olutasidenib)应用于不可切除或晚期软骨肉瘤的临床研究结果显示,一共纳入23例患者,3级以上不良反应率48%,13%患者因不良反应停药,在21例可评估的随访队列中,11例患者达SD,8例PD,中位PFS为2.71个月。同时有2例患者持续临床获益,其中1例患者脑转移得到一定缓解。IDH1抑制剂在软骨肉瘤治疗中展现出较好的潜力[26]。
一项探究CDK2/4/6抑制剂治疗未分化脂肪肉瘤的II期临床试验中,共入组26例患者,其中23例患者纳入疗效评估队列,其研究终点的12周PFS率为63.6%,ORR8.7%,DCR78.3%,中位PFS4.7个月。安全性方面3级以上毒副反应率30.8%,主要涉及血液学毒性[27]。
6、特殊亚型的软组织肉瘤的特效药的出现
以Pexidartinib为代表的CSF1R抑制剂的出现给TGCT的治疗提供了全新的策略。ENLIVEN研究显示,接受Pexidartinib组和安慰剂组患者的ORR率分别为39% VS 0%(P<0.0001)[28],此外Pexidartinib还能显著改善患者躯体功能和僵硬度[29],在2024年CSCO最新指南中已经将Pexidartinib应用于有症状、不可切除TGCT的Ⅱ级推荐。
最新的NCCN指南中已经将以Nirogacestat为代表的γ分泌酶口服抑制剂作为硬纤维瘤患者全身治疗的1类推荐,其是首个被批准于硬纤维瘤患者的药物。DeFi临床试验中,与安慰剂组相比,接受Nirogacestat治疗的患者疾病进展风险降低71%,同时安慰剂组和试验组ORR分别为8% VS 41%,在安全性方面两份不良反应发生率分别为69% VS 72%。该药物在疗效和安全性方面都表现突出,为硬纤维瘤患者的治疗带来新的希望[30]。
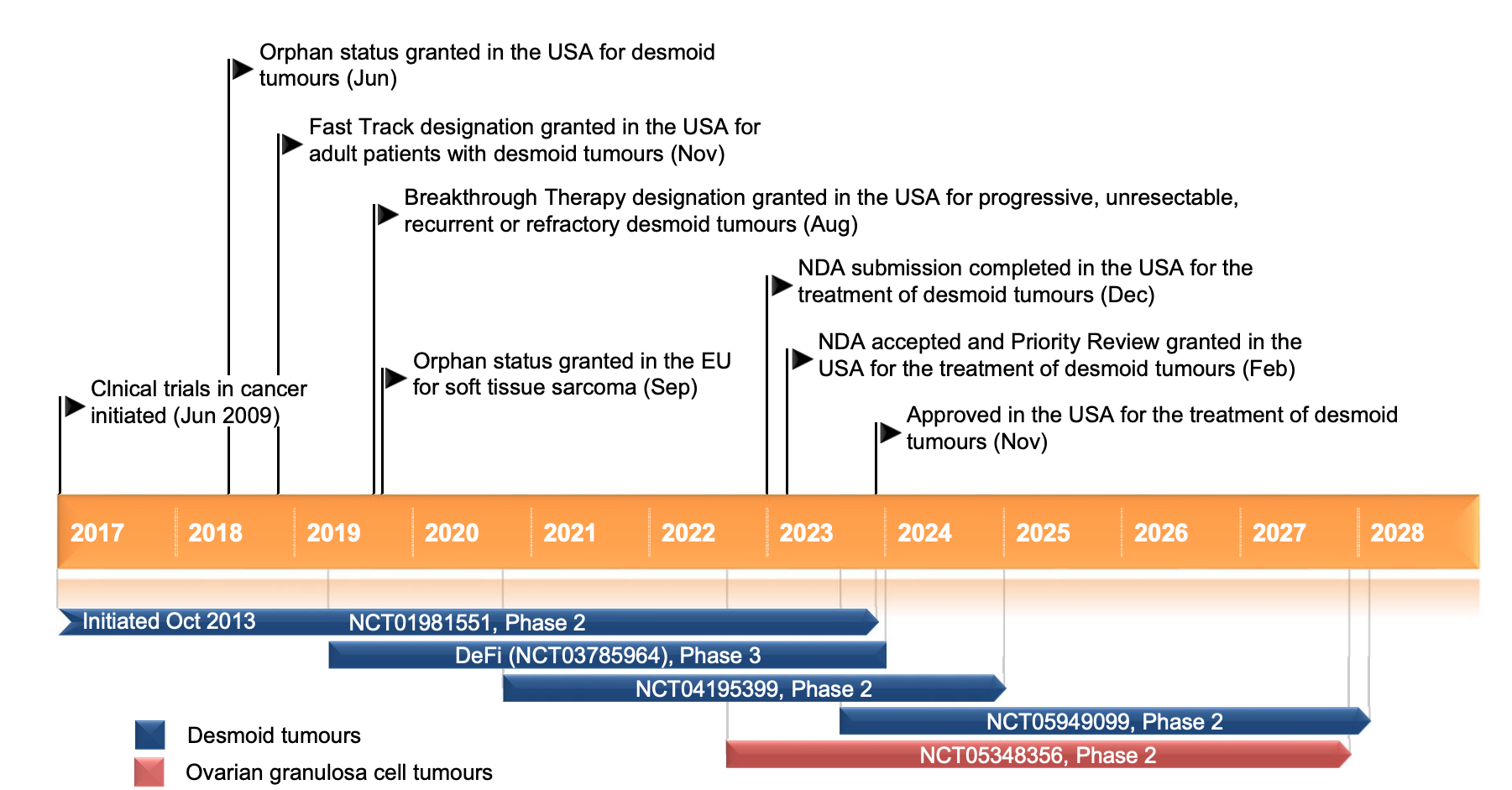 Nirogacestat在肿瘤治疗进展中的重大事件[30]
Nirogacestat在肿瘤治疗进展中的重大事件[30]
随着肿瘤药物研究的日新月异,药物治疗在骨与软组织肉瘤的标准治疗中发挥着越来越重要的作用,其对患者生活质量和生存预后发挥关键作用。目前抗血管生存靶向药物、免疫治疗、小分子抑制剂都在肉瘤的治疗中展现出显著的潜力,随着新型药物的不断开发、联合治疗策略的应用和精准医疗的推进,期待未来国内外骨与软组织肉瘤领域的专家能够开展更多基础及临床研究,为恶性骨与软组织肉瘤患者带来更多的希望和疗效。
作者简介
党支部书记
主任医师 教授 博士研究生导师
国家骨科医学中心 工作委员会委员
国家重点研发计划 首席科学家
北京市创伤骨科研究所PI
中华医学会骨科分会青委会骨肿瘤学组 副组长
北京医学会骨科分会骨肿瘤学组 组长
中国医药教育协会骨与软组织肿瘤专委会 副主任委员
CACA肉瘤专业委员会智能骨科与精准诊疗学组 组长
CACA骨肿瘤与骨转移癌专委会数字骨肿瘤学组 副组长
CACA肉瘤专业委员会基础研究及转化学组 副组长
CACA骨肿瘤与骨转移癌专委会青年学组 副组长
CSCO黑色素瘤专家委员会常务委员&青委会 副主委
CSCO肉瘤专家委员会 委员
国家卫健委儿童恶性实体瘤外科专家委员会委员
国家癌症中心国家肿瘤质控中心专家委员会委员
《中华骨科杂志》《中华外科杂志》通讯编委
毕业于北京大学医学部,肿瘤内科学博士
毕业后一直就职于积水潭医院骨肿瘤科,从事骨与软组织肉瘤的内科治疗临床工作,擅长恶性骨肿瘤和软组织肉瘤的化疗和肺转移瘤的诊断与治疗
参与多项首都发展科学基金、北京市科委、国家自然科学基金项目研究,参编多本骨肿瘤专业书籍,在核心期刊发表骨肿瘤专业论文数篇,参与并协助完成CSCO经典型骨肉瘤诊疗指南2018V1版和CSCO软组织肉瘤诊疗指南2019版的编写
CSCO肉瘤专家委员会委员
中国抗癌协会肉瘤专业委员会化疗学组委员
北京医学奖励基金会肺癌医学青年专家委员会委员
北京癌症康复与姑息治疗(CRPC)青年委员会委员
毕业于北京协和医学院
肿瘤学博士
1. Tang, F., et al., Updated results from ALTER-S002: A single-arm multicenter trial of the combination of anlotinib with chemotherapy in patients with stage IIB classic osteosarcoma of the extremity. Journal of Clinical Oncology, 2024. 42(16_suppl): p. 11529-11529.
2. Tanaka, K., et al., Final results of a randomized phase II/III study comparing perioperative adriamycin plus ifosfamide and gemcitabine plus docetaxel for high-grade soft tissue sarcomas: Japan Clinical Oncology Group study JCOG1306. Journal of Clinical Oncology, 2024. 42(16_suppl): p. 11503-11503.
3. Vanzulli, A., et al., Redefining radiologic responses (RR) in solid tumors: Shall we brace ourselves for a post-RECIST era? Results from a randomized clinical trial (RCT) on neoadjuvant chemotherapy in high-risk soft-tissue sarcomas (HR-STS) of the trunk or extremities. Journal of Clinical Oncology, 2024. 42(16_suppl): p. 11553-11553.
4. Mowery, Y.M., et al., SU2C-SARC032: A randomized trial of neoadjuvant RT and surgery with or without pembrolizumab for soft tissue sarcoma. Journal of Clinical Oncology, 2024. 42(16_suppl): p. 11504-11504.
5. Wang, C.-M., et al., Anlotinib versus placebo as adjuvant therapy for completely resected high-grade soft tissue sarcomas: Interim results of a phase 2, double-blinded, randomized controlled trial. Journal of Clinical Oncology, 2024. 42(16_suppl): p. 11562-11562.
6. Xie, L., et al., Apatinib combined with ifosfamide and etoposide versus ifosfamide and etoposide in relapsed or refractory osteosarcoma (OAIE/PKUPH-sarcoma 11): A multicenter, randomized controlled trial. Journal of Clinical Oncology, 2024. 42(16_suppl): p. 11527-11527.
7. Liu, J., et al., Safety and efficacy of eribulin plus anlotinib in patients with advanced soft tissue sarcoma (ERAS): A multi-center phase II study. Journal of Clinical Oncology, 2024. 42(16_suppl): p. 11561-11561.
8. Cho, H.J., et al., Phase IB/II trial of durvalumab plus doxorubicin combination in patients with advanced soft-tissue sarcoma. Journal of Clinical Oncology, 2024. 42(16_suppl): p. 11552-11552.
9. Zhou, Y., et al., 1740P Surufatinib combined with gemcitabine in soft tissue sarcoma (STS) patients failed with anthracyclines chemotherapy or monotherapy post-anlotinib progression: A multi-center, phase II trial. Annals of Oncology, 2024. 35: p. S1040.
10. Yang, C., et al., Efficacy and Safety of Fruquintinib-Based Treatment in Patients with Refractory Bone and Soft Tissue Sarcoma after Developing Resistance to Several TKIs: A Multicenter Retrospective Study. Orthop Surg, 2024. 16(10): p. 2380-2390.
11. Castro, C., et al., Anti-angiogenic TKIs in patients with advanced Ewing sarcoma: A systematic review and single-arm meta-analysis. Journal of Clinical Oncology, 2024. 42(16_suppl): p. 11531-11531.
12. Zhang, X., et al., Phase II study to evaluate surufatinib in patients with osteosarcoma and soft tissue sarcoma that has failed standard chemotherapy: Updated analysis. Journal of Clinical Oncology, 2024. 42(16_suppl): p. 11539-11539.
13. Livingston, J.A., et al., 1756P A phase I/II trial of gemcitabine, docetaxel, and hydroxychloroquine in advanced/metastatic osteosarcoma. Annals of Oncology, 2024. 35: p. S1046.
14. Grohar, P.J., et al., SARC037: Phase II results of trabectedin given as a 1-hour (h) infusion in combination with low dose irinotecan in patients (pts) with relapsed/refractory Ewing sarcoma (ES). Journal of Clinical Oncology, 2024. 42(16_suppl): p. 11508-11508.
15. Strauss, S.J., et al., ImmunoSarc II master trial (phase II of sunitinib and nivolumab): Results from the dedifferentiated chondrosarcoma (DDCS) cohort—A GEIS, ISG and UCL study. Journal of Clinical Oncology, 2024. 42(16_suppl): p. 11506-11506.
16. Liu, Z., et al., 1735P Sintilimab plus anlotinib in patients with advanced sarcomas (SINANLOSARC): A single-centre, single-arm, phase II trial. Annals of Oncology, 2024. 35: p. S1038.
17. Toulmonde, M., et al., Reshaping the tumor microenvironment of cold soft-tissue sarcomas with oncolytic viral therapy: a phase 2 trial of intratumoral JX-594 combined with avelumab and low-dose cyclophosphamide. Mol Cancer, 2024. 23(1): p. 38.
18. Avutu, V., et al., Phase 1 results of the WEE1 inhibitor, azenosertib, in combination with gemcitabine (gem) in adult and pediatric patients (pts) with relapsed or refractory (R/R) osteosarcoma. Journal of Clinical Oncology, 2024. 42(16_suppl): p. 11525-11525.
19. Xie, L., et al., ARTEMIS-002: Phase 2 study of HS-20093 in patients with relapsed or refractory osteosarcoma. Journal of Clinical Oncology, 2024. 42(16_suppl): p. 11507-11507.
20. Zhang, X., et al., Phase I clinical trial to assess safety, pharmacokinetics (PK), pharmacodynamics (PD), and efficacy of NY-ESO-1–specific TCR T-cells (TAEST16001) in HLA-A*02:01 patients with advanced soft tissue sarcoma. Journal of Clinical Oncology, 2022. 40(16_suppl): p. 11502-11502.
21. Zhou, Y., et al., Efficacy and safety of SHR-2554 in advanced epithelioid sarcoma: A phase 2 trial. Journal of Clinical Oncology, 2024. 42(16_suppl): p. 11549-11549.
22. Zhou, Y., et al., An open label, phase 1b/2 trial of LVGN6051 (4-1BB agonistic antibody) combined with anlotinib for refractory soft tissue sarcoma (STS). Journal of Clinical Oncology, 2024. 42(16_suppl): p. 11554-11554.
23. Bui, N., et al., Phase 2a results of SQ3370, a doxorubicin-based click chemistry therapeutic in patients with advanced STS: Planned interim analysis. Journal of Clinical Oncology, 2024. 42(16_suppl): p. 11555-11555.
24. Ahmed, J., et al., Safety and toxicity evaluation of the combination of selinexor with atezolizumab in patients with soft tissue sarcomas. Journal of Clinical Oncology, 2024. 42(16_suppl): p. 11557-11557.
25. Tan, Z., et al., A phase II study of an oncolytic herpes simplex virus 2 and an anti-PD-1 antibody in patients with advanced sarcoma. Journal of Clinical Oncology, 2024. 42(16_suppl): p. 11571-11571.
26. Jones, R.L., et al., 1721MO Safety and efficacy of olutasidenib, an IDH1 mutant inhibitor, for the treatment of recurrent/relapsed or locally advanced or metastatic IDH1 mutated chondrosarcoma. Annals of Oncology, 2024. 35: p. S1031-S1032.
27. Chen, J., et al., 1731P Phase II study of the CDK2/4/6 inhibitor TQB3616 capsules in patients with dedifferentiated liposarcomas (DDLPS). Annals of Oncology, 2024. 35: p. S1037.
28. Tap, W.D., et al., Pexidartinib versus placebo for advanced tenosynovial giant cell tumour (ENLIVEN): a randomised phase 3 trial. Lancet, 2019. 394(10197): p. 478-487.
29. Healey, J.H., et al., Pexidartinib Provides Modest Pain Relief in Patients With Tenosynovial Giant Cell Tumor: Results From ENLIVEN. Clin Orthop Relat Res, 2023. 481(1): p. 107-116.
30. Keam, S.J., Nirogacestat: First Approval. Drugs, 2024. 84(3): p. 355-361.
排版编辑:肿瘤资讯-Vicky











 苏公网安备32059002004080号
苏公网安备32059002004080号


