在乳腺癌治疗的漫漫征途中,HER2阴性晚期乳腺癌一直是极具挑战性的难题,其总生存期(OS)的突破亦步履维艰。近年来,抗体偶联药物(ADC)的问世为这一困境带来了突破性的变革。此类药物不仅在延长患者生存期方面展现出显著的疗效,更在提升患者生活品质上具有独特优势。为此,【肿瘤资讯】特邀新疆医科大学附属肿瘤医院赵兵教授,聚焦HER2阴性晚期乳腺癌,全面梳理 ADC 药物的研究脉络及 OS 获益详情,并深入探讨其在临床实践中的应用前景与深远意义。
特邀嘉宾
新疆医科大学附属肿瘤医院副院长
中国抗癌协会乳腺癌专业委员会委员
中国临床肿瘤学会(CSCO)乳腺癌专家委员会委员
中国临床肿瘤学会(CSCO)患者教育专家委员会常务委员
中国健康促进基金会乳腺疾病专家委员会常务委员
北京癌症防治学会乳腺癌精准靶向诊疗专业委员会委员
《JCO》中文版 乳腺专刊 青年编委
新疆抗癌协会康复与姑息治疗专委会候任主委
新疆抗癌协会乳腺癌专业委员会常务委员
抗肿瘤药物临床获益的“金标准”
OS是指从随机化开始至(因任何原因)死亡的时间,它相对客观、精确可测,是衡量抗肿瘤药物临床获益的最可靠终点,被誉为抗肿瘤药物临床研究终点的“金标准”。OS的改善具有统计学显著性和临床意义,可用来支持试验药物的常规新药上市申请。然而,OS研究之路布满艰难险阻,通常需要庞大的样本量与漫长的随访周期,且极易受到交叉治疗及后续干预措施的干扰。鉴于肿瘤治疗的高度复杂性,OS突破始终是医学界亟待攻克的关键难题。本文聚焦ADC药物在HER2-乳腺癌范畴内的OS获益状况,深入探讨其带来的临床获益。
抗Trop-2 ADC在
HER2-晚期乳腺癌领域的OS获益
目前,全球研发较为成熟的Trop-2 ADC主要有三种,分别为戈沙妥珠单抗(SG)、芦康沙妥珠单抗(SKB264)和Dato-DXd。它们均由Trop-2靶向单克隆抗体和具有旁观者效应的载药拓扑异构酶抑制剂通过可裂解连接子偶联而成,但在结构组成和作用机制等方面具有不同的特征。这些差异决定了它们在抗肿瘤活性方面的特异性表现。其中,SG是目前唯一在HR+/HER2-乳腺癌中达到OS终点的Trop-2 ADC,并且是唯一在HR+和HR-亚群以及全人群中均取得统计学显著OS获益的ADC药物。
表1 抗Trop-2 ADC在HER2-晚期乳腺癌领域的OS结局汇总
SG
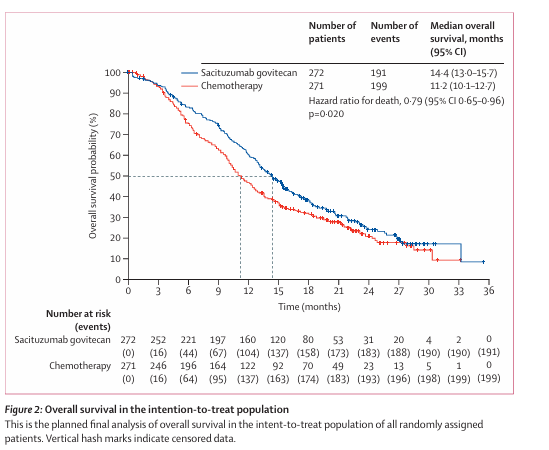
SG是全球首款靶向Trop-2的ADC,它通过将靶向Trop-2抗原的人源化IgG1抗体与伊立替康(拓扑异构酶Ⅰ抑制剂)的代谢活性物SN-38进行偶联而制成。在HR+/HER2-转移性乳腺癌(mBC)领域,关键Ⅲ期TROPiCS-02研究1,2旨在评估SG与医生选择化疗(TPC)在接受过内分泌治疗、CDK4/6抑制剂以及经历过2至4线化疗的HR+/HER2-局部晚期或mBC患者中的疗效和安全性。研究数据表明,与TPC组相比,SG 可显著改善患者的中位无进展生存期(mPFS)(5.5 个月 vs. 4.0 个月;HR=0.66,95% CI 0.53-0.83;P=0.0003)和mOS(14.4个月 vs 11.2个月),降低 21%的死亡风险(HR=0.79,95% CI 0.65-0.96;P=0.020),成功实现了PFS和OS的双重获益1,2。
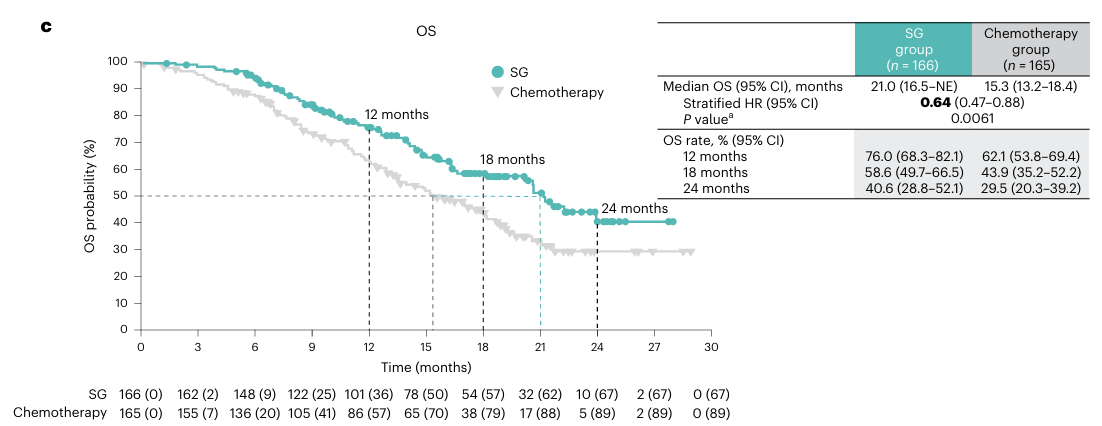
2024年10月1日,由中国医学科学院肿瘤医院徐兵河院士团队牵头开展的TROPiCS-02亚洲桥接研究EVER-132-002研究3结果发表于Nature Medicine。该研究结果显示,相较于TPC,SG能够显著延长HR+/HER2- mBC患者的mPFS,降低33%疾病进展或死亡风险(4.3个月 vs. 4.2个月; HR=0.67, 95%CI 0.52-0.87;P=0.0028),此外,SG组的mOS也显著延长,达到21.0个月,而化疗组为15.3个月3。该研究表明SG是亚洲HR+/HER2-mBC患者的一种有前景的治疗选择。
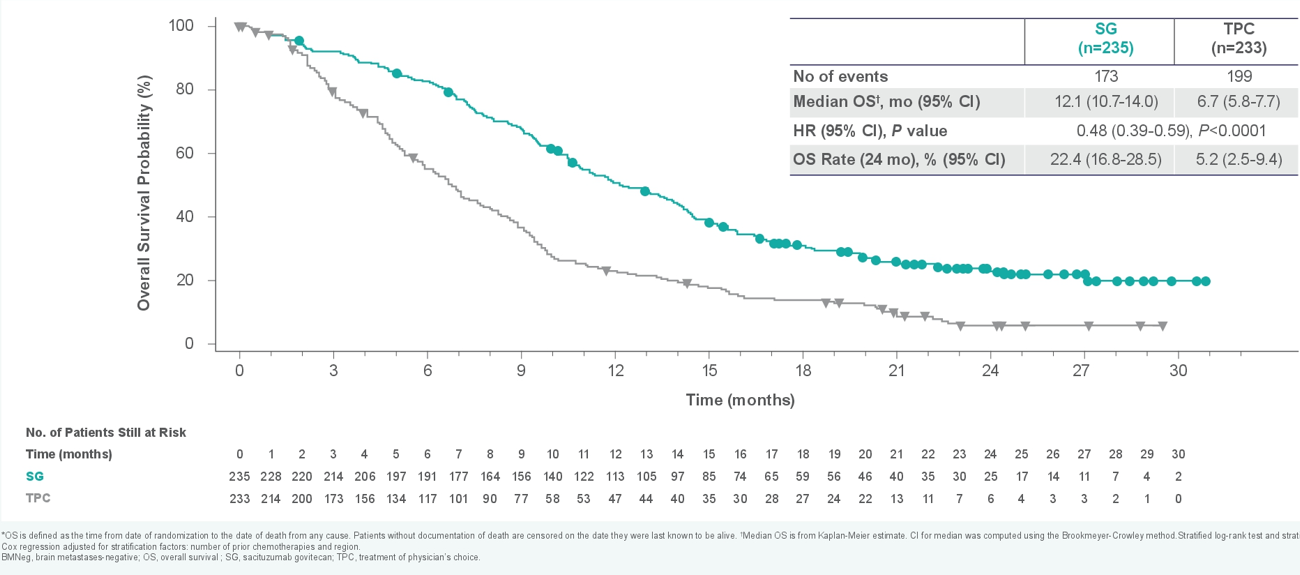
在晚期或转移性三阴性乳腺癌(mTNBC)的治疗领域中,SG已凭借Ⅲ期ASCENT研究成果,成功获得了FDA与NMPA的上市许可,用于既往至少接受过2 种系统治疗(其中至少1种治疗用于转移性阶段)的不可切除的局部晚期或mTNBC成人患者。ASCENT 研究4针对基线无脑转移人群的结果表明,SG 治疗使疾病进展风险降低了61%(5.6个月 vs. 1.7个月;HR=0.39,95%CI 0.31-0.49),同时,SG 组的mOS达到 12.1 个月,TPC 组为 6.7 个月(HR=0.48,95%CI 0.39-0.59),SG降低死亡风险达52%,同样取得了PFS和OS双获益。
SKB264
对于SKB264,其单药治疗HR+/HER2-局部晚期或mBC患者的Ⅲ期临床研究仍处于推进阶段,在中国完成首例患者的给药工作。此前,仅有一项I/II期、单臂篮子试验5评估了其在内分泌治疗进展且晚期阶段至少接受了一线化疗的HR+/HER2-mBC的疗效。该试验仅公布了PFS的结果,为 11.1 个月(95%CI 5.4-13.1),目前的OS数据尚不成熟。
在针对经治局部复发性或mTNBC的Ⅲ期OptiTROP-Breast01研究6中,SKB264 组与化疗组的mPFS分别达到 5.7个月和 2.3个月(HR=0.31;95%CI 0.22-0.45;P<0.00001);mOS分别为14.3个月和 9.4个月(HR=0.53;95%CI 0.36-0.78;P=0.0006)。
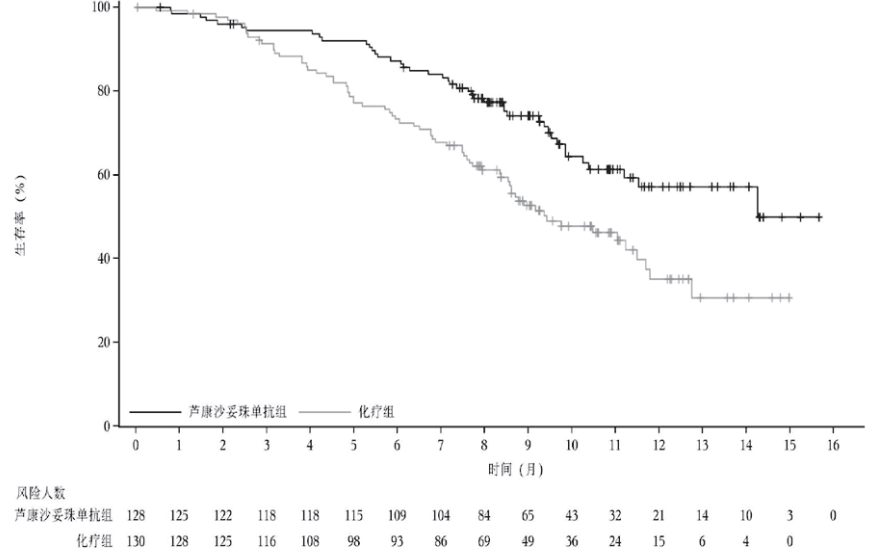
Dato-DXd
在HR+ mBC领域,Ⅲ期TROPION-Breast01研究评估了Dato-DXd对比研究者选择化疗组(ICC)用于HR+/HER2低表达或阴性(IHC1+或IHC2+/ISH-,IHC0)不可手术或mBC患者的安全性和有效性。最新公布的结果显示,Dato-DXd组经BICR评估的mPFS较ICC组延长(6.9个月 vs 4.9个月,HR=0.63,95%CI 0.52-0.76;P<0.0001),但未达到OS终点(HR=0.84,95% CI 0.62-1.14)7。Dato-DXd用于mTNBC治疗的Ⅲ期研究尚在推进中。
抗HER2 ADC在
HER2-晚期乳腺癌领域的OS获益
在抗HER2 ADC应用于HER2- mBC的领域中,目前仅T-DXd开展了相关探索工作。其中,DESTINY-Breast04(DB04)研究探索了其在HER2低表达乳腺癌中的应用,在HR+人群中达到了OS终点。
表2. 抗HER2 ADC在HER2-晚期乳腺癌领域的OS汇总
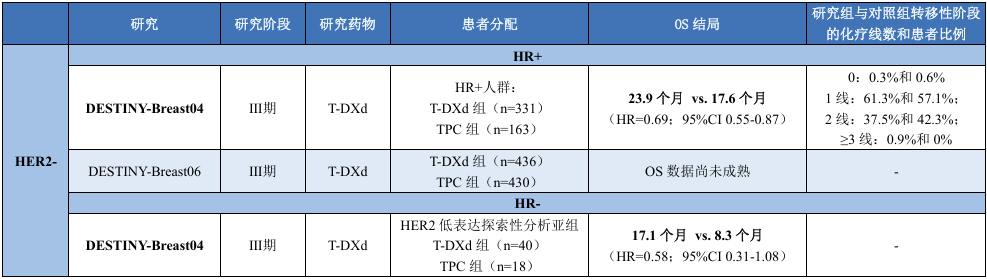
T-DXd
DB04研究8评估了T-DXd用于HER2低表达mBC的疗效和安全性。数据显示,在HR+患者中,与TPC相比,T-DXd组的mOS显著延长(23.9个月 vs. 17.6个月;HR=0.69,95%CI 0.55-0.87)8。继DB04研究后,DB06研究9探索了T-DXd对HR+、HER2(超)低表达mBC的疗效和安全性。然而,该研究的OS数据仍未成熟。
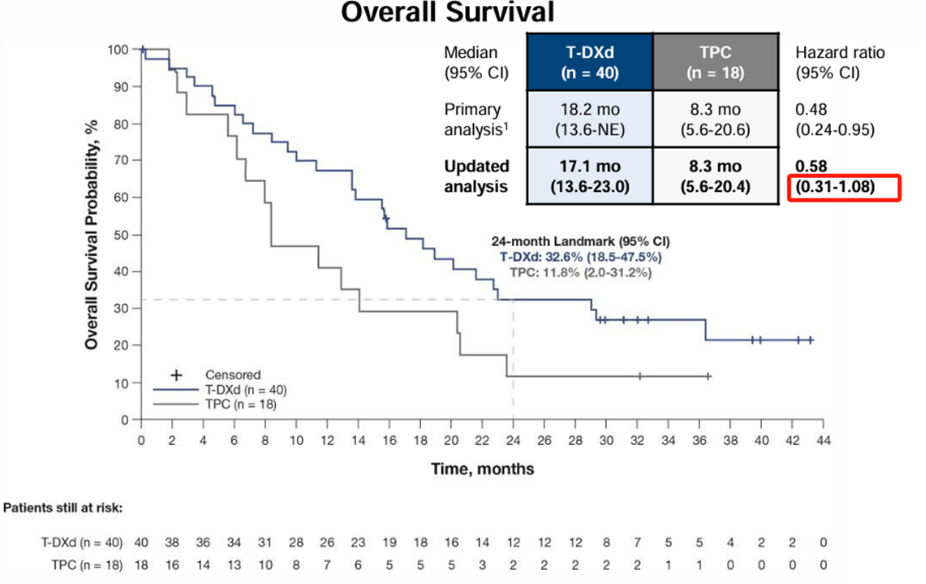
T-DXd尚未在mTNBC领域开展针对性的Ⅲ期临床研究,DB04研究8入组了58例HR-/HER2低表达乳腺癌患者,或为 T-DXd在mTNBC方面的应用提供一定参考依据。该研究HR-/HER2低表达亚组探索性分析结果显示,T-DXd组与TPC组的mPFS分别为6.3个月和2.9个月(HR=0.29;95%CI 0.15-0.57),但mOS未达到统计学意义上的显著改善(17.1个月 vs. 8.3个月;HR=0.58;95%CI 0.31-1.08)。
提升生活质量,助力患者活得更好
ADC药物精准靶向治疗的价值不仅仅体现在延长患者OS上,在提升患者生活质量方面同样表现出色。在ASCENT研究中,SG对健康相关生活质量(HRQoL)的改善作用尤为显著。基于这一成果,在ESMO转移性乳腺癌在线指南v1.1中,SG的ESMO-MCBS评分从原来的4分提升至最高等级5分,成为目前mTNBC二线治疗中唯一获得ESMO-MCBS 5分的治疗方案。这一评分的提升,充分体现了SG在改善患者生存和生活质量方面的优势。
小结
随着“精准治疗”时代的到来,ADC药物在HER2- mBC中的探索不断取得突破,改写了乳腺癌的诊疗格局。其中,SG表现尤为突出,是目前在HR+/HER2-mBC中唯一达到OS终点的Trop-2 ADC。此外,SG也是目前唯一在HER2- mBC中,无论HR+/HR-独立人群还是全人群,均显示出统计学意义上OS改善的ADC。新型ADC药物不仅显著延长了患者的生命,还大幅提升了患者的生活质量。展望未来,我们期待更多创新药物和治疗方案不断涌现,为乳腺癌患者带来更多福音。
1. Rugo HS, et al. Lancet. 2023 Oct 21;402(10411):1423-1433.
2. Rugo HS, et al. J Clin Oncol. 2022 Oct 10;40(29):3365-3376.
3. Xu B, et al. Nat Med. 2024 Dec;30(12):3709-3716.
4. Bardia A, et al. 2024ASCO. Poster1071.
5. Ouyang Q, et al. 2023ESMO. 380MO.
6. 注射用芦康沙妥珠单抗说明书(https://kelun-biotech.com/upload/2024-11-29/2991227641.pdf).
7. https://www.astrazeneca.com.cn/zh/about-us/astrazeneca-in-china.html.
8. S. Modi et al, et al. 2023 ESMO. 376O.
9. Bardia A, et al. N Engl J Med. 2024 Sep 15.
排版编辑:肿瘤资讯-CXY











 苏公网安备32059002004080号
苏公网安备32059002004080号


