2024年12月20日,美国国立综合癌症网络(NCCN)对 NSCLC 指南进行了更新,升级为 2025. V1 版本,本次为大版本更新,更新内容比较多,不想看详细版可以看总结版 。
总结版:
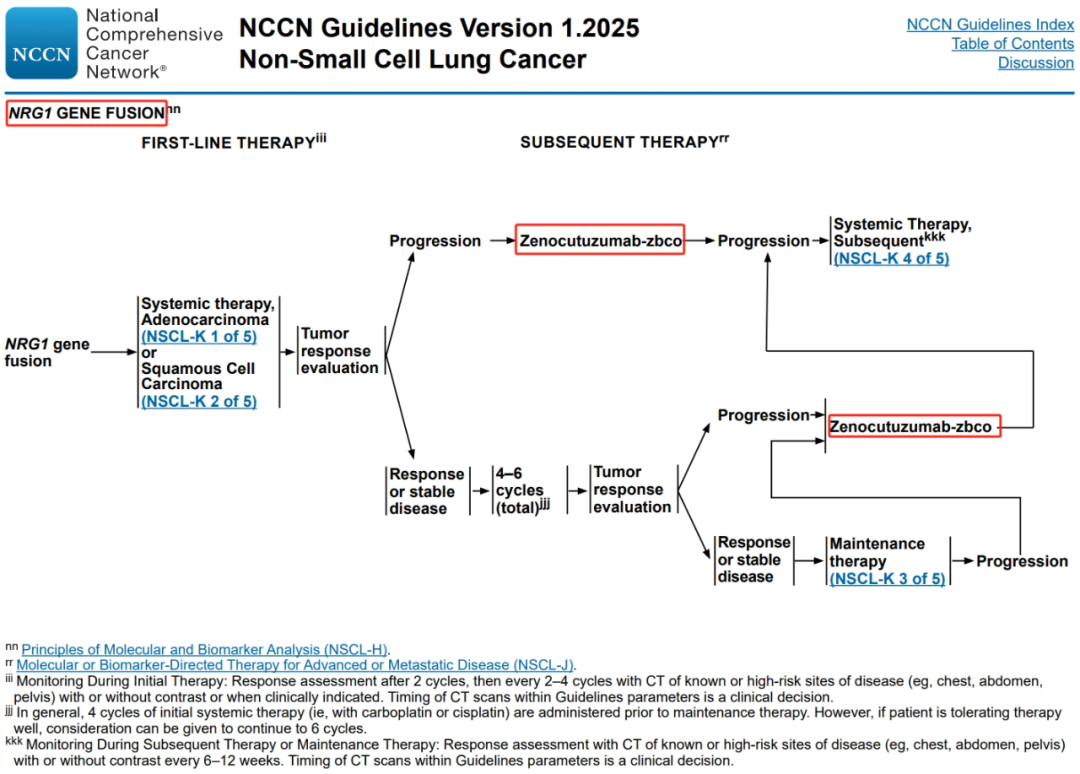
1. 新增靶点 : NRG1基因融合 和 FGFR变异 ,对应的靶向药物分别是 Zenocutuzumab-zbco和Erdafitinib。
2. 删除疗法 :ROS1重排一线治疗去除 塞瑞替尼 ;EGFR S768I, L861Q和/或G719X去除了 Amivantamab-vmjw+卡铂+培美曲塞(非鳞状细胞癌) 的后线疗法 。
3. EGFR exon19del或L858R突变、EGFR S768I, L861Q和/或G719X突变 、ALK重排、ROS1重排、NTRK1/2/3基因融合、MET ex14跳跃突变、RET重排,在一线系统 治疗中 发现这些靶点,则“ 中断当前的治疗,并开始相应的靶向治疗 ”。
4. 针对RET重排 : Cabozantinib 由之前的一线调整到普拉替尼或塞普替尼治疗进展的 后线 。
5. 针对MET高水平扩增 :对于NGS检测结果,拷贝数 ≥10 与高水平MET扩增相一致(注:之前版本是大于10)。
6. 度伐利尤单抗巩固治疗增加“ 无EGFR exon19del或L858R ”限定条件。
7. 与PD-1/PD-L1抑制剂的获益较小相关的致癌驱动变异增加了 RET和ROS1重排 ,措辞调整为“ 某些 致癌驱动变异”的靶向治疗优先于免疫检查点抑制剂治疗。

2025.V1版——非小细胞肺癌NCCN指南详细更新内容如下
IB期 (周围型T2aN0)、I期 (中心型T1abc-T2aN0)、II期 (T1abc-2abN1; T2bN0)、IIB期 (T3N0)、IIIA期(T3N1)患者治疗前评估增加了“ EGFR、ALK的分子检测;PD-L1检测” 。
肺上沟瘤(T4 invasion ,N0-1),不可切除-根治性同步放化疗,度伐利尤单抗增加限定说明“ 如果无EGFR 19外显子缺失或L858R ”。
IIIA期(T4, N0-1)不可切除,根治性同步放化疗后的度伐利尤单抗增加限定“ 如果无EGFR 19外显子缺失或L858R ”。
T1-3N1阳性M0和T1-3N2阳性M0中的根治性同步放化疗后的度伐利尤单抗增加限定“ 如果无EGFR 19外显子缺失或L858R ”。
IIIB期(T1-2N3),IIIC期(T3N3)治疗前评估中增加 EGFR 分子检测 。N3阳性-根治性同步放化疗,度伐利尤单抗增加限定“ 如果无EGFR 19外显子缺失或L858R ” 。
晚期或转移性疾病-腺癌/大细胞癌/非特指型NSCLC(NOS) 生物标记物检测增加NRG1和HER2(IHC) ,并且RET调整为1类推荐;鳞状细胞癌生物标记物检测 增加NRG1和HER2(IHC) ;
EGFR exon19del或L858R突变 :a) 在一线系统治疗中发现EGFR突变的一线治疗列: 1.去除“完成计划的系统性治疗,包括维持治疗”的描述,并将描述调整为“中断当前的治疗,并开始奥希替尼或Amivantamab-vmjw+lazertinib治疗”;2.增加“在培美曲塞+(顺铂或卡铂)(非鳞状细胞癌)的基础上加用奥希替尼”。b) 奥希替尼或Amivantamab-vmjw+lazertinib治疗进展-脑部有症状的后续治疗: 第一条的描述去除了有限的病灶,调整后描述为“考虑根治性局部治疗(如SRS)” 。并且其增加bbb脚注:“CNS疾病的根治性局部治疗时,确实会考虑包括无症状病变在内的治疗,基于部位、位置和水肿等因素这些病变有症状进展的风险”。 Amivantamab-vmjw(如果先前未使用)+卡铂+培美曲塞(非鳞状细胞癌)(1类)(首选) 增加ccc脚注:“ 对于EGFR S768I、L861Q和/或G719X突变,不属于可选方案 ”。
EGFR S768I, L861Q和/或G719X突变 :在一线系统治疗中发现EGFR突变的一线治疗列:去除“完成计划的系统性治疗,包括维持治疗”的描述,并将描述调整为“中断当前的治疗,并开始阿法替尼(首选)或奥希替尼(首选)或达可替尼或厄洛替尼或吉非替尼”。
EGFR exon20ins突变 :一线治疗的脚注iii调整为“初始治疗期间的监测:在2个周期后评估疗效,然后每2-4个周期进行已知或高危部位( 如胸部、腹部、盆腔 )CT检查(加或不加造影剂),或当有临床指征时进行检查。在指南参数范围内的CT检查时机是一个临床决策”。后续系统治疗的脚注kkk调整为“后续治疗或维持治疗期间的监测:每6-12周对已知或高危疾病部位( 如胸部、腹部、盆腔 )进行CT检查(加或不加造影剂)评估疗效。在指南参数范围内的CT检查时机是一个临床决策”。(红色为新增)
KRAS G12C突变 :经过 Sotorasib或 Adagrasib治疗进展后不根据PS评分状态进行分层,直接指向后续治疗(NSCL-K 4/5)。
ALK重排 : a)在一线系统治疗前发现ALK重排 , 塞瑞替尼 从其他推荐调整到某些条件下使用; b)在一线系统治疗中发现ALK重排 ,去除“完成计划的系统性治疗,包括维持治疗”的描述,并将描述调整为“中断当前的治疗,并开始阿来替尼(首选)或布格替尼(首选)或洛拉替尼(首选)或塞瑞替尼或克唑替尼”。
ROS1重排 : a)在一线系统治疗前发现ROS1重排 , 去除塞瑞替尼 ; b)在一线系统治疗中发现ROS1重排 , 去除塞瑞替尼 ,去除“完成计划的系统性治疗,包括维持治疗”的描述,并将描述调整为“中断当前的治疗,并开始克唑替尼(首选)或恩曲替尼(首选)或瑞普替尼(首选)”。 c)恩曲替尼、克唑替尼、瑞普替尼或塞瑞替尼的进展-脑部有症状的后续治疗 :第二条调整为“瑞普替尼或洛拉替尼(首选)或恩曲替尼(在某些情况下有用,如果之前接受过克唑替尼治疗)或临床试验”(注:因为一线去除了塞瑞替尼,所以恩曲替尼的限定中去除了塞瑞替尼;同时也增加了临床试验)。瑞普替尼增加脚注ppp:“ 瑞普替尼是ROS1 G2032R等耐药突变的可选治疗方案 ”。
BRAF V600E突变 :在一线系统治疗中发现BRAF V600E突变,一线治疗列的描述调整为“完成计划的系统性治疗,包括维持治疗,或中断当前治疗并开始达拉非尼+曲美替尼(首选)或Encorafenib+binimetinib(首选)”。
NTRK1/2/3基因融合 :在一线系统治疗中发现NTRK1/2/3基因融合的一线治疗列:去除“完成计划的系统性治疗,包括维持治疗”的描述,并将描述调整为“中断当前的治疗,并开始恩曲替尼或拉罗替尼或瑞普替尼”。 MET ex14跳跃突变 :在一线系统治疗中发现MET ex14跳跃突变,一线治疗列:去除“完成计划的系统性治疗,包括维持治疗”的描述,并将描述调整为“中断当前的治疗,并开始卡马替尼(首选)或特泊替尼(首选)或克唑替尼”。 RET重排 : a)在一线系统治疗前发现RET重排 ,一线治疗列:塞普替尼推荐等级由2A类调整为1类; Cabozantinib 去除 ;系统治疗(NSCL-K)去除。 b)在一线系统治疗中发现RET重排 ,一线治疗列: Cabozantinib 去除 ,去除“完成计划的系统性治疗,包括维持治疗”的描述,并将描述调整为“中断当前的治疗,并开始普拉替尼(首选)或塞普替尼(首选)”。 c)后续治疗列 : 普拉替尼或塞普替尼治疗 进展后增加Cabozantinib ,Cabozantinib治疗进展后添加系统治疗(NSCL-K)。 ERBB2(HER2)突变 :ERBB2(HER2)突变增加脚注rrr: 关于 HER2蛋白过表达(IHC3+) 的治疗方案,参见NSCL-K 4/5。 NRG1基因融合 : 增加 治疗页面 ,后续治疗中包含 Zenocutuzumab-zbco 。 PD-L1 :去除了体能状态(PS)分层,PD-L1阳性的脚注ttt调整为“PD-1/PD-L1抑制剂治疗的禁忌证可能包括活动性或既往记录的自身免疫病和/或目前使用的免疫抑制剂;一些致癌驱动基因(如EGFR exon19del或L858R;ALK、 RET或ROS1重排 )已被证明与PD-1/PD-L1抑制剂的获益较小相关” (注:增加了RET和ROS1重排)。 围手术期系统治疗板块 : a)新辅助系统治疗 :第一条描述调整为“对于肿瘤≥4 cm或淋巴结阳性的患者,应评估其术前治疗,并强烈考虑免疫检查点抑制剂+化疗”(对人群更优针对性); b)辅助化疗 :1.第一条调整为“对于IB期和IIA期(T2bN0)和切缘阴性的高危患者,建议行辅助化疗 ” (注:增加了IB期)。2.第二条调整为“IIB期(T1abc-T2aN1)、IIB期(T3N0;T2bN1期)、IIIA期(T1-2N2;T3N1;T4N0-1)、IIIB期(T3-4N2)和切缘阴性(R0),辅助化疗作为1类推荐 ” (注:T4N0-1添加到IIIA期,T4N2添加到IIIB期)。3.增加第三条:以下列出的所有化疗方案均可用于序贯化疗/放疗。4.第四条调整为“检测PD-L1状态、EGFR突变和ALK重排(IB-IIIA,IIIB期[T3-4N2]) ” (注:增加了IB期和T4N2)。 c)手术切除后的系统治疗 :1.第一条调整为“检测PD-L1状态、EGFR突变和ALK重排(IB-IIIA,IIIB期[T3-4N2]) ” (注:增加了T4N2)。2.增加第二条:对于完全切除的肿瘤≥4cm或淋巴结阳性的NSCLC患者应评估其他系统性治疗。3.阿来替尼、奥希替尼、阿替利珠单抗、帕博利珠单抗、度伐利尤单抗和纳武利尤单抗中去除了肿瘤分期、肿瘤大小和淋巴结的描述,奥希替尼、阿替利珠单抗和帕博利珠单抗等级调整为1类推荐。 同步放化疗方案板块 :对接受根治性同步放化疗后PS 0-1且无疾病进展的不可切除的II/III期NSCLC患者进行巩固治疗:度伐利尤单抗增加了“ 除了EGFR exon19del或L858R突变阳性的肿瘤 ”限定。 分子和生物标志物分析原则板块 :a)NSCLC的分子诊断研究中增加一条“ 不应根据临床病理特征选择接受检测的患者 ”。b)NSCLC的分子诊断研究的检测方法学中 去除了Sanger测序的引用 。c)分子靶点的分析-EGFR基因突变:第二条调整为“对于 IB-IIIC 期的NSCLC,考虑TKI治疗时应进行EGFR突变的分子检测。虽然对切除标本的检测过程在技术上可能更容易,但初始诊断性活检标本也可用于这一适应症的检测”。d)分子靶点的分析-ALK基因重排:增加“ 对于IB-IIIB期的NSCLC患者,当考虑TKI治疗时,应进行ALK重排的分子检测。虽然对切除标本的检测过程在技术上可能更容易,但初始诊断性活检标本也可用于这一适应症的检测 ”描述。e)分子靶点的分析-HER2蛋白过表达(新增):HER2过表达定义为肿瘤细胞染色3+(根据IHC)。目前,对于非小细胞肺癌(NSCLC)中HER2染色的特定IHC抗体克隆,没有特别的推荐。抗HER2单克隆抗体/抗体-药物偶联物(ADC)治疗的评分标准是基于最初应用于 胃癌的标准 ,其使用的评分标准与用于乳腺癌的评分标准不同,对于小活检标本和切除标本,使用的评分标准也不同。f)分子靶点的分析-PD-L1:第二条部分内容调整,调整为“虽然PD-L1表达在有致癌驱动基因的患者中可能升高,但针对 某些致癌驱动变异 的靶向治疗应优先于免疫检查点抑制剂治疗”(注:致癌驱动前增加限定—“某些 ” ,更严谨了!)。g)分子靶点的分析-生殖系检测(新增):如果怀疑体细胞检测发现生殖系变异,则考虑转诊至遗传咨询。 识别转移性NSCLC患者新疗法的新型生物标志物板块 :表格 增加了FGFR变异 ,对应的药物是 Erdafitinib ,对应的增加脚注c:“关于致癌或可能致癌的FGFR突变,请参见oncokb.org上的定义 ” 。MET高水平扩增的脚注a调整:“对于NGS检测结果, 拷贝数≥10 与高水平MET扩增相一致 ” (注:之前是大于10)。 晚期或转移性疾病的分子和生物标志物靶向疗法板块 :EGFR S768I, L861Q和/或G719X 去除了Amivantamab-vmjw+卡铂+培美曲塞(非鳞状细胞癌)的后线疗法 。NRG1基因融合 增加Zenocutuzumab-zbco作为后续治疗 。HER2阳性(IHC 3+) 增加德曲妥珠单抗作为后续治疗 。 晚期或转移性疾病的系统性治疗板块 :将体能状态评分(PS)为2的治疗建议集成到PS 0-1的某些条件下使用中,列标题修改:•无PD-1或PD-L1抑制剂禁忌证, 无EGFR exon19del或L858R;ALK、RET或ROS1重排 ;•PD-1或PD-L1抑制剂禁忌证 或EGFR exon19del或L858R;ALK、RET或ROS1重排 。在某些条件下使用:吉西他滨/多西他赛和吉西他滨/长春瑞滨1类推荐调整为2A类。晚期或转移性疾病的系统性治疗-后续治疗:德曲妥珠单抗增加“HER2 IHC 3+”限定,并去除了之前“仅在肿瘤HER2过表达(IHC 3+)的患者中”的脚注。














▲图1: 2025.V1版NSCLC指南更新内容(部分截图)
参考资料 :
https://www.nccn.org/guidelines/guidelines-detail?category=1&id=1450











 苏公网安备32059002004080号
苏公网安备32059002004080号


