寒冬将至,天气渐寒,但血液病研究的热情却从未减退。这个月,又有一批重要的研究成果相继发布,为临床诊疗提供了新的思路和可能。让我们继续关注血液肿瘤领域各大顶级期刊的重点研究,共同探讨最新进展!
BLOOD
Daratumumab in Pediatric Relapsed/Refractory Acute Lymphoblastic Leukemia or Lymphoblastic Lymphoma:DELPHINUS Study
达雷妥尤单抗用于治疗复发/难治性儿童急性淋巴细胞白血病或淋巴母细胞淋巴瘤:DELPHINUS研究
既往研究表明,CD38在T-ALL幼稚细胞上高表达,而在B-ALL幼稚细胞上表达相对较低。近期,Teena Bhatla教授等开展了一项II期、多中心、开放标签临床试验,旨在评估抗CD38单抗达雷妥尤单抗联合化疗方案在治疗复发/难治性(R/R)儿童急性淋巴细胞白血病(ALL)/淋巴母细胞淋巴瘤(LL)患者中的疗效和安全性。该研究共纳入了7例≥2次复发的B-ALL患者、24例儿童T-ALL患者、5例成年T-ALL患者和10例T-LL患者。主要研究终点是B-ALL患者在2个疗程内和T-ALL患者在1个疗程结束时的完全缓解(CR)率。
研究结果显示:①在7例高危B-ALL患者中,未观察到CR,该队列因无效而关闭。②在儿童T-ALL、成年T-ALL和T-LL队列中,第1个疗程结束时的CR率分别为41.7%、60.0%和30.0%;总缓解率(ORR;任何时间点)分别为83.3%(CR+CRi)、80.0%(CR+CRi)和50.0%(CR+部分缓解);微小残留病灶(MRD)阴性率(<0.01%)分别为45.8%、20.0%和50.0%;24个月无事件生存(EFS)率分别为36.1%、20.0%和20.0%;24个月总生存(OS)率分别为41.3%、25.0%和20.0%;接受异基因造血干细胞移植的患者比例分别为75.0%、60.0%和30.0%。③安全性方面,未观察到新的不良反应。
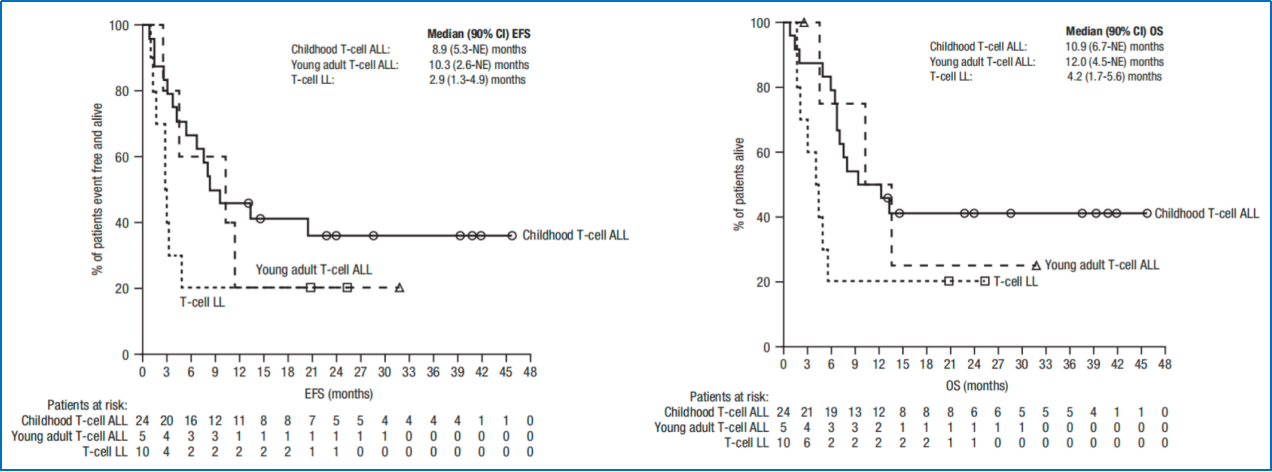
该研究表明,达雷妥尤单抗联合标准化疗在治疗复发/难治性儿童和年轻成人T-ALL/LL中是安全的,并且可帮助大多数患者成功桥接至异基因造血干细胞移植。
Efficacy and safety of teclistamab in patients with relapsed/refractory multiple myeloma after BCMA-targeting therapies
teclistamab在既往接受过BCMA靶向治疗的复发/难治性多发性骨髓瘤患者中的疗效和安全性研究
MajesTEC-1研究的C队列纳入了40例既往接受过BCMA靶向治疗的复发/难治性多发性骨髓瘤(RRMM)患者,评估了teclistamab(BCMA×CD3双特异性抗体)治疗的疗效和安全性。中位随访28.0个月后,主要结果显示:①ORR为52.5%(95%CI:36.1-68.5),≥VGPR率为47.5%(95%CI:31.5-63.9),≥CR率为30.0%(95%CI:16.6-46.5);②接受过ADC治疗和CAR-T细胞治疗的患者中,ORR分别为55.2%和53.3%,疗效相当。③中位无进展生存期(PFS)为4.5个月,中位OS为15.5个月。④在安全性方面,最常见的治疗相关不良事件为中性粒细胞减少(70.0%)、贫血(50.0%)、淋巴细胞减少(45.0%)和血小板减少(45.0%)。细胞因子释放综合征发生率为65.0%,均为1-2级。
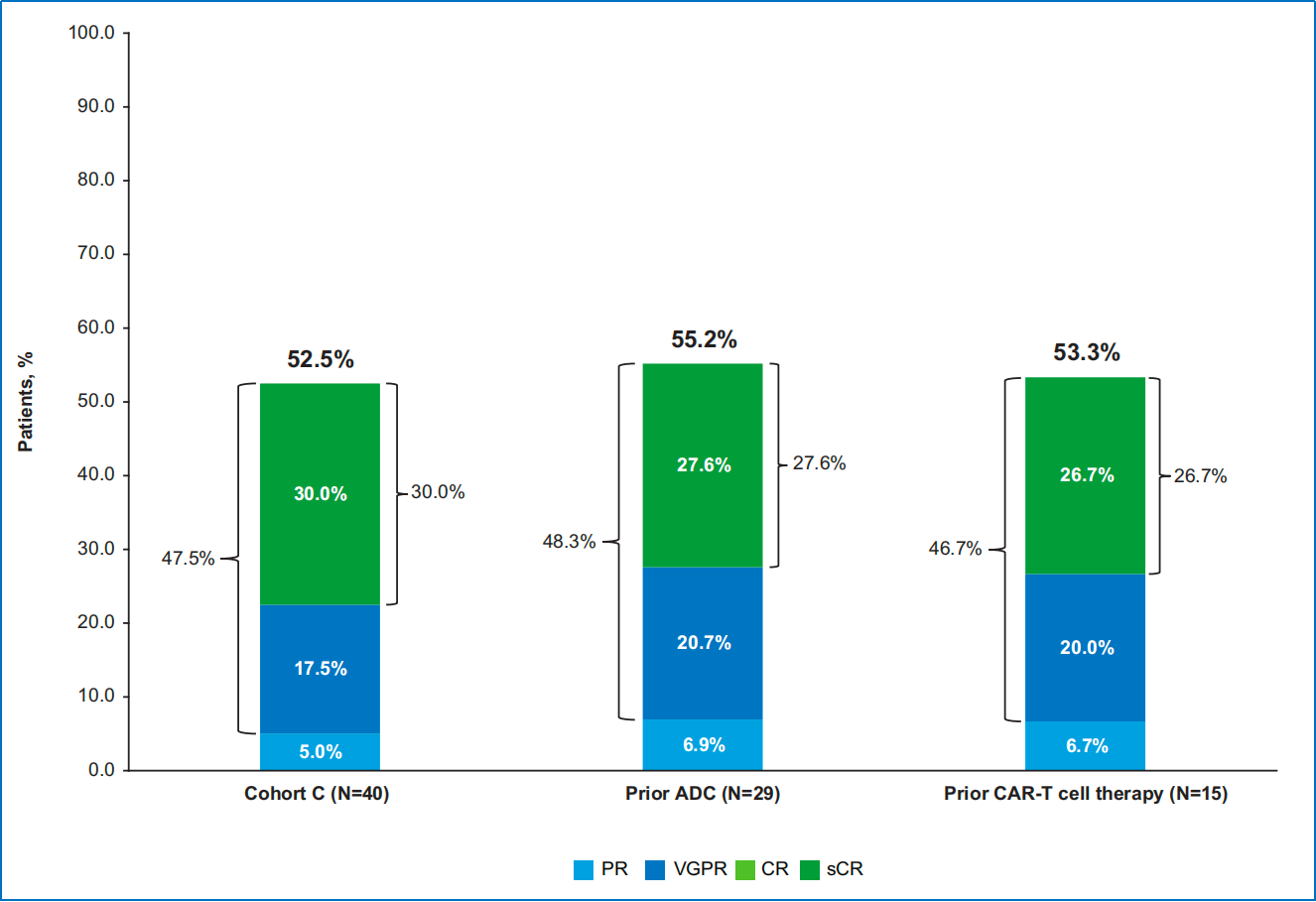
该研究的结果表明,对于包括既往接受过BCMA靶向治疗的RRMM患者而言,teclistamab具有较好的疗效和可控的安全性。
HAEMATOLOGICA
LILRB4 represents a promising target for immunotherapy by dual targeting tumor cells and myeloid-derived suppressive cells in multiple myeloma
LILRB4在多发性骨髓瘤中通过双重靶向肿瘤细胞和骨髓源性抑制细胞成为一个有前景的免疫治疗靶点
尽管目前,MM治疗取得了巨大进展,但约10%的患者预后仍然很差,中位OS不足24个月。本研究通过单细胞转录组测序深入分析了患者的骨髓微环境特征,发现在生存期少于2年的患者(EM24)中富集了一个LILRB4高表达的浆细胞亚群。这个亚群表现出侵袭性增殖和耐药表型。研究结果显示:①高水平的LILRB4促进了MM克隆形成和疾病进展;②临床上,LILRB4的高表达与初诊和复发难治性MM患者的不良预后相关;③ATAC-测序分析发现,染色质可及性的显著增加导致MM细胞中LILRB4的升高;④通过CRISPR-Cas9敲除LILRB4可以减轻MM细胞的生长,抑制骨髓源性抑制细胞(MDSC)的免疫抑制功能,并进一步改善MM微环境中的T细胞功能障碍;⑤在EM24患者中观察到更多的MDSC浸润。基于此,研究者开发了一种创新的基于T细胞受体的嵌合抗原受体T细胞,即LILRB4-STAR-T。细胞毒性实验证明LILRB4-STAR-T细胞可以有效清除肿瘤细胞并阻碍MDSC功能。
该研究阐明了LILRB4是高危MM的理想生物标志物和有前景的免疫治疗靶点,针对LILRB4的STAR-T细胞免疫治疗通过同时靶向肿瘤细胞和免疫抑制性肿瘤微环境展现出良好的应用前景。
LEUKEMIA
Venetoclax in combination with hypomethylating agents in chronic myelomonocytic leukemia:a propensity score matched multicenter cohort study
维奈克拉联合去甲基化药物治疗慢性粒单核细胞白血病:一项倾向评分匹配的多中心队列研究
慢性粒单核细胞白血病(CMML)是一种罕见的血液恶性肿瘤,具有骨髓增生异常综合征(MDS)和骨髓增殖性肿瘤的特征,以外周血单核细胞增多为特征。近期,一项多中心回顾性队列研究纳入了89例初治的CMML和CMML-BT(转化为急性白血病)患者,旨在比较维奈克拉联合去甲基化药物(HMA+VEN)与去甲基化药物(HMA)单药治疗的疗效差异。主要研究终点是OS。
结果显示:①在CMML患者中,HMA+VEN组的ORR显著优于单药HMA组(91% vs. 39%,P<0.001);②在CMML-BT患者中,HMA+VEN组的ORR同样显著优于单药HMA组(94% vs. 47%,P<0.001);③在CMML患者中,HMA+VEN组的中位OS为25.1个月,与单药HMA组(19.1个月)相比无显著差异(P=0.85),但无白血病生存期得到显著改善(13.0个月 vs. 5.3个月,P=0.03);④在CMML-BT患者中,两组的中位OS分别为7.5个月和9.7个月(P=0.98);⑤值得注意的是,HMA+VEN方案促进了更多患者进行造血干细胞移植(34% vs. 12%,P=0.018)。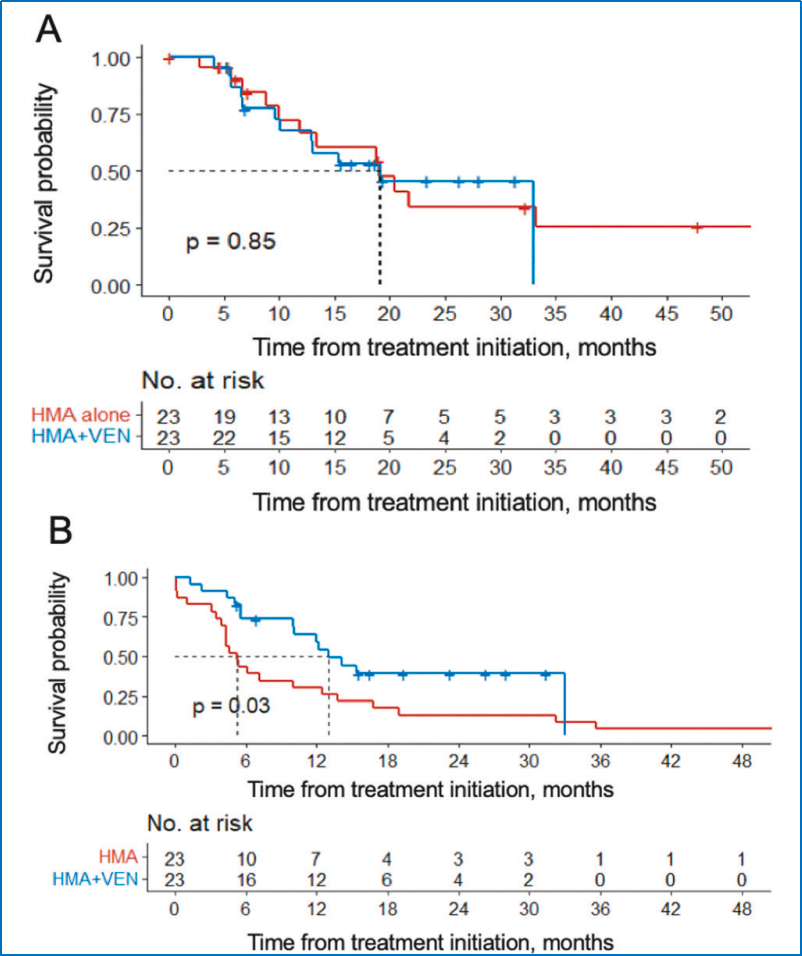
总体而已,虽然HMA+VEN方案改善了CMML和CMML-BT患者的缓解率,但并未延长OS。然而,该方案可能有助于高危患者成功桥接至造血干细胞移植。
THE LANCET HAEMATOLOGY
Decitabine,venetoclax,and ponatinib for advanced phase chronic myeloid leukaemia and Philadelphia chromosome-positive acute myeloid leukaemia:a single-arm,single-centre phase 2 trial
地西他滨、维奈托克和泊那替尼治疗进展期慢性髓系白血病和费城染色体阳性急性髓系白血病:单臂、单中心2期试验研究
进展期慢性髓系白血病(CML)患者预后较差。为此,Nicholas J Short教授等开展了一项单臂、单中心2期试验研究,纳入了20例≥18岁的进展期CML或Ph+ AML患者,评估了地西他滨、维奈托克和泊那替尼三药联合治疗的疗效和安全性。
中位随访21.2个月结果显示:①CR或血细胞不完全恢复的完全缓解(CRi)率为50%,包括1例(5%)CR和9例(45%)CRi。额外6例(30%)患者达到骨髓无白血病状态,总骨髓缓解率达到80%。②在安全性方面,最常见的不良反应为恶心/呕吐(75%)、皮疹(75%)、便秘(65%)和转氨酶升高(60%)。感染发生率为50%,其中9例为3-5级。8例(40%)患者发生至少1次心血管事件,但仅2例为3级或以上。三药联合治疗患者并未观察到协同性非血液学毒性。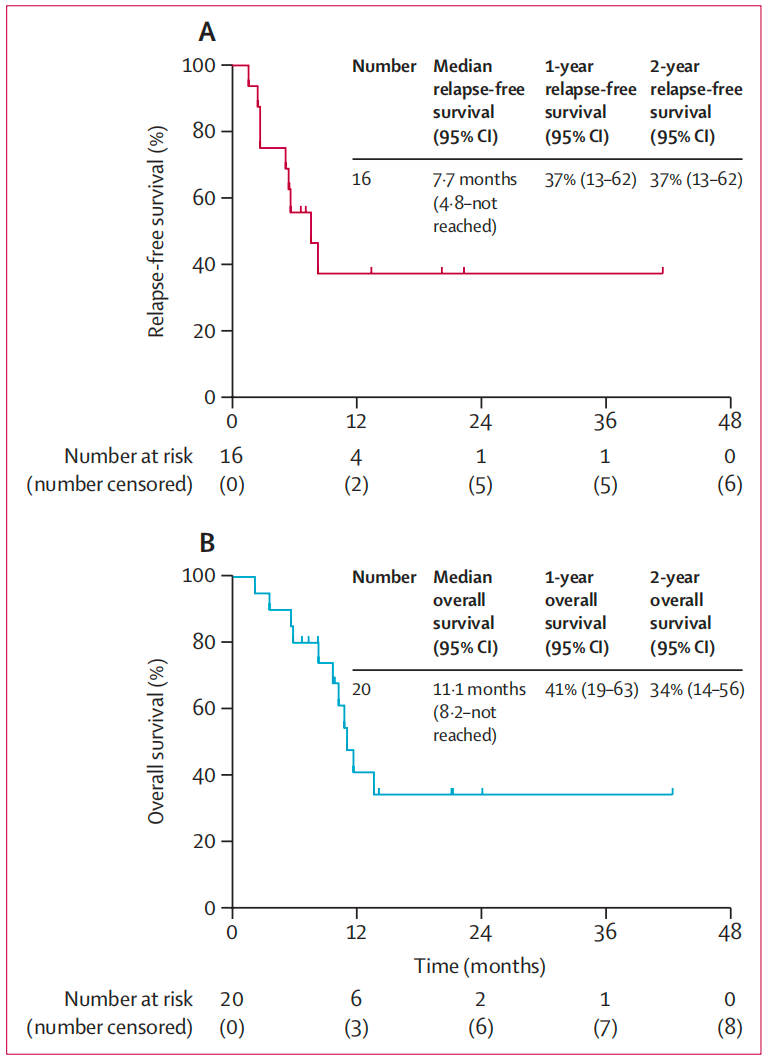
总之,该研究表明,对于进展期CML或Ph+ AML患者而言,地西他滨、维奈托克和泊那替尼三药联合治疗具有较好的疗效和可接受的安全性。
[1] Bhatla T, Hogan LE, Teachey DT, et al. Daratumumab in pediatric relapsed/refractory acute lymphoblastic leukemia or lymphoblastic lymphoma: the DELPHINUS study. Blood. 2024;144(21):2237-2247. doi:10.1182/blood.2024024493
[2] Touzeau C, Krishnan AY, Moreau P, et al. Efficacy and safety of teclistamab in patients with relapsed/refractory multiple myeloma after BCMA-targeting therapies. Blood. 2024;144(23):2375-2388. doi:10.1182/blood.2023023616
[3] Gong L, Sun H, Liu L, et al. LILRB4 represents a promising target for immunotherapy by dual targeting tumor cells and myeloid-derived suppressive cells in multiple myeloma. Haematologica. 2024;109(11):3650-3669. Published 2024 Nov 1. doi:10.3324/haematol.2024.285099
[4] Tremblay D, Csizmar C, DiNardo CD, et al. Venetoclax in combination with hypomethylating agents in chronic myelomonocytic leukemia: a propensity score matched multicenter cohort study. Leukemia. Published online November 12, 2024. doi:10.1038/s41375-024-02466-6
Short NJ, Nguyen D, Jabbour E, et al. Decitabine, venetoclax, and ponatinib for advanced phase chronic myeloid leukaemia and Philadelphia chromosome-positive acute myeloid leukaemia: a single-arm, single-centre phase 2 trial. Lancet Haematol. 2024;11(11):e839-e849. doi:10.1016/S2352-3026(24)00250
排版编辑:Mathilda











 苏公网安备32059002004080号
苏公网安备32059002004080号


