EGFR-TKI已经成为EGFR突变晚期非小细胞肺癌(NSCLC)一线标准治疗用药,为患者带来了显著的无进展生存期(PFS)和总生存期(OS)获益。然而,靶向治疗的耐药问题无法避免,EGFR-TKI耐药后,如何进一步延长患者生存,成为临床医生关注的难题。近年来,各类联合治疗方案层出不穷,以期针对不同耐药机制,探索出不同的后线治疗模式。【肿瘤资讯】特邀中山大学肿瘤防治中心方文峰教授回顾不同治疗模式在EGFR-TKI耐药NSCLC患者中的治疗进展。
“国家高层次人才项目青年人才”
“广东省特支计划百千万工程青年拔尖人才”
“广东省杰出青年医学人才”
“广州市珠江科技新星”
CSCO非小细胞肺癌专业委员会委员
CSCO鼻咽癌专业委员会委员
中国抗癌协会肺癌专业委员会委员
广东省抗癌协会鼻咽癌专业青年委员会副主任委员
广东省医学会精准医学与分子诊断专业委员会副主任委员
广东省临床医学会真实世界临床研究专业委员会副主任委员
研究方向:肺癌及鼻咽癌的靶向治疗及免疫治疗的临床及转化研究
主要课题:主持国家重大研发计划(子课题)、国自然(6项)
代表论著:JAMA、Cancer Cell、JCO、Lancet Oncology(2篇,2021,2018)、STTT、 Molecular Cancer、 Nature Communications、J Thorac Oncol、Clinical Cancer Research、JITC等
EGFR是我国NSCLC最常见驱动基因,TKI耐药患者亟需有效后线治疗方案
EGFR是我国NSCLC患者中最常见的一类驱动基因,其占比可达50.3%,在不吸烟的腺癌患者中占比更高,可以达到74.5%,是NSCLC的临床实践中最值得关注的驱动基因[1]。目前,EGFR-TKI已经成为EGFR突变晚期NSCLC患者的一线标准治疗方案,并为患者带来了显著的生存获益,然而EGFR-TKI的获得性耐药却成为限制患者获得更多获益的阻碍。EGFR-TKI的耐药机制可能包括EGFR通路相关突变、组织学转化、MET扩增、细胞周期基因扩增等其他旁路信号通路相关变异,机制复杂,往往需要采取针对性和精准化的治疗策略[2,3]。
在《CSCO非小细胞肺癌诊疗指南(2024版)》中[4],针对第三代EGFR-TKI或第一/第二代EGFR-TKI耐药(T790M阴性)的患者,标准治疗方案为含铂化疗±抗血管生成药物,但此方案的治疗获益非常有限。在一项纳入209例EGFR-TKI耐药的EGFR突变晚期NSCLC患者的回顾性研究中[5],患者接受二线化疗的中位PFS仅2.6-4.6个月;另一项纳入144例EGFR-TKI耐药的EGFR突变晚期NSCLC患者的真实世界研究中[6],患者接受化疗+抗血管生成药物治疗的中位PFS也仅7个月。总体而言,临床亟需探索针对EGFR-TKI耐药患者的有效后线治疗策略,为这部分患者带来更好的生存结局。
免疫治疗为EGFR-TKI耐药患者带来新希望,免疫联合方案已成功获批
免疫治疗正在成为EGFR-TKI耐药后NSCLC患者的后线治疗新方向,特别是对于耐药机制未知的患者。对于初治EGFR突变患者,由于其Treg浸润增加、CD8+T细胞数量减少和TMB降低,使得一线免疫治疗不但难以取得超越靶向治疗的疗效,反而增加毒性。然而EGFR-TKI的治疗,可通过增加CD8+T细胞浸润和MHC I/II的表达,减少Treg数量和活性,重塑肿瘤微环境(TME),为后线免疫治疗的应用提供了可能。此前,《驱动基因阳性晚期非小细胞肺癌免疫治疗专家共识(2023版)》中指出:对于EGFR-TKIs耐药后发生广泛进展的患者,且在缺乏有效靶向治疗或传统治疗疗效不佳的情况下,推荐使用以ICIs为基础的治疗策略[7]。
目前,多项研究探索了免疫联合方案在EGFR-TKI经治患者中的应用。随机、开放标签的III期IMpower150研究纳入部分EGFR-TKI经治患者[8],结果显示,阿替利珠单抗+卡铂+紫杉醇+贝伐珠单抗(ABCP)方案用于EGFR-TKI耐药后NSCLC患者的中位OS可达到27.8个月,对比卡铂+紫杉醇+贝伐珠单抗(BCP)显示出OS的获益趋势;随机、开放标签、多中心的III期ATTLAS研究也显示[9],针对EGFR-TKI耐药患者,ABCP方案对比单纯化疗可显著改善中位PFS(8.7个月vs. 5.6个月,HR=0.60;P=0.002);在中国开展的双盲、随机、安慰剂对照III期ORIENT-31研究显示[10],信迪利单抗+化疗+贝伐珠单抗治疗EGFR-TKI耐药NSCLC患者,中位PFS可达到7.2个月,对比化疗组PFS得到显著改善(HR=0.51;P<0.0001),OS也有获益的趋势,联合组≥3级TRAE的发生率为56%。基于ORIENT-31研究结果,2023年5月NMPA(国家药品监督管理局)批准信迪利单抗+贝伐珠单抗+化疗用于经EGFR-TKI治疗失败的EGFR基因突变阳性的局部晚期或转移性非鳞状NSCLC。
2024年ASCO大会中,安慰剂对照、随机双盲III期HARMONi-A研究引起业内专家高度关注[11],该研究评估了新型PD-1/VEGF双特异性抗体依沃西单抗联合化疗在EGFR-TKI耐药NSCLC患者中的应用。研究显示依沃西单抗+化疗对比化疗显著改善了中位PFS(7.1个月 vs. 4.8个月,HR=0.46,95%CI:0.34-0.62;P<0.001),OS也有获益的趋势,≥3级TRAE的发生率分别为54.0%和42.9%。2024年5月,NMPA正式批准依沃西单抗+培美曲塞+卡铂用于EGFR-TKI治疗后进展的EGFR突变阳性的局晚期或转移性NSCLC患者的治疗。
新型双特异性抗体PM8002/BNT327(PD-L1/VEGFA双抗)在刚结束的2024 ESMO大会上展示了其联合化疗用于EGFR耐药人群II期研究的初步数据[12],纳入分析的64例受试者中ORR为54.7%,DCR为92.9%,≥3级TRAE的发生率为54.7%。该研究的初步数据进一步证实了免疫+抗血管+化疗疗法在EGFR耐药人群治疗中的重要性。
艾托组合抗体展现优异疗效,安全可耐受,中位PFS可达8.5个月
基于MabPairTM平台诞生的全球首个PD-1&CTLA-4双功能免疫组合抗体——艾帕洛利托沃瑞利单抗(简称:艾托组合抗体;研发代号:QL-1706)同样在EGFR-TKI经治患者中显示了令人鼓舞的疗效。艾托组合抗体通过抗PD-1单抗和抗CTLA-4单抗的合理配比保证了有效的血药浓度,其中抗PD-1单抗选择lgG4亚型,使得不会因为ADCC效应损耗效应T细胞,而抗CTLA-4单抗选择IgG1亚型,通过ADCC效应杀伤调节性T细胞。在其I/Ib期研究中,对于免疫初治的NSCLC患者,ORR达到24.2%[13]。
中山大学肿瘤防治中心张力教授牵头开展了一项开放标签、多队列II期研究(DUBHE-L-201/QL1706-201)[14],从2021年6月11日至2021年12月29日期间总纳入91例患者,包括60例EGFR野生型NSCLC患者,31例EGFR-TKI耐药NSCLC患者。
在EGFR-TKI耐药人群的第5队列中,17例(54.8%)患者达到PR,ORR为54.8%(95% CI:36.0-72.7)。中位DOR为7.0个月(95% CI:4.2-NE),DCR为93.5%(95% CI:78.6-99.2),中位PFS达到8.5个月(95% CI:5.7, NE)。其中19例既往接受过第三代EGFR-TKI治疗的患者的ORR为52.6%。而在EGFR野生型患者的第1至第4队列中,27例(45%)患者实现了部分缓解(PR),ORR达到45%(95% CI:32.1-58.4)。中位PFS达到6.8个月(95% CI:5.2-9.7)。
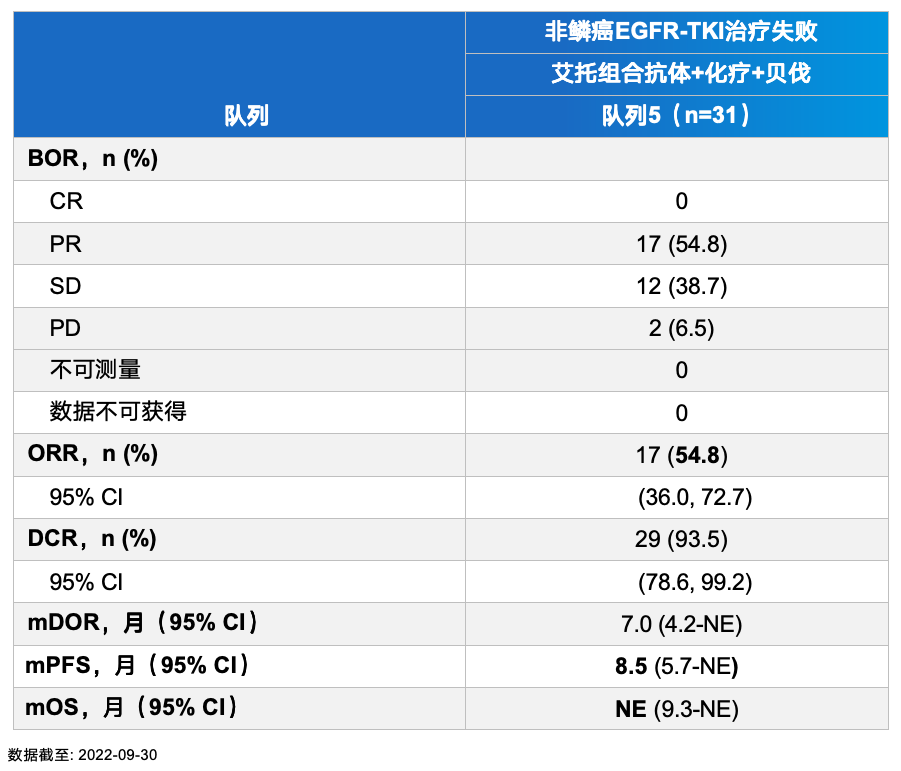
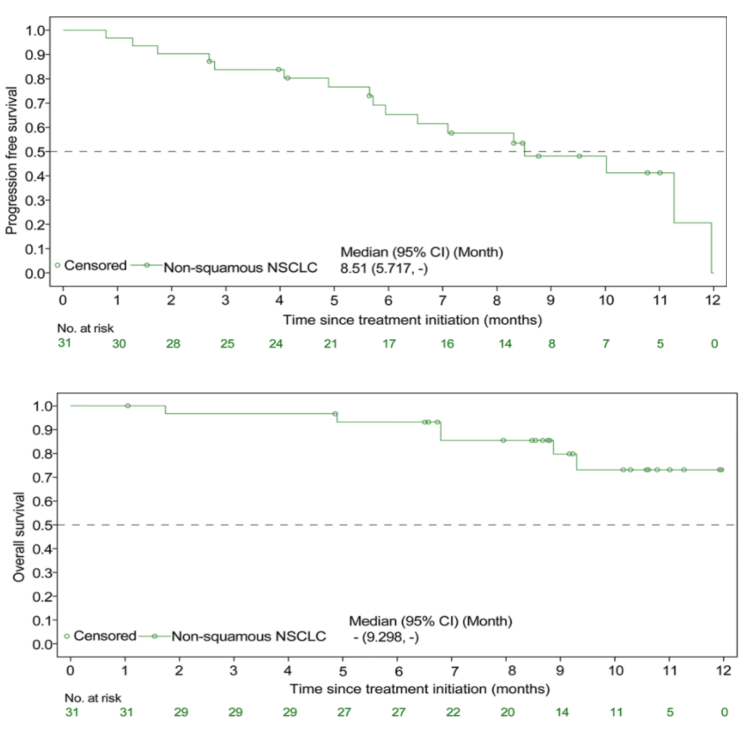 图1 艾托组合抗体在EGFR-TKI经治患者中的肿瘤缓解情况
图1 艾托组合抗体在EGFR-TKI经治患者中的肿瘤缓解情况研究显示艾托组合抗体 ≥3级TRAE的发生率为35.5%。该研究表明,艾托组合抗体不仅在EGFR-TKI经治NSCLC患者中初步显示出可观的疗效和较低的不良反应发生率,也在EGFR野生型患者一线治疗中显示出疗效潜力。
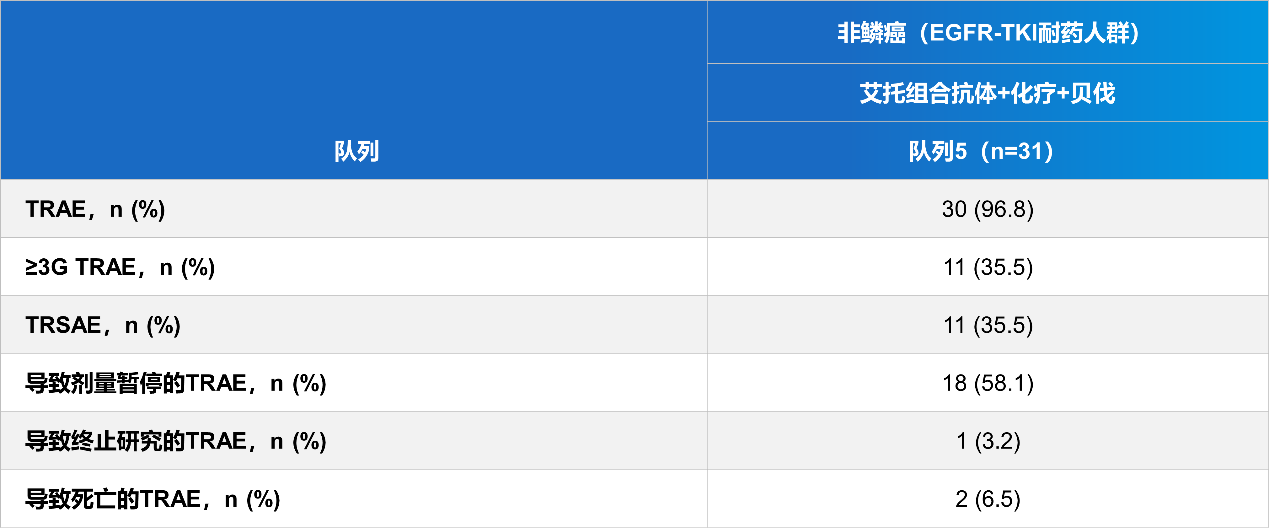
期待更多研究结果为丰富EGFR-TKI耐药患者的治疗选择提供依据
除免疫治疗外,其他治疗模式的探索也同样令人期待。例如MARIPOSA-2研究探索了Amivantamab+化疗±Lazertinib在奥希替尼耐药后患者中的疗效[15],其中Amivantamab+化疗+Lazertinib组的中位PFS达到8.3个月,对比化疗组显著改善(HR=0.44,P<0.001);抗体偶联药物(ADC)HER3-DXd在HERTHENA-Lung01研究中[16],针对EGFR-TKI耐药的NSCLC患者,也显示出具有临床意义的疗效,ORR达到了29.2%,中位PFS达到5.5个月;同样作为ADC的Dato-DXd在TROPION-Lung05研究中[17],针对靶向治疗、化疗耐药的EGFR突变NSCLC患者,ORR达到43.6%,中位PFS达到5.8个月;SAVANNAH研究显示赛沃替尼+奥希替尼的联合方案用于奥希替尼耐药的EGFR突变阳性、MET高水平扩增/过表达的NSCLC患者,ORR达到49%,中位PFS达到7.1个月[18]。
综合看来,EGFR/c-MET双抗、ADC、双靶联合等治疗模式的探索也令人期待,在EGFR-TKI耐药的NSCLC患者中显示出临床获益。期待未来更多临床研究的持续突破,不断丰富此类患者的治疗选择。
[1] Oncotarget. 2016 Jul 5;7(27):41691-41702
[2] Ramalingam S, Reungwetwattana T, Chewaskulyong B, et al. Annals of Oncology, 2017, 28: v635.
[3] Laface C, Maselli F M, Santoro A N, et al. Pharmaceutics, 2023, 15(6): 1604.
[4] CSCO非小细胞肺癌诊疗指南(2024版)
[5] Lin C Y, Hu C H, Hsu C F, et al.Thoracic Cancer, 2023, 14(19): 1857-1864.
[6] Yu X, Li J, Ye L, et al.Translational Lung Cancer Research, 2021, 10(9): 3782.
[7] 中国抗癌协会肿瘤精准治疗专业委员会,中华医学会杂志社肺癌研究协作组. 驱动基因阳性晚期非小细胞肺癌免疫治疗专家共识(2023版)[J]. 中华肿瘤杂志,2023,45(9):717-740.
[8] Nogami N, Barlesi F, Socinski M A, et al. Journal of Thoracic Oncology, 2022, 17(2): 309-323.
[9] Park S, Kim T M, Han J Y, et al.Journal of Clinical Oncology, 2024, 42(11): 1241-1251.
[10] Lu S, Wu L, Jian H, et al. The Lancet Respiratory Medicine, 2023, 11(7): 624-636.
[11] HARMONi-A Study Investigators.JAMA. Published online May 31, 2024.
[12] 2024 ESMO 1255MO
[13] Zhao Y, et al. J Hematol Oncol. 2023 May 8;16(1):50.
[14] Huang Y, et al. Signal Transduct Target Ther. 2024 Jan 29;9(1):23
[15] Passaro A, Wang J, Wang Y, et al. Annals of Oncology, 2024, 35(1): 77-90.
[16] Yu H A, Goto Y, Hayashi H, et al. Journal of Clinical Oncology, 2023, 41(35): 5363-5375.
[17] Paz-Ares L, Ahn M J, Lisberg A E, et al. Annals of Oncology, 2023, 34: S755-S756.
[18] Ann M J, et al. WCLC 2022. EP08.02-140.
排版编辑:肿瘤资讯-小编











 苏公网安备32059002004080号
苏公网安备32059002004080号


