转移性结直肠癌中BRAF突变约占8%~20%,其中V600E突变占90%以上。BRAFV600E突变的肿瘤生物学行为较差,携带此突变的患者预后不良,治疗策略始终是临床关注的焦点。本期【爱肠学院】特邀四川省肿瘤医院陈永昌教授,全面梳理BRAFV600E突变型转移性结直肠癌的治疗进展和研究方向。
专家介绍
四川省肿瘤医院
安德森肿瘤中心 博士共同培养
四川省肿瘤医院 肿瘤内科一期病房
四川省抗癌协会食管癌专委会 委员
四川省国际医促会消化道专业委员会 常委
四川省医学传播学会消化道肿瘤分会 委员
中国南方肿瘤临床研究协会(CSWOG)青委会 委员
四川省抗癌协会免疫治疗青委会 委员
靶向联合治疗打破传统治疗格局
MAPK信号通路在结直肠癌的发生和发展中扮演着关键角色,该通路的异常激活可以导致细胞增殖失控、凋亡受阻以及细胞周期调节失衡,从而促进肠癌的进展。因此,针对MAPK信号通路的靶向治疗成为肠癌治疗策略的重要组成部分。RAF蛋白位于MAPK信号通路下游,在RAS/RAF/MEK/ERK信号通路中传导细胞生长信号,参与调控细胞的生长、分化、凋亡等事件。BRAF突变共分为三类(图1),其中Ⅰ类突变为V600突变,预后最差;Ⅱ类突变预后次之;Ⅲ类突变预后最好,与BRAF野生型相似[1-3]。来自我们中心(四川省肿瘤医院)林桐榆教授牵头的一项多中心、回顾性研究同样得到相似的结论,研究共纳入2118例转移性结直肠癌(mCRC)患者,共473例患者存在BRAF突变,其中Ⅰ、Ⅱ、Ⅲ类突变患者的中位总生存(OS)分别为12.7、16.5和31.9个月(P=0.042)[4]。
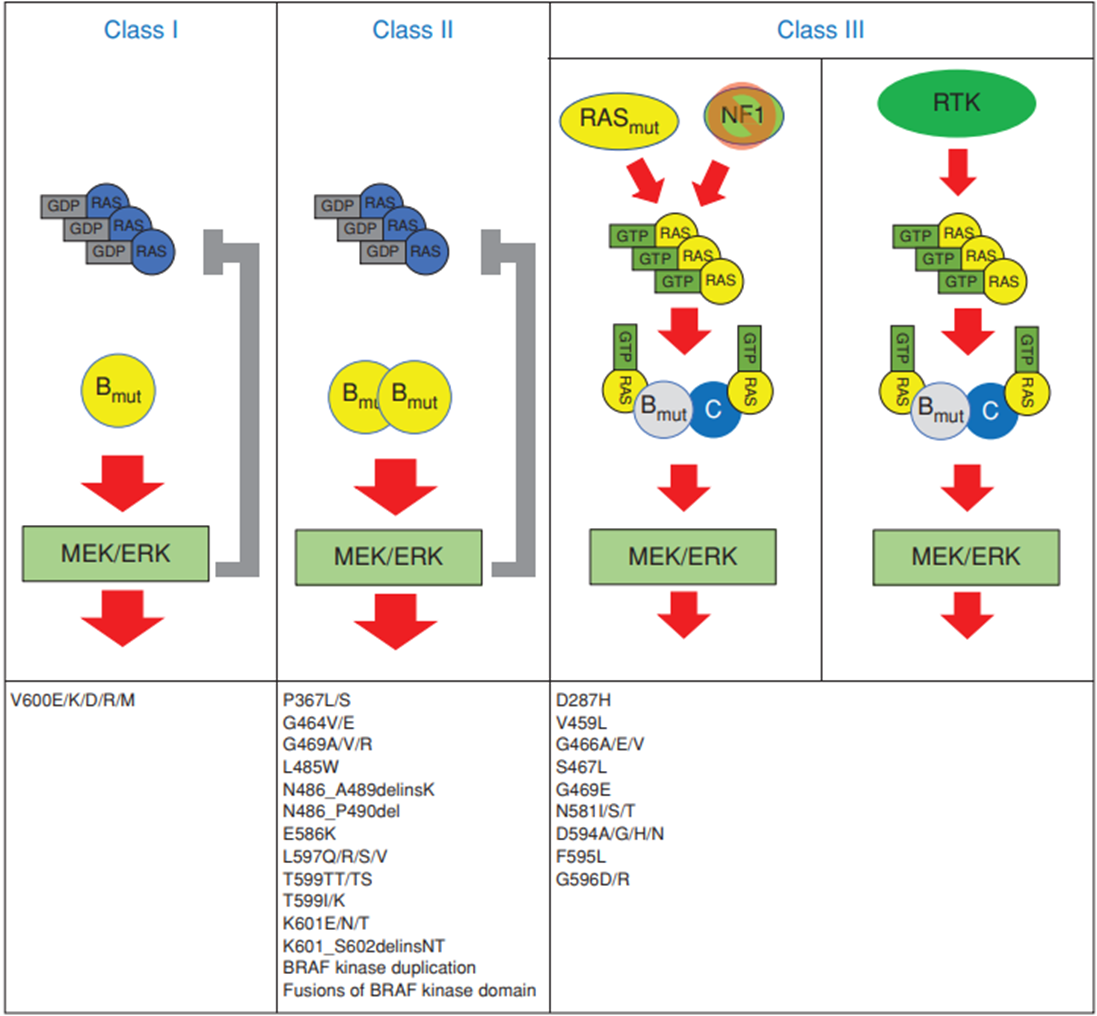
对于BRAFV600E突变型mCRC患者,指南推荐的标准一线治疗是化疗联合贝伐珠单抗,主要基于Ⅲ期TRIBE研究28例BRAFV600E突变亚组数据,FOLFOXIRI+贝伐珠单抗与FOLFIRI+贝伐珠单抗相比OS存在获益趋势(19.0个月 vs. 10.7个月)[5]。然而,后续的临床研究中并没有重复出类似的结果[6]。同样来自2020年在JCO发布的一项Meta分析显示,三药化疗+贝伐珠单抗对比两药化疗(FOLFOX或FOLFIRI)+贝伐珠单抗没能改善患者的OS[7]。随着精准治疗的推进,BRAF抑制剂在肠癌中的应用取得了一系列突破性进展[8,9]。目前,国内外各大权威指南一致推荐BRAF抑制剂联合抗EGFR单抗±MEK抑制剂的双靶或三靶方案用于二线和后线治疗[10-12]。
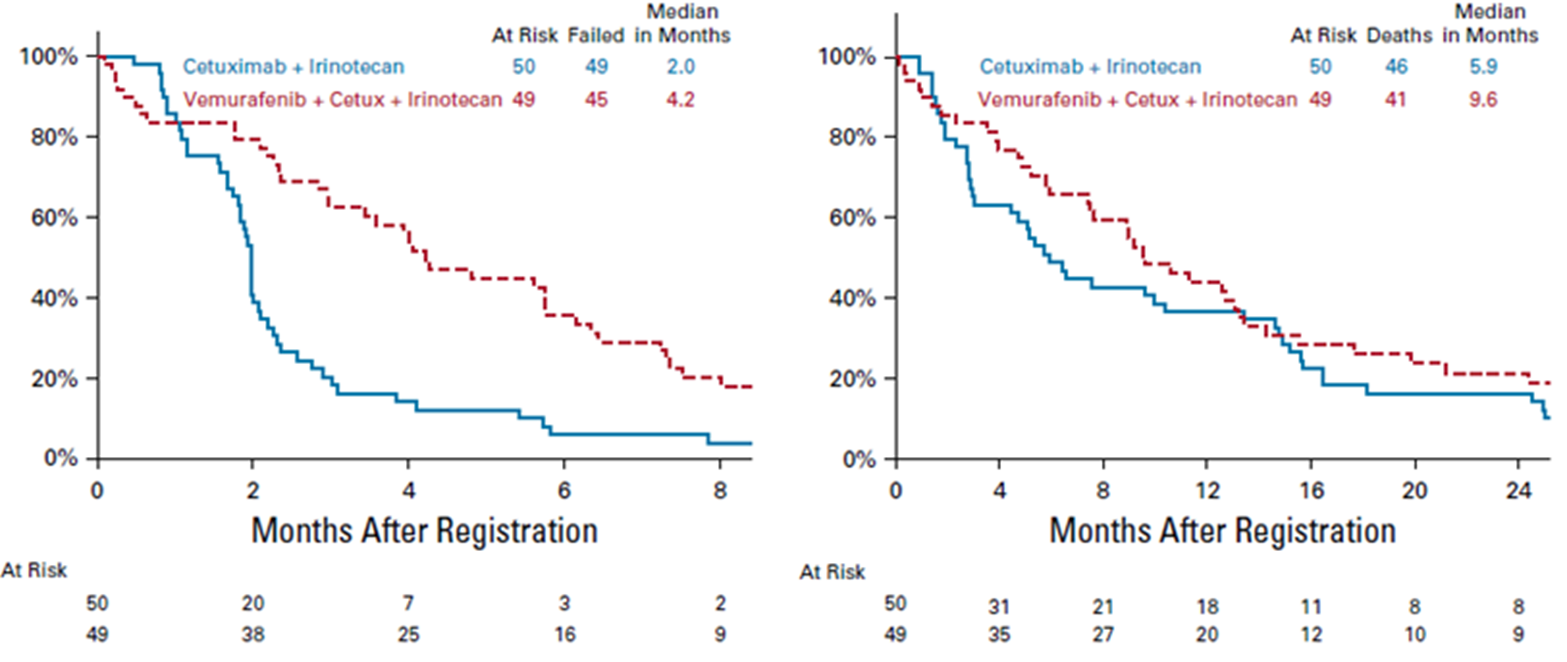
其中,最为人熟知的包括VIC方案和BEACON方案。VIC方案指的是维莫非尼(BRAF抑制剂)+伊立替康+西妥昔单抗,主要来自于随机、Ⅱ期SWOG S1406研究。其结果显示,对于既往经治的BRAFV600E突变mCRC患者,与西妥昔单抗+伊立替康相比,维莫非尼+西妥昔单抗+伊立替康的无进展生存(PFS)显著获益(4.2个月 vs. 2.0个月,HR 0.5,P=0.001),客观缓解率(ORR;17% vs. 4%, P = 0.05)和疾病控制率(DCR;65% vs. 21%, P<0.001)均显著提升,中位OS分别为9.6个月和5.9个月[8](图2)。复旦大学附属中山医院的一项前瞻性队列研究同样验证了VIC方案的疗效,研究结果提示,VIC组的ORR和DCR显著高于贝伐珠单抗联合化疗,且PFS和OS同样显著更优。基于SWOG S1406研究,VIC方案在2022年已被CSCO指南推荐用于BRAF突变mCRC的二线治疗。
BEACON方案指的是康奈非尼(BRAF抑制剂)+西妥昔单抗±比美替尼(MEK抑制剂),该方案主要源自于BEACON CRC研究。BEACON CRC研究是首个探索BRAF/MEK抑制剂联合抗EGFR单抗在BRAFV600E突变型mCRC中疗效的Ⅲ期优效性研究,该研究证实了康奈非尼+西妥昔单抗±比美替尼的三靶或双靶方案在既往接受过至少一种或两种系统性治疗患者的疗效与安全性。共纳入665例受试者,结果提示三靶组(康奈非尼+西妥昔单抗+比美替尼)和双靶组(康奈非尼+西妥昔单抗)与对照组(伊立替康+西妥昔单抗或FOLFIRI+西妥昔单抗)相比,均可改善患者OS和PFS,三组中位OS分别为9.3个月、9.3个月和5.9个月,三靶组和双靶组较对照组可分别降低死亡风险达40%和39%;中位PFS分别为4.5个月、4.3个月和1.5个月(图3)。缓解率方面,三靶组(27%)和双靶组(20%)的ORR与对照组(2%)相比均显著提高(P <0.0001)。三药并不优于两药[9]。2024年ASCO年会上,BEACON研究的中国桥接试验NAUTICAL CRC研究公布了其结果,与全球BEACON CRC研究的结果一致。两组的中位PFS分别为4.2个月 vs. 2.5个月(HR 0.37, 95%CI 0.20~0.68,P=0.0004),中位OS分别为11.6个月 vs. 8.2个月(HR 0.55,95%CI 0.31~0.99) [13]。亦有一系列研究验证了BEACON方案在真实世界中的疗效[14,15],体现出其良好的应用前景。基于此,在去年发布的欧洲专家小组BRAFV600E突变转移性结直肠癌临床管理共识建议,一线治疗进展后患者应尽快接受康奈非尼联合西妥昔单抗(1A类证据)[16]。

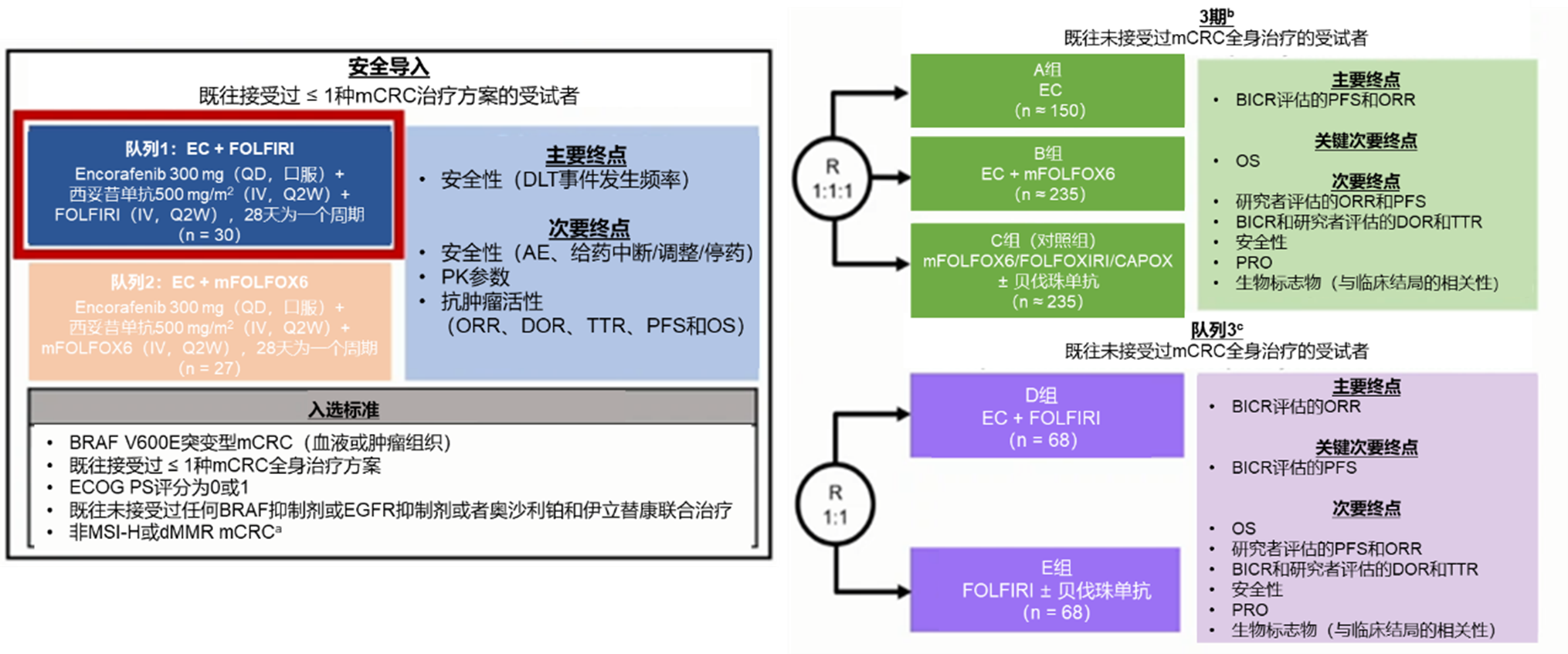
随着BEACON研究在二线治疗中的成功,能否前推到一线治疗成为了值得回答的问题。ANCHOR CRC研究探索了这一方向。结果显示,康奈非尼+西妥昔单抗+比美替尼在一线治疗的ORR为47.4%(95% CI 37.0%~57.9%),中位PFS为5.8个月,中位OS为18.3个月,且安全性可耐受,整体而言显示出了有潜力的治疗活性[17]。因此,Ⅲ期BREAKWATER研究应运而生,旨在评估康奈非尼+西妥昔单抗+/-化疗对比标准治疗在一线治疗中的疗效与安全性。其中,安全性导入期包含了一线和二线人群,近年陆续公布的研究结果观察到初步积极抗肿瘤疗效,康奈非尼+西妥昔单抗(EC)+mFOLFOX6或FOLFIRI在一线治疗中的ORR近70%,EC +mFOLFOX6二线的ORR为50%,EC +FOLFIRI二线的ORR超60%, EC +mFOLFOX6在一线和二线治疗的中位PFS分别为9.9个月和9.7个月,EC +FOLFIRI在一线和二线治疗的中位PFS均未达到,观察到初步积极抗肿瘤疗效,支持正在进行的Ⅲ期研究。由于发现伊立替康与康奈非尼存在药代动力学的相互作用,因此Ⅲ期研究中选择了联合mFOLFOX6。然而,2024年ESMO大会上公布的BREAKWATER安全性导入期的最新结果提示,EC+FOLFIRI在一线治疗和二线治疗的ORR分别为83.3%和44.4%,且截至中位随访超30个月,一线治疗的中位PFS和OS均未达到,二线治疗的中位PFS和OS分别为12.6个月和19.7个月,与历史临床结局相比均有良好的改善,因此研究者在BREAKWATER研究中新加入了队列3,以评估EC+FOLFIRI对比FOLFIRI+/-贝伐珠单抗在BRAFV600E突变患者一线治疗中的疗效[18,19]。期待BREAKWATER Ⅲ期研究和队列3结果的公布(图4),为BRAFV600E突变mCRC患者一线治疗提供更多证据。
能否在BEACON方案基础上进一步提高疗效,是目前探索的热门方向。化疗是肠癌治疗的基石,和化疗的联合是联合策略之一。一项中国的单中心IMPROVEMENT研究探索了维莫非尼+西妥昔单抗+FOLFIRI用于BRAFV600E突变型mCRC的疗效与安全性(n=21),主要入组一线和二线治疗人群(一线:57.1%;二线:38.1%),这一双靶+化疗方案的ORR达81%,中位PFS和OS分别为9.7个月和15.4个月。尽管样本量有限,但初步结果显示出有潜力的抗肿瘤活性,且耐受性良好[20]。我们中心开展了一项Ⅰb期研究,旨在探索达拉非尼+曲美替尼+西妥昔单抗+伊立替康这一四药联合方案的疗效。从目前观察到初步结果来看,这一方案整体毒性可耐受。疗效方面,ORR和DCR分别为30%和80%,中位PFS为7.5个月,展现出有潜力的临床活性,值得进一步探索[21]。
靶免联合治疗方案崭露头角
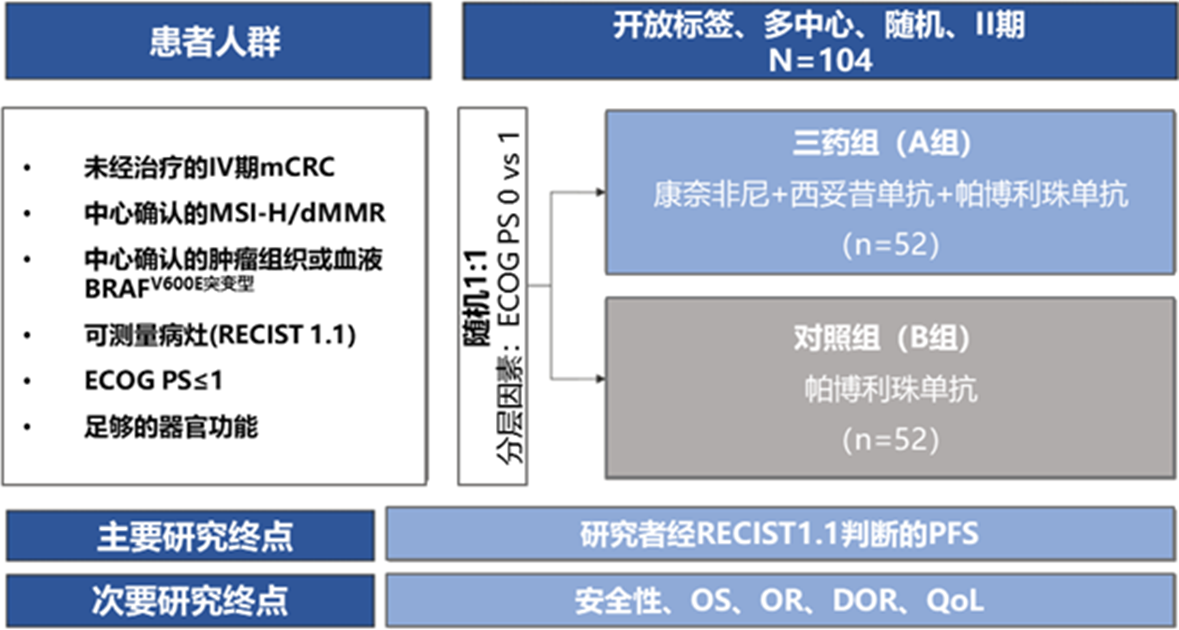
随着免疫检查点抑制剂在MSI-H型mCRC患者中的治疗突破,亦有一系列研究探索了在BRAFV600E突变人群中的应用。据报道,MSI-H患者中BRAFV600E突变发生率明显更高,约为30%~50%,而在MSS型患者中比例为10%[22,23]。一项纳入了1253例结直肠癌的大型分析数据显示,无论BRAF状态如何,MSI-H患者的生存期均显著优于MSS患者 [24]。在Ⅲ期KEYNOTE-177研究中,亚组分析结果显示BRAF突变患者与BRAF 野生患者使用帕博利珠单抗显示出和MSI-H全人群一致的获益趋势,HR分别为0.48(0.27~0.86)和0.50(0.31~0.80)[25]。Ⅲ期CheckMate 8HW研究的亚组分析显示了同样的趋势,纳武利尤单抗+依匹木单抗这一双免联合方案与研究者选择的方案相比,在BRAF突变患者中显示出一致的PFS获益(中位PFS:未达到 vs. 9.2个月,HR 0.37)[26]。这些研究结果也提示了MSI仍是压倒一切的临床因素。去年发布的欧洲专家小组BRAFV600E突变转移性结直肠癌临床管理共识建议,MSI-H状态合并BRAFV600E突变型mCRC的一线治疗首选为免疫检查点抑制剂(1A类证据)[16]。那对于这类患者,在免疫检查点抑制剂的基础上联合BEACON双靶方案能否进一步提升患者的获益?SEAMARK研究计划回答这一临床问题。这是一项开放标签、多中心、随机、Ⅱ期临床研究(图5),计划纳入104例既往未经治疗的MSI-H/dMMR合并BRAFV600E突变型mCRC患者,按照1∶1随机分组接受康奈非尼+西妥昔单抗+帕博利珠单抗对比帕博利珠单抗单药,主要终点为研究者评估的PFS(NCT05217446)。该研究目前正在入组中,预计2026年初步完成,也期待结果的公布,以指导临床实践[27]。
对于BRAFV600E/MSS型mCRC患者,目前的治疗方案以化疗+靶向为主。免疫检查点抑制剂的加入能否提升患者的预后也是值得思考的临床问题,有一系列小样本Ⅱ期研究在后线治疗中探索了这一方向,整体体疗效结果与BRAF抑制剂+抗EGFR单抗的疗效相似,尽管显示出一定潜力,但免疫治疗的加入似乎没有看到进一步的获益[28,29]。国内研究者亦在这方面进行了探索,来自四川大学华西医院的一项Ⅰ期研究初步评估了维莫非尼联合西妥昔单抗和卡瑞利珠单抗治疗经治患者的安全性和疗效。共入组10例受试者,整体耐受性中等,ORR为40%,DCR为80%,中位PFS为3.47个月,中位OS为10.2个月,显示出一定的有效性,需要在更大样本量中进一步验证这一方案的疗效[30]。美国国家癌症研究所(NCI)发起了一项多中心、随机、Ⅱ期的临床研究SWOG S2107,旨在评估康奈非尼联合西妥昔单抗+/-纳武利尤单抗治疗既往接受过≥1线治疗的MSS/BRAFV600E突变mCRC的疗效与安全性[31]。研究正在入组中,预计完成时间为2026年(图6)。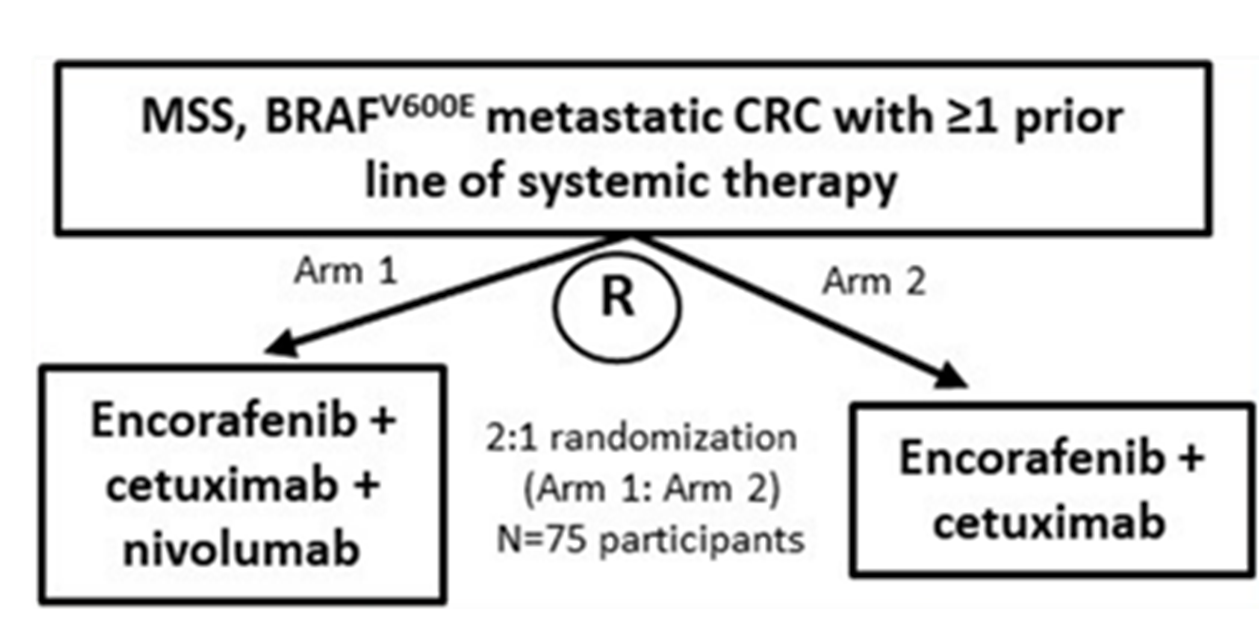
总结和展望
总体而言,BRAFV600E突变型mCRC是临床上预后较差的一种亚型,各指南均推荐在治疗开始前进行BRAF检测。在二线及后线治疗中,以BRAF抑制剂和抗EGFR单抗为基础的方案已成为BRAFV600E突变型mCRC的治疗标准,且有向一线推进的趋势。目前指南推荐的标准一线方案效果并不能令人满意,存在尚未满足的临床需求,BRAF抑制剂+抗EGFR单抗+化疗可能能给患者带来进一步的获益,期待包括BREAKWATER在内的研究结果的公布,为BRAFV600E突变型mCRC这一难治性患者的一线治疗提供更多证据与治疗标准。
MSI-H患者中BRAFV600E突变发生率明显高于MSS型患者,对于MSI-H伴BRAFV600E突变的患者,免疫治疗显示出优异的的疗效,是否需要进一步联合BRAF抑制剂和抗EGFR单抗需要更多研究的探索。在BRAFV600E突变/MSS型患者中,基于目前的研究数据,靶免联合与BRAF抑制剂联合抗EGFR单抗双靶方案相比未能展现出疗效优势,正在进行中的SWOG S2107研究未来可能给予我们更多提示。
1. Marta S. et al., Class 1, 2, and 3 BRAF-Mutated Metastatic Colorectal Cancer: A Detailed Clinical, Pathologic, and Molecular Characterization. Clin Cancer Res. 2019 Jul 1;25(13):3954-3961.
2. Rona Y. & Ryan B. C., Targeting Alterations in the RAF–MEK Pathway. Cancer Discov. 2019 Mar;9(3):329-341.
3. Jeremy C J. et al., Non-V600 BRAF Mutations Define a Clinically Distinct Molecular Subtype of Metastatic Colorectal Cancer. J Clin Oncol. 2017 Aug 10;35(23):2624-2630.
4. Yungchang. C. et al., Clinical and genomic distinction of class 1/2/3 BRAF-mutant colorectal cancer and differential prognosis. J Clin Oncol 40, 2022 suppl 16; abstr 3533.
5. Cremolini C, Loupakis F, Antoniotti C, et al. FOLFOXIRI plus bevacizumab versus FOLFIRI plus bevacizumab as first-line treatment of patients with metastatic colorectal cancer: updated overall survival and molecular subgroup analyses of the open-label, phase 3 TRIBE study. Lancet Oncol. 2015;16(13):1306-1315.
6. Cremolini C, Antoniotti C, Rossini D, et al. Upfront FOLFOXIRI plus bevacizumab and reintroduction after progression versus mFOLFOX6 plus bevacizumab followed by FOLFIRI plus bevacizumab in the treatment of patients with metastatic colorectal cancer (TRIBE2): a multicentre, open-label, phase 3, randomised, controlled trial. Lancet Oncol. 2020;21(4):497-507.
7. Cremolini C, Antoniotti C, Stein A, et al. Individual Patient Data Meta-Analysis of FOLFOXIRI Plus Bevacizumab Versus Doublets Plus Bevacizumab as Initial Therapy of Unresectable Metastatic Colorectal Cancer [published online ahead of print, 2020 Aug 20]. J Clin Oncol. 2020, JCO 2001225.
8. Scott K. et al., Randomized Trial of Irinotecan and Cetuximab With or Without Vemurafenib in BRAF-Mutant Metastatic Colorectal Cancer (SWOG S1406). J Clin Oncol. 2021 Feb 1;39(4):285-294.
9. Josep T. et al., Encorafenib Plus Cetuximab as a New Standard of Care for Previously Treated BRAF V600E-Mutant Metastatic Colorectal Cancer: Updated Survival Results and Subgroup Analyses from the BEACON Study. J Clin Oncol. 2021 Feb 1;39(4):273-284.
10. 中国临床肿瘤协会(CSCO)结直肠癌诊疗指南 2024.
11. NCCN Clinical Practice Guidelines in Oncology, Colon Cancer Version 1.
12. A. Cervantes. et al., Metastatic colorectal cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2023 Jan;34(1):10-32.
13. Xicheng W. et al., Encorafenib and cetuximab versus irinotecan/cetuximab or FOLFIRI/cetuximab in Chinese patients with BRAF V600E mutant metastatic colorectal cancer: The NAUTICAL CRC study. LBA3559, 2024 ASCO.
14. C. Gallois. et al., Efficacy and safety of the combination of encorafenib and cetuximab in patients with BRAF V600E mutated metastatic colorectal cancer: An AGEO real-world multicentre study. Abs 625P, 2023 ESMO.
15. Sebastian S. et al. Encorafenib plus cetuximab in patients with metastatic, BRAF V600E-mutated, colorectal carcinoma: First effectiveness data of the European multi-centric, multi-national, non-interventional study—BERING-CRC. Abs 3551, 2024 ASCO.
16. Erika M. et al., European expert panel consensus on the clinical management of BRAFV600E-mutant metastatic colorectal cancer. Cancer Treat Rev. 2023 Apr:115:102541.
17. Eric Van C. et al., ANCHOR CRC: Results From a Single-Arm, Phase II Study of Encorafenib Plus Binimetinib and Cetuximab in Previously Untreated BRAFV600E-Mutant Metastatic Colorectal Cancer. J Clin Oncol. 2023 May 10;41(14):2628-2637.
18. Josep Tabernero , et al. BREAKWATER safety lead-in (SLI): Encorafenib (E) + cetuximab (C) + chemotherapy (chemo) for BRAFV600E metastatic colorectal cancer (mCRC). 2022 ESMO LBA 26.
19. Josep Tabernero, et al. Encorafenib cetuximab (EC) FOLFIRI for BRAF V600E mutant metastatic colorectal cancer (mCRC): Updated Results From the BREAKWATER Safety Lead-In (SLI). 515MO, 2024 ESMO.
20. Zhan W. et al., Cetuximab and vemurafenib plus FOLFIRI (5-fluorouracil/leucovorin/ irinotecan) for BRAF V600E-mutated advanced colorectal cancer (IMPROVEMENT): An open-label, single-arm, phase II trial. Eur J Cancer. 2022 Mar:163:152-162.
21. Yungchang. C. et al., Phase Ib Study of Dabrafenib, Trametinib, Irinotecan and Cetuximab in BRAF V600E mutated Metastatic , Colorectal CancerJ Clin Oncol 41, 2023 (suppl 4; abstr 156).
22. Maria Grazia R. et al., Exploring biological heterogeneity and implications on novel treatment paradigm in BRAF-mutant metastatic colorectal cancer. Crit Rev Oncol Hematol. 2022 May:173:103657.
23. Ben T. et al., Impact of BRAF mutation and microsatellite instability on the pattern of metastatic spread and prognosis in metastatic colorectal cancer. Cancer. 2011 Oct 15;117(20):4623-32.
24. Paul L. et al., Microsatellite instability and BRAF mutation testing in colorectal cancer prognostication. J Natl Cancer Inst. 2013 Aug 7;105(15):1151-6.
25. Thierry Andre et al. Final overall survival for the phase III KN177 study: Pembrolizumab versus chemotherapy in microsatellite instability-high/mismatch repair deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC). 2021 ASCO, abs3500.
26. Thierry Andre,et al. Nivolumab (NIVO) plus ipilimumab (IPI) vs chemotherapy (chemo) as first-line (1L) treatment for microsatellite instability-high/mismatch repair-deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC): First results of the CheckMate 8HW study. 2024 ASCO GI, LBA768.
27. Scott K. et al., SEAMARK: Randomized phase 2 study of pembrolizumab + encorafenib + cetuximab versus pembrolizumab alone for first-line treatment of BRAF V600E-mutant and microsatellite instability-high (MSI-H)/mismatch repair deficient (dMMR) metastatic colorectal cancer (CRC). 2022 ASCO abs.TPS3634.
28. Jun T. et al. Combined PD-1, BRAF and MEK inhibition in BRAFV600E colorectal cancer: a phase 2 trial. Nat Med. 2023 Feb;29(2):458-466.
29. Van K. Morris et al. Phase I/II trial of encorafenib, cetuximab, and nivolumab in patients with microsatellite stable (MSS), BRAFV600E metastatic colorectal cancer. 2022 ASCO Abs 3598.
30. Gui-Xia W, et al. Tolerability and Safety of Vemurafenib, Cetuximab Combined with Camrelizumab for BRAF V600E mutated /MSS Metastatic Colorectal Cancer. Abs 624P, 2023 ESMO.
31. Van K.M. et al., SWOG S2107: Randomized phase II trial of encorafenib and cetuximab with or without nivolumab for patients with previously treated, microsatellite stable, BRAFV600E metastatic and/or unresectable colorectal cancer. 2024 ASCO GI, TPS234.
排版编辑:Crystal











 苏公网安备32059002004080号
苏公网安备32059002004080号


