*此报道将发布于良医汇-肿瘤医生APP
晚期胆道恶性肿瘤(BTC)的全身治疗选择有限,且疗效不尽如人意。德国的一项随机Ⅱ期AIO NALIRICC研究[1]纳入了含吉西他滨方案治疗后进展的晚期BTC患者,旨在比较伊立替康脂质体+氟尿嘧啶+亚叶酸与氟尿嘧啶+亚叶酸治疗的疗效和安全性。结果表明,虽然伊立替康脂质体+氟尿嘧啶+亚叶酸治疗的总的缓解率优于氟尿嘧啶+亚叶酸,但并未转化为无进展生存的延长。尽管整体安全性可控,但治疗毒性可能导致治疗暴露减少,致使无进展生存无改善。
前言
胆道恶性肿瘤(BTC)为罕见肿瘤,发病率不足2/10万。多数BTC为散发性,已知危险因素包括高龄、肥胖、非酒精性脂肪肝、病毒性乙型和丙型肝炎以及原发性硬化性胆管炎,亚洲国家肝吸虫感染也是重要的危险因素。手术切除仍是目前BTC唯一的治愈性手段,但由于术后往往早期复发,因此几乎所有BTC患者最终都要接受姑息性化疗。
基于Ⅲ期ABC-02研究[2]的结果,2010年吉西他滨+顺铂方案成为晚期BTC的标准一线治疗。尽管既往开展了大量的研究,但法国和美国的研究均未能证实三药化疗、靶向治疗+化疗的疗效优于吉西他滨+顺铂,仅日本的研究发现在双药化疗基础上加用S-1有轻微获益[3-5]。TOPAZ-1[6]和KEYNOTE-966[7]两项随机Ⅲ期研究表明,在吉西他滨+顺铂基础上加入PD-L1抑制剂度伐利尤单抗或PD-1抑制剂帕博利珠单抗均较单纯化疗显著改善生存,且安全性数据良好,故免疫治疗+化疗成为目前一线标准治疗。部分患者,特别是肝内胆管癌患者还可选择精准个体化治疗。Ⅲ期ABC-06研究[8]证实了氟尿嘧啶+奥沙利铂(FOLFOX)二线治疗的有效性,该方案因此被确定立为二线治疗的首选方案,但中位OS仅6.2个月,对照组5.3个月,期望更有效的治疗方案。
NAPOLI-1研究[9]中,伊立替康脂质体+氟尿嘧啶+亚叶酸二线治疗胰腺导管腺癌显示出具有临床意义的疗效,含伊立替康脂质体的方案也被认为是BTC的潜在治疗选择。韩国的多中心开放性Ⅱb期NIFTY研究[10,11]首次评估了伊立替康脂质体+氟尿嘧啶+亚叶酸治疗晚期BTC的疗效,共招募174例吉西他滨+顺铂一线治疗进展患者,研究组中位OS 8.6个月,对照组5.3个月。德国NIFE研究[12]支持上述结果,该研究中伊立替康脂质体+氟尿嘧啶+亚叶酸钙一线治疗的中位OS 15.9个月,对照组吉西他滨+顺铂的中位OS 13.6个月。
研究方法
NALIRICC是一项多中心开放性随机Ⅱ期研究,在德国的17个医学中心进行,患者≥18岁,东部肿瘤协作组状态(ECOG PS)评分0~1,确诊为不可切除的局部晚期或转移性胆管癌/胆囊癌,含吉西他滨方案治疗后进展。1∶1随机接受每2周静脉输注伊立替康脂质体(70mg/m²)、氟尿嘧啶(2400mg/m²)和亚叶酸(400mg/m²)(伊立替康脂质体组)或每2周静脉输注氟尿嘧啶(2400mg/m²)+亚叶酸(400mg/m²)(对照组)。按原发肿瘤部位分层。研究者评估的PFS是主要终点,所有随机患者均进行评估。次要终点包括OS、客观缓解率(ORR)和生活质量。所有随机分配且接受至少1剂研究治疗的患者进行安全性评估。
研究结果
2017年12月4日至2021年8月2日期间,伊立替康脂质体组共入组49例患者,对照组51例患者,中位年龄65岁,女性45例(45%)。结果显示,伊立替康脂质体组未较对照组改善PFS和OS:中位PFS分别为2.6个月和2.3个月(HR=0.87);中位OS分别为6.9个月和8.2个月(HR=1.08)(图1)。两组的ORR分别为14%和4%。
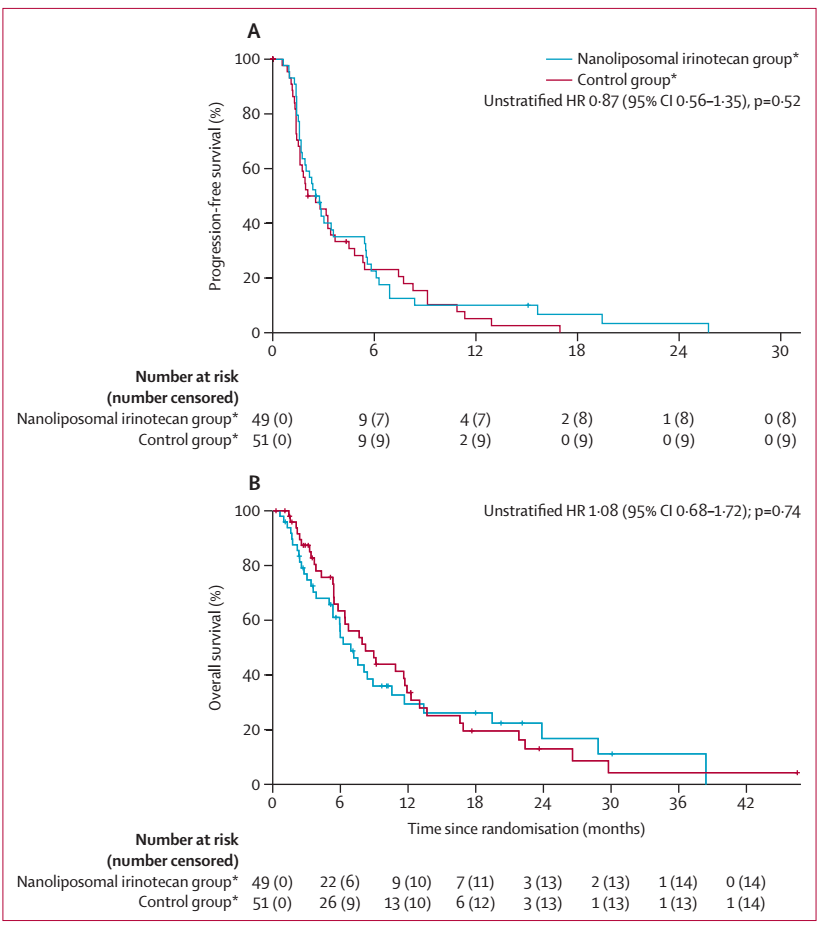
安全性方面,伊立替康脂质体组最常见的≥3级不良事件(AE)包括中性粒细胞减少、腹泻和恶心。对照组最常见的≥3级AE是胆管炎和胆管狭窄。伊立替康脂质体组16例(33%)患者发生严重治疗相关不良事件,对照组仅1例。至整体健康状况恶化的中位持续时间,伊立替康脂质体组4.0个月,对照组3.7个月。
讨论
NALIRICC研究未能在西欧BTC患者中证实伊立替康脂质体+氟尿嘧啶+亚叶酸二线治疗相较于氟尿嘧啶+亚叶酸的获益。值得注意的是, NALIRICC和NIFTY研究的纳入和排除标准以及两组的干预设计均相似,但NALIRICC研究中对照组的中位PFS较根据NIFTY研究预设的PFS延长了1.4个月,而NIFTY研究显示研究组的中位PFS和中位OS均较对照组有改善。NALIRICC和NIFTY研究的一个显著差异是进展后治疗的频度和类型不同,NIFTY研究中两组接受后线治疗的患者比例相似,对照组仅3.5%的患者转为含伊立替康方案的治疗,而NALIRICC研究中对照组接受至少一种后线治疗的患者比例更高,70%患者接受了含伊立替康方案的治疗。除进展后治疗模式不同之外,目前无证据表明基线特征对NIFTY和NALRICC两项研究中疗效的不同有实质性影响,中位年龄、性别和远处转移分布均相似。
NALIRICC研究中69%的患者ECOG PS为0,NIFTY研究中78%的患者ECOG PS为1,NALIRICC研究中的患者虽然PS评分更好,但并未转化为临床结果的改善。两项研究中原发肿瘤部位多为肝内胆管癌,但NIFTY研究中肝外胆管癌(27%和19%)和胆囊癌(30%和17%)比例更高,肿瘤部位与伊立替康治疗反应的相关性尚不清楚。德国NIFE研究和法国PRODIGE38-AMEBICA研究的亚组分析表明,一线治疗时肝外胆管癌可能对含伊立替康方案的反应优于肝内胆管癌,NALRICC和NIFTY研究表明这一趋势在二线治疗时并不明显。本研究未进一步分析分子标志物,因此无法明确遗传变异与疗效的相关性。
根据NAPOLI研究(比较伊立替康脂质体+氟尿嘧啶+亚叶酸与氟尿嘧啶+亚叶酸治疗胰腺腺癌的疗效)结果,预期NALIRICC研究中伊立替康脂质体组的AE发生率相对较高,但事实却是伊立替康脂质体组和对照组的严重AE的总发生率均高于NIFTY研究,NALIRICC研究中分别为56%和40%,NIFTY研究中分别为42%和24%。该结果说明,NALIRICC研究人群的氟尿嘧啶+亚叶酸导致的背景毒性更高,从而导致更高的总体毒性。NALIRICC和NIFTY研究的毒性谱略有不同,伊立替康脂质体组最常见的3或4级AE是中性粒细胞减少和腹泻,NALIRICC研究的腹泻发生率更高(15%和5%),NIFTY研究的中性粒细胞减少发生率更高(24%和17%),其他研究也曾报道过亚洲和欧洲患者的这种差异,可能与药代动力学差异和活性代谢产物浓度不同有关。虽然NALIRICC研究中伊立替康脂质体组的AE发生率较高,但两组的至生活质量恶化时间并无显著差异,表明伊立替康脂质体+氟尿嘧啶+亚叶酸的AE可控,与NIFTY研究结果一致。
[1] Vogel A, Saborowski A, Wenzel P, et al. Nanoliposomal irinotecan and fluorouracil plus leucovorin versus fluorouracil plus leucovorin in patients with cholangiocarcinoma and gallbladder carcinoma previously treated with gemcitabine-based therapies (AIO NALIRICC): a multicentre, open-label, randomised, phase 2 trial. Lancet Gastroenterol Hepatol 2024;9(8):734-744.
[2] Valle J, Wasan H, Palmer DH, et al. Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer. N Engl J Med 2010; 362: 1273–81.
[3] Shroff RT, Guthrie KA, Scott AJ, et al. SWOG 1815: a phase III randomized trial of gemcitabine, cisplatin, and nab-paclitaxel versus gemcitabine and cisplatin in newly diagnosed, advanced biliary tract cancers. Proc Am Soc Clin Oncol 2023; 41 (suppl): LBA490 (abstr).
[4] Ioka T, Kanai M, Kobayashi S, et al. Randomized phase III study of gemcitabine, cisplatin plus S-1 versus gemcitabine, cisplatin for advanced biliary tract cancer (KHBO1401-MITSUBA). J Hepatobiliary Pancreat Sci 2023; 30: 102–10.
[5] Phelip JM, Desrame J, Edeline J, et al. Modified FOLFIRINOX versus CISGEM chemotherapy for patients with advanced biliary tract cancer (PRODIGE 38 AMEBICA): a randomized phase II study. J Clin Oncol 2022; 40: 262–71.
[6] Kelley RK, Ueno M, Yoo C, et al. Pembrolizumab in combination with gemcitabine and cisplatin compared with gemcitabine and cisplatin alone for patients with advanced biliary tract cancer (KEYNOTE-966): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2023; 401: 1853–65.
[7] Oh D-Y, He AR, Qin S, et al. Durvalumab plus gemcitabine and cisplatin in advanced biliary tract cancer. NEJM Evid 2022; 1: EVIDoa2200015.
[8] Lamarca A, Palmer DH, Wasan HS, et al. Second-line FOLFOX chemotherapy versus active symptom control for advanced biliary tract cancer (ABC-06): a phase 3, open-label, randomised, controlled trial. Lancet Oncol 2021; 22: 690–701.
[9] Wang-Gillam A, Hubner RA, Siveke JT, et al. NAPOLI-1 phase 3 study of liposomal irinotecan in metastatic pancreatic cancer: final overall survival analysis and characteristics of long-term survivors. Eur J Cancer 2019; 108: 78–87.
[10] Yoo C, Kim KP, Jeong JH, et al. Liposomal irinotecan plus fluorouracil and leucovorin versus fluorouracil and leucovorin for metastatic biliary tract cancer after progression on gemcitabine plus cisplatin (NIFTY): a multicentre, open-label, randomised, phase 2b study. Lancet Oncol 2021; 22: 1560–72.
[11] Hyung J, Kim I, Kim KP, et al. Treatment with liposomal irinotecan plus fluorouracil and leucovorin for patients with previously treated metastatic biliary tract cancer: the phase 2b NIFTY randomized clinical trial. JAMA Oncol 2023; 9: 692–99.
[12] Perkhofer L, Striefler JK, Sinn M, et al. Nal-IRI with 5-fluorouracil (5-FU) and leucovorin or gemcitabine plus cisplatin in advanced biliary tract cancer: final results of the NIFE-trial (AIO-YMO HEP-0315), a randomized phase II study of the AIO Biliary Tract Cancer group. Ann Oncol 2021; 32 (suppl 5): S1282 (abstr).
本材料由阿斯利康公司提供,仅供医疗卫生专业人士参考,不用于产品推广目的。涉及具体药物使用,请参考相关药品说明书。
审批编码:CN-145630
有效期至:2025/3/31
排版编辑:肿瘤资讯-CXY











 苏公网安备32059002004080号
苏公网安备32059002004080号


