2024年9月16日,国际知名期刊BMC Health Services Research发表了一篇原创研究文章,该研究探讨了医疗支出模式与胃癌发病率之间的关联。通过使用韩国国民健康保险服务高级队列数据,采用嵌套病例对照设计,将确诊患有胃癌的个体与未确诊的个体进行匹配,并进行医疗支出轨迹分析。研究确定了7种不同的五年医疗支出轨迹。结果显示,医疗支出轨迹与胃癌风险之间存在显著关联,特别是快速增长、持续最低和逐渐增加的医疗支出模式与更高的胃癌发病风险相关。研究结论表明,通过监测医疗支出轨迹,可以识别潜在的高风险人群,从而帮助早期筛查和预防胃癌[1]。【肿瘤资讯】整理该研究要点,以飨读者。
研究背景
胃癌是全球范围内高度常见的癌症之一,尤其在韩国发病率极高[2]。2020年,胃癌是韩国第四大常见癌症,约占所有癌症的10.8%[3]。韩国的胃癌发病率在全球排名靠前,特别是在男性中发病率显著高于女性,达到每10万人中76.2人[2,3]。虽然2010年至2020年间胃癌的发病率有所下降,但韩国男性的胃癌发病率仍是全球最高[2,3]。
癌症的发病率持续上升,不仅对患者及其家庭构成了沉重的经济负担,也增加了卫生系统和社会的压力[4,5]。由于癌症治疗包括住院、门诊、化疗、药物、手术等多种高成本项目,胃癌的经济负担尤为显著[6,7]。因此,准确和及时的胃癌筛查显得尤为重要,有助于早期发现和治疗,从而减少治疗成本和患者负担[8]。
胃癌的发生是由多种因素共同作用的结果,包括人口统计学特征、生活方式、遗传易感性、医疗条件和感染因素[9]。可改变的风险因素如吸烟、高盐饮食和幽门螺杆菌感染已被证明与胃癌的发病密切相关[10,11]。韩国自1999年起实施全国性的胃癌筛查计划,建议40岁及以上人群每两年进行一次内窥镜检查或上消化道系列检查[12]。这一筛查计划在降低胃癌发病率方面发挥了重要作用,特别是通过早期发现癌前病变和根除幽门螺杆菌感染[13]。
尽管已有研究关注癌症诊断后及临终关怀期间的医疗支出[14],但尚缺乏对胃癌发病前医疗支出模式的研究。由于胃肠道癌症的致病过程通常持续5至15年[15],纵向分析医疗支出轨迹可能为识别高风险人群提供重要线索。通过监测支出轨迹,可以为早期胃癌的筛查和预防提供参考,从而减少疾病带来的经济负担。因此,本研究利用韩国国家健康保险服务(NHIS)高级队列数据,采用嵌套病例对照设计,分析了胃癌发病前的医疗支出轨迹与胃癌发病率之间的关联,以填补这一研究空白。
研究方法
本研究利用韩国NHIS老年队列数据,采用嵌套病例对照设计,分析了健康支出轨迹与胃癌发病率之间的关联。研究对象为2008年至2019年间基线年龄为60岁及以上的761,917名个体。排除有癌症病史、接受医疗救助以及因非突发性胃癌死亡的参与者后,共纳入59,492名个体进行分析。通过潜在类别轨迹模型(LCTM)识别了7种不同的医疗支出轨迹,并使用条件逻辑回归分析这些支出轨迹与胃癌发病率的关联。协变量包括社会人口因素、基础健康状况、健康行为和既往病史等。此外,进行了敏感性分析以确保结果的稳健性。统计分析使用SAS和R软件进行,显著性水平通过比值比(OR)和95%置信区间(CI)确定。
研究结果
本研究利用韩国NHIS老年队列数据,探讨了胃癌发病前的卫生支出轨迹与胃癌发病率之间的关联。通过潜在类别轨迹模型(LCTM)分析,确定了7种不同的卫生支出轨迹类型,包括“持续最低”、“快速上升”、“逐渐上升”、“持续次高”、“中低”、“逐渐下降”和“持续最高”,并最终选择了符合模型拟合度和比例标准的类别7作为分析对象(表1)。
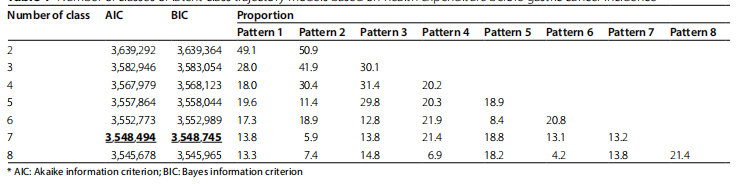
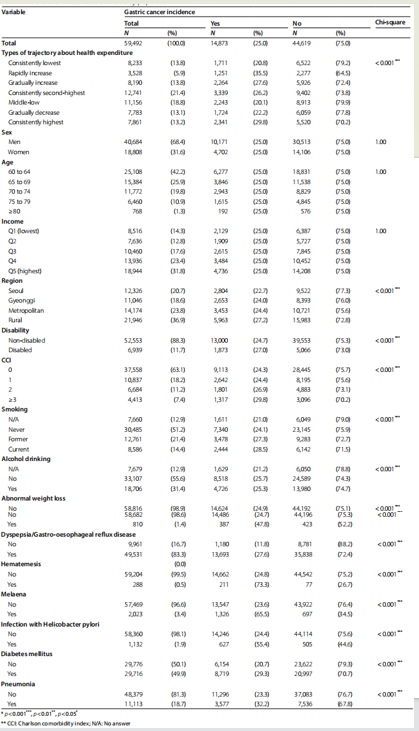
共纳入59,492名研究对象,其中14,873名为胃癌病例组,44,619名为对照组。研究对象中大多数为男性(68.4%),年龄在65岁以下(42.2%),收入处于最高四分位数(31.8%),居住在农村地区(36.9%),无残疾(88.3%),CCI评分为0(63.1%),从未吸烟(51.2%),不饮酒(55.6%),且49.9%的老年人患有糖尿病。快速上升、持续最高和逐渐上升的支出轨迹组的胃癌发病率分别为35.5%、29.8%和27.6%,均显著高于其他支出轨迹组(p < 0.001)(表2)。
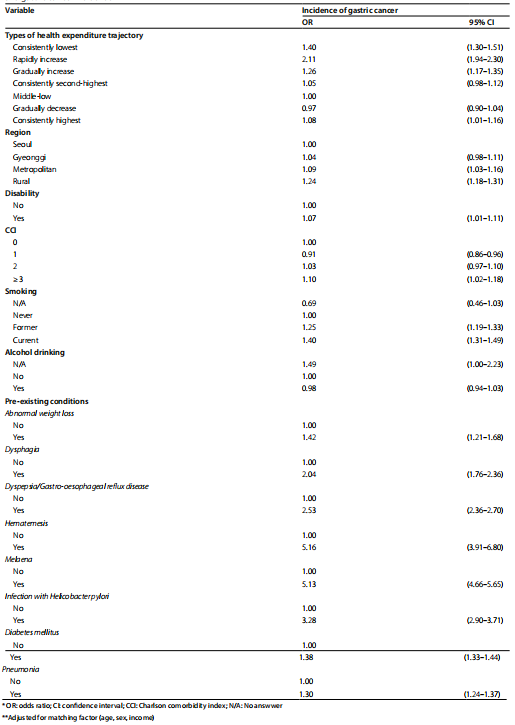
条件逻辑回归分析结果显示,与中低支出组相比,持续最低组(OR = 1.40,95% CI;1.30-1.51)、快速上升组(OR = 2.11,95% CI;1.94-2.30)和逐渐上升组(OR = 1.26,95% CI;1.17-1.35)的个体胃癌发病风险更高(表3)。此外,居住在大城市和农村地区、存在残疾、较高CCI评分、吸烟、患有既往疾病的人群胃癌发病率也较高。特定疾病如吞咽困难(OR = 2.04,95% CI;1.76-2.36)、消化不良/胃食管反流病(OR = 2.53,95% CI;2.36-2.70)、幽门螺杆菌感染(OR = 3.28,95% CI;2.90-3.71)等都显著增加了胃癌风险(表3)。
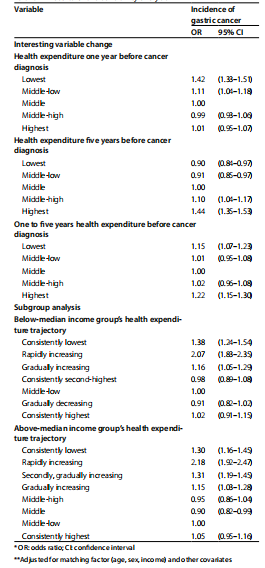
敏感性分析进一步验证了结果的稳健性。在有趣变量变化分析中,胃癌确诊前一年和五年内的卫生费用与胃癌发病风险显著相关,快速增加组和持续最低组的风险较高。在不同收入亚组的分析中,低于中位数收入组和高于中位数收入组的分析结果显示相似趋势,持续最低组和快速增加组的胃癌发病率较高(表4)。
研究讨论
该研究是首个探讨医疗支出轨迹与胃癌发病率之间关联的研究,利用韩国的强制性社会医疗保险系统,为卫生支出和利用模式的研究提供了理想的环境。研究结果表明,快速增加、持续最低和逐渐增加的医疗支出轨迹与胃癌发病率显著相关。快速增加组的个体胃癌风险最高(OR = 2.11),其次是持续最低组(OR = 1.40)和逐渐增加组(OR = 1.26)。这些发现通过敏感性分析得到进一步证实,显示了短期和长期卫生费用与胃癌发病率之间的稳健关联。
研究结果揭示了监测卫生支出轨迹在识别胃癌高危人群中的潜在作用。不同支出轨迹反映了不同的健康需求利用模式,如基于需求的利用、供应商诱导的需求或未满足的需求。持续最低支出组面临的胃癌风险较高,可能源于医疗服务的未充分利用。而快速和逐渐增加的支出轨迹也显示出较高的胃癌风险,这表明最初不必要的需求可能最终演变为基于需求的利用,与癌症发病有关。
此外,研究还显示,农村地区和残疾人群体的胃癌发病率较高,这与之前的研究一致。农村居民可能因饮食习惯,如高盐摄入,面临更高的胃癌风险,而残疾人往往在晚期才被诊断,导致更高的癌症发病率和死亡率。有既往疾病和较高Charlson合并症指数(CCI)评分的参与者同样面临更高的胃癌发病风险,进一步支持了合并症与癌症发病率之间的关联。
结论
该研究表明,快速增长、持续最低和逐渐增长的医疗支出轨迹与较高的胃癌发病风险相关。监测这些支出模式有助于识别高风险人群,因此,跟踪和分析卫生支出轨迹对早期干预至关重要。研究结果可用于指导高风险人群通过NHIS的健康利用记录进行癌症筛查。此外,个人还可以通过“My Data”平台下载和评估自己的健康记录,了解医疗支出模式,从而采取针对性的二级预防措施,降低胃癌风险。这一发现为胃癌早期筛查和预防提供了新的思路,有助于提高高危人群的健康管理效果。
声明:材料由阿斯利康支持,仅供医疗卫生专业人士参考
审批编码:CN-145427
有效期至:2025-10-24
1. Lee WR, et. al. Health expenditure trajectory and gastric cancer incidence in the National Health Insurance Senior Cohort: a nested case-control study. BMC Health Serv Res. 2024 Sep 16;24(1):1076.
2. Balakrishnan M, et. al. Changing Trends in Stomach Cancer Throughout the World. Curr Gastroenterol Rep. 2017 Aug;19(8):36. doi: 10.1007/s11894-017-0575-8. PMID: 28730504; PMCID: PMC6918953.
3. Morgan E, et. al. The current and future incidence and mortality of gastric cancer in 185 countries, 2020-40: A population-based modelling study. EClinicalMedicine. 2022 Apr 21;47:101404.
4. Luengo-Fernandez R, Leal J, Gray A, Sullivan R. Economic burden of cancer across the European Union: a population-based cost analysis. Lancet Oncol. 2013 Nov;14(12):1165-74.
5. Rahmani H, et. al. Burden of esophageal cancer in Iran during 1995-2015: Review of findings from the Global Burden of Disease studies. Med J Islam Repub Iran. 2018 Jul 2;32:55.
6. Nguyen TXT, et. al. The economic burden of cancers attributable to smoking in Korea, 2014. Tob Induc Dis. 2019 Feb 28;17:15.
7. Barr RD, Feeny D, Furlong W. Economic evaluation of treatments for cancer in childhood. Eur J Cancer. 2004 Jun;40(9):1335-45.
8. Fitzgerald RC, et. al. The future of early cancer detection. Nat Med. 2022 Apr;28(4):666-677.
9. Karimi P, et. al. Gastric cancer: descriptive epidemiology, risk factors, screening, and prevention. Cancer Epidemiol Biomarkers Prev. 2014 May;23(5):700-13.
10. Kamangar F. Socio-economic health inequalities: ever-lasting facts or amenable to change? Int J Prev Med. 2013 Jun;4(6):621-3. PMID: 23930178; PMCID: PMC3733028.
11. Tsugane S, et. al. Salt and salted food intake and subsequent risk of gastric cancer among middle-aged Japanese men and women. Br J Cancer. 2004 Jan 12;90(1):128-34.
12. Jun JK, et. al.. Effectiveness of the Korean National Cancer Screening Program in Reducing Gastric Cancer Mortality. Gastroenterology. 2017 May;152(6):1319-1328.e7.
13. Lee YC, et. al. Association Between Helicobacter pylori Eradication and Gastric Cancer Incidence: A Systematic Review and Meta-analysis. Gastroenterology. 2016 May;150(5):1113-1124.e5.
14. Morishima T, et. al. Association of healthcare expenditures with aggressive versus palliative care for cancer patients at the end of life: a cross-sectional study using claims data in Japan. Int J Qual Health Care. 2014 Feb;26(1):79-86.
15. Morishima T, et. al. Association of healthcare expenditures with aggressive versus palliative care for cancer patients at the end of life: a cross-sectional study using claims data in Japan. Int J Qual Health Care. 2014 Feb;26(1):79-86.
排版编辑:肿瘤资讯-Rex











 苏公网安备32059002004080号
苏公网安备32059002004080号


