2024年7月5日,NATURE REVIEWS CANCER(IF:78.5)在线发布了一篇名为“Towards targeting the breast cancer immune microenvironment”的综述,旨在探讨乳腺癌免疫肿瘤微环境(TME)中的各种组分、疾病进展中TME的变化、影响免疫TME的宿主因素和靶向或影响免疫TME的疗法。本期(上篇)整理了乳腺癌TME中的各种组分和疾病进展中TME的变化。

背景解析
乳腺癌是全球女性中最常见的癌症,占所有女性癌症诊断的31%。尽管生存率有所提高,但该疾病的负担仍然很高,是30-60岁女性的主要死亡原因。基于基因表达数据乳腺癌可分为五种亚型:HER2+型、Luminal A型、Luminal B型、基底样型和Claudin-low型。其治疗和预后取决于HER2和激素受体(HR)表达以及疾病阶段。三阴性乳腺癌(TNBC)患者在晚期疾病中的预后最差,而HER2扩增型乳腺癌由于HER2靶向治疗的出现,其预后显著改善。
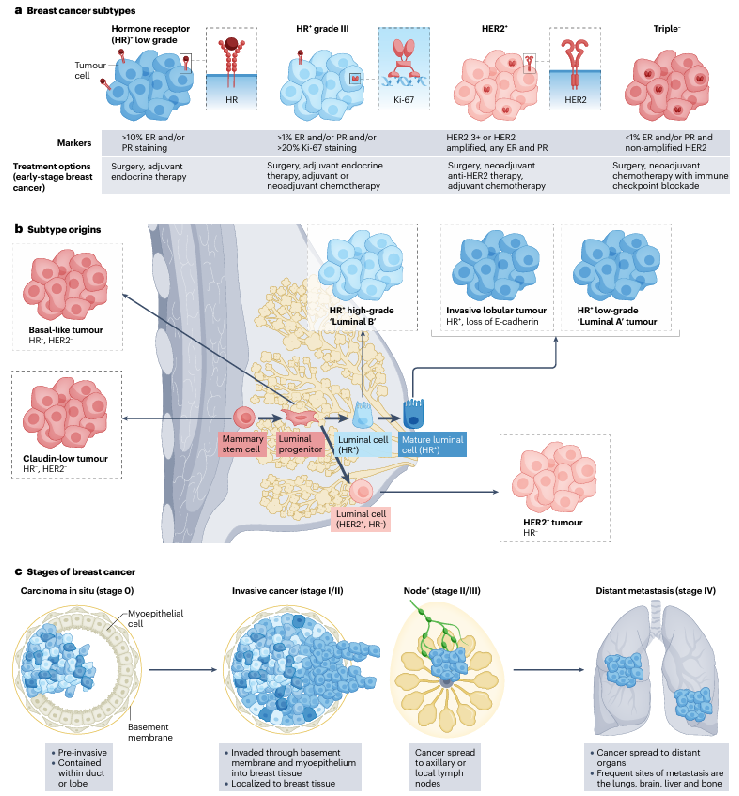 图1 乳腺癌亚型的起源和分期
图1 乳腺癌亚型的起源和分期
乳腺癌现有的全身治疗主要包括:细胞毒化疗、激素治疗和肿瘤细胞特异性靶向治疗三种。免疫检查点阻断(ICB)等新疗法的出现聚焦于靶向TME,提供了在肿瘤细胞缺乏可操作靶点时的新治疗方法。
TME的多种细胞类型在疾病病理中起着关键作用,这些细胞可以通过分泌和表达促进肿瘤细胞增殖和抑制抗肿瘤免疫应答的因子来促进疾病进展,或反之,通过适应性免疫来对抗肿瘤生长。免疫在癌症中的关键作用通过流行病学数据得以证明,这些数据显示免疫功能低下的患者患癌症的风险增加且死亡率更高。靶向TME的疗法,包括ICB和新兴疗法,如程序性细胞死亡蛋白1(PD1)抑制剂帕博利珠单抗或程序性细胞死亡配体1(PDL1)抑制剂阿替利珠单抗联合化疗在TNBC中比单独化疗更有效,可以显著减少乳腺癌的复发。仍需进一步的研究以识别可能从ICB中受益的患者。本研究从肿瘤因素如免疫TME的组成、不同疾病进展中的TME、影响TME的宿主因素和靶向或影响免疫TME的疗法这几方面对乳腺癌中的TME进行综述。
乳腺癌免疫TME的组成部分
乳腺癌TME是一个复杂的领域,由多种免疫和基质细胞组成,这些细胞在促进和抑制抗肿瘤免疫应答中发挥着重要作用。TNBC和HER2+亚型具有更丰富的肿瘤浸润淋巴细胞(TIL),而TIL的数量与TNBC的预后以及ICB联合化疗的疗效相关。髓系细胞如肿瘤相关巨噬细胞(TAMs)通过产生生长因子和细胞因子促进肿瘤增殖;而树突状细胞(DCs)和M1样巨噬细胞则通过抗原呈递连接先天和适应性免疫;癌症相关成纤维细胞(CAFs)也在调节抗肿瘤免疫应答中起重要作用。国际免疫肿瘤学工作组已将TIL评估标准化,并纳入若干国际指南中,以帮助预测TNBC和HER2+乳腺癌患者的预后和复发风险。
肿瘤浸润T细胞
因为亚型的不同,乳腺癌中肿瘤浸润T细胞的数量和类型也不相同。TNBC具有最高数量的T细胞(其中CD8+ T细胞比例较高),这与其相对较高的肿瘤突变负担和基因组不稳定性有关。不同乳腺癌亚型的T细胞在表型和功能上也存在差异。例如,在未经治疗的Luminal B和Luminal A肿瘤中,CD8+ T细胞上的PD1和淋巴细胞活化基因3(LAG3)表达存在差异。
TIL在TME中的位置和分布会影响临床结果。混合TME(TILs分散在肿瘤细胞中)具有更高的PD1+ CD8+ T细胞比例,这与更好的生存率相关。CD8+与 CD4+ T细胞的比例随着TIL密度的增加而增加,这表明高TIL密度样本中效应T细胞的数量越多,临床结果就越好。多种免疫检查点和功能标志物的表达结果表明,这些T细胞亚群可能对ICB疗法高度敏感。
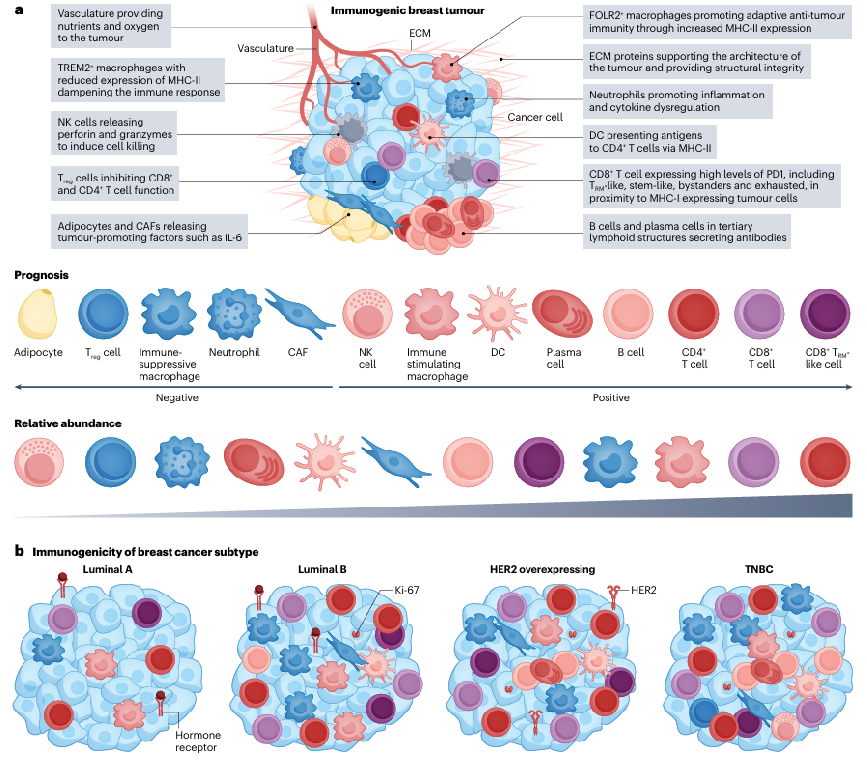 图2 免疫原性乳腺癌的肿瘤微环境和乳腺癌亚型
图2 免疫原性乳腺癌的肿瘤微环境和乳腺癌亚型
肿瘤浸润的B淋巴细胞和自然杀伤(NK)细胞
肿瘤浸润的B淋巴细胞是TNBC和HER2+乳腺癌的预后标志物,在TNBC免疫微环境中占比达到11%。这些B细胞通常聚集在TME中,部分形成三级淋巴结构(TLSs),促进抗原呈递以增强抗肿瘤免疫。成熟的TLSs与T细胞低耗竭相关,不成熟的TLSs在T细胞高耗竭的TME中更常见。NK细胞是对抗癌症的勇士,尽管NK细胞在所有乳腺癌亚型的TME中都只占相对较小的部分。然而在TNBC中发现了一种具有较低细胞毒性潜力的未成熟NK细胞亚群,它们的过多存在与较差的生存率有关,这一结果可能是过多存在的未成熟NK细胞通过促进肿瘤生长而导致的。
髓系细胞
TAMs在TME中占据重要位置,特别是在TNBC中。组织驻留巨噬细胞和招募的单核细胞来源的巨噬细胞共同组成TAM群体。与Luminal A相比,基底型、Claudin-low、Luminal B和HER2+亚型的TAM基因特征较高,并与较差的生存率相关。特定亚群的TAMs,如表达PDL1或PDL2的脂质相关巨噬细胞(LAM),在不同乳腺癌亚型中起重要作用。此外,DCs和肥大细胞也在乳腺癌TME中发挥关键作用,对抗肿瘤免疫着有显著影响。
非免疫成分
CAFs在乳腺癌TME中发挥重要作用,通过基质重塑、促进血管生成和支持癌细胞增殖来影响TME。CAF亚群在不同乳腺癌亚型中的存在和分布对免疫抑制有显著影响,其中CAF-S1亚群可以促进调节性T细胞(Treg细胞)的存活和分化,从而抑制效应T细胞。血管内皮细胞通过调节免疫细胞进入肿瘤的途径,对TME中的免疫应答也有着重要影响。抑制成纤维细胞生长因子受体的治疗可以减少CAF水平,增加T细胞浸润并增强对ICB的反应。
表1 乳腺TME中选定细胞类型的关键标志物和特征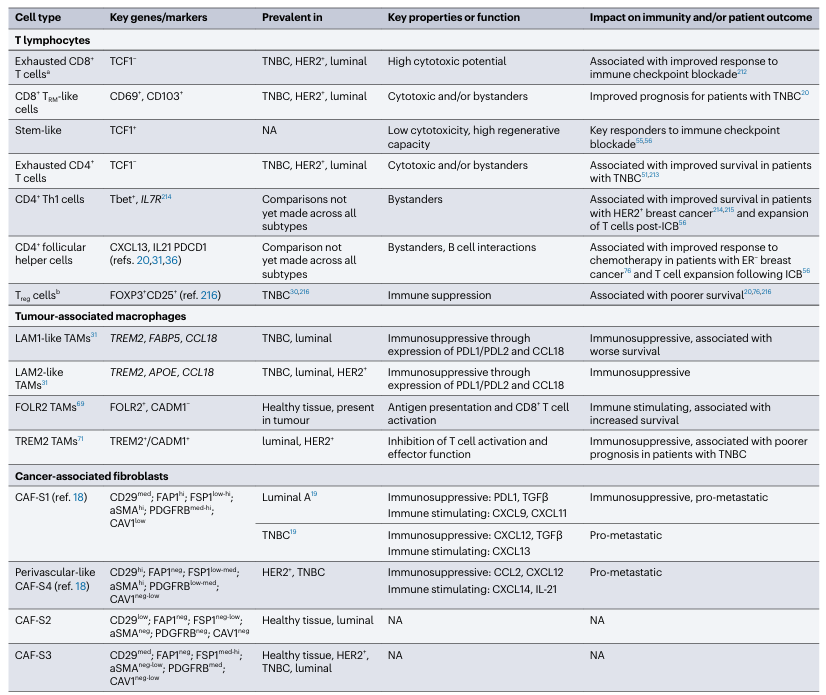
癌前病变和转移性的免疫TME
TME中的异质性不仅存在于不同肿瘤之间,还存在于病变内部,并且随着肿瘤癌前病变进展为浸润性癌而发生变化,在原发部位和转移之间也存在差异。在TNBC晚期转移阶段,PDL1用来预测患者对帕博利珠单抗的反应,是一个可靠的指标。但对于早期的TNBC,PDL1并不能作为预测治疗效果的可靠标志物。这强调了在研究TME时考虑肿瘤进展的重要性。
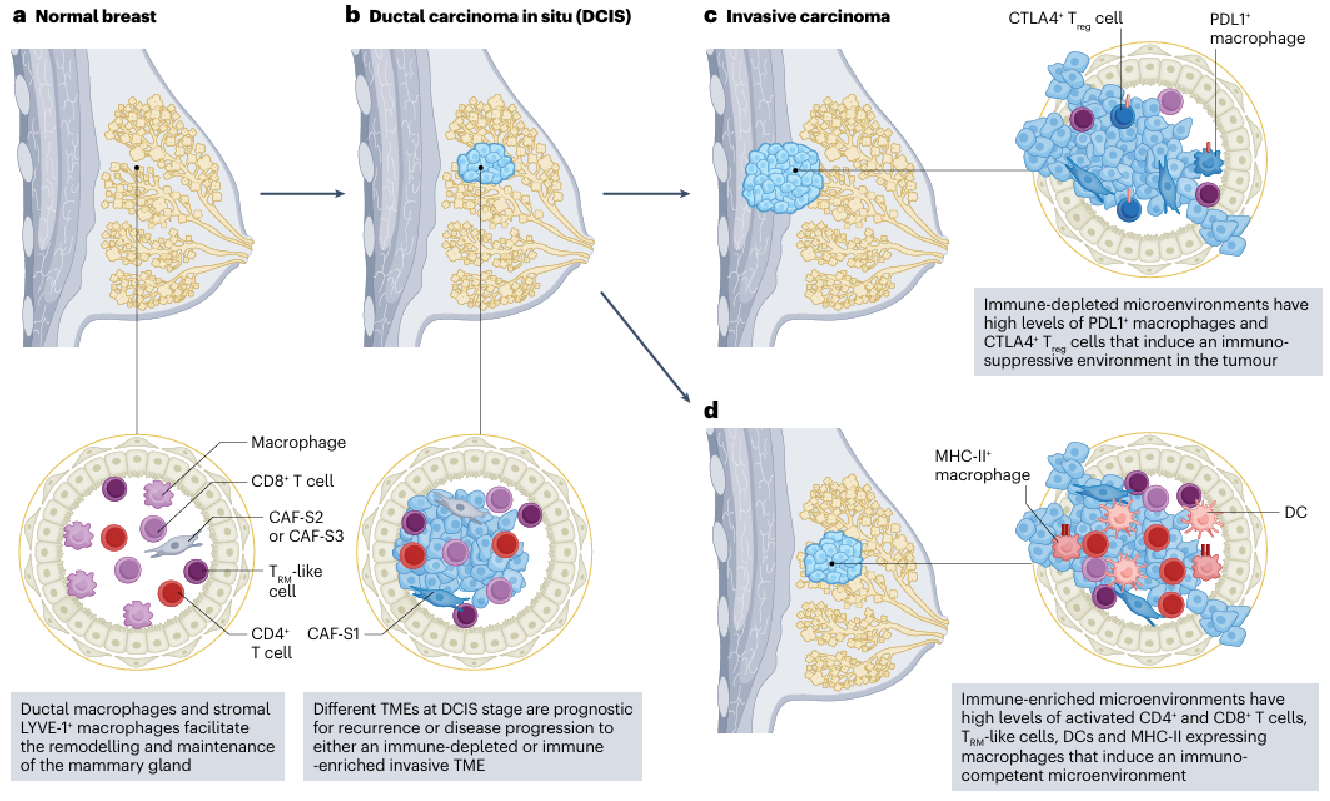 图3 乳腺癌TME从癌前病变到浸润性癌症的演变
图3 乳腺癌TME从癌前病变到浸润性癌症的演变
TME从肿瘤癌前病变到浸润性癌的变化
从正常组织到导管原位癌(DCIS)再到浸润性癌的进展过程中,TME也发生了显著变化(图1C)。DCIS间质组织主要由正常的肌成纤维细胞和CAFs组成。随着浸润性癌的发展,免疫细胞浸润的频率增加,T细胞从健康组织中的活化状态转变为DCIS中的免疫抑制状态。
对DCIS样本进行多重成像研究发现,TME与一些风险因素(如癌症的严重程度)有关联,然而这种关联并不能预测疾病后续是否会发展成浸润性癌。相比之下,多重离子束成像和RNA-seq分析的数据表明,CD4+ T细胞、髓系和浆细胞样DCs在DCIS中是复发的预测指标。在肿瘤癌前组织中,表达C-X3-C基序趋化因子受体1(CX3CR1)且具有TAM表型的细胞很少见,但在肿瘤组织中较为普遍。
原发病灶和转移病灶的TME差异
转移病灶中的TIL密度和DCs减少,而TAMs保持不变。尽管在疾病进展过程中TME发生显著变化,但DCIS中的PDL1状态与浸润性癌保持一致,PDL1的表达因转移部位不同而有所差异,淋巴结中PDL1阳性细胞最多,骨转移中最少。在淋巴结以外的转移部位的免疫模块评分降低,这可能解释了仅有淋巴结转移患者对ICB疗法反应较好的原因。
TNBC转移灶的适应性免疫特征显著减少,包括T细胞、B细胞和人类白细胞抗原(HLA),而成纤维细胞和内皮细胞特征保持相似。HLA-A的表达减少是表观遗传变化或缺失(或两者)造成的,这与免疫浸润减少和患者预后较差相关。鉴于表达减少的HLA-A肿瘤细胞不容易被传统的CD8+ T细胞杀死,HLA-A的缺失可能成为决定某些患者不适合使用ICB疗法的生物标志物。
结论与展望
TME在乳腺癌的发展、演变和治疗中至关重要,这对现有的传统癌症生物学理解提出了挑战。为开发更有效的疗法,需要关注TME的复杂性和动态变化,特别是在不同生命阶段的影响和变化。
下篇我们将介绍影响TME的宿主因素和靶向或影响免疫TME的疗法,并深入研究针对TME疗法的这一潜在策略,敬请期待。
Harris MA, Savas P, Virassamy B, et al. Towards targeting the breast cancer immune microenvironment. Nat Rev Cancer. Published online July 5, 2024. doi:10.1038/s41568-024-00714-6
排版编辑:肿瘤资讯-Jenny











 苏公网安备32059002004080号
苏公网安备32059002004080号


