黑色素瘤文献月评项目秉承传递最新医学进展的理念,以专业视角多维度关注领域最新进展。继前四期获得业内高度评价后,项目第五期与大家如期而见。本期精选了ASCO 2020重大研究进展4项和2020年5月最新发表的高质量热点研究1篇,聚焦以达拉非尼和曲美替尼为代表的BRAFi/MEKi联合免疫治疗的探索性研究成果、双靶抑制剂耐药后联合新发突变位点抑制剂疗效探索、PD-1抑制剂辅助治疗后早期复发患者的管理等内容,特别邀请解放军东部战区总医院全军肿瘤中心王锋教授为我们深入解读。

解放军东部战区总医院全军肿瘤中心
CSCO肝癌专家委员会秘书
CSCO黑色素瘤专家委员会常务委员
CSCO肿瘤心脏病学专家委员会委员
CSCO放射介入治疗专家委员会委员
CSCO青年专家委员会委员
中国抗癌协会肿瘤临床化疗专业委员会青委会委员
江苏省癌症康复与姑息治疗委员会委员
江苏省免疫学会肿瘤免疫专业委员会委员
CSCO肝癌、黑色素瘤诊疗指南执笔人
2017~2019中国临床肿瘤学黑色素瘤年度研究进展编写组组长
主要从事肝癌、黑色素瘤、肺癌等恶性肿瘤的化疗、靶向和免疫治疗,曾参加国际、国内多中心临床研究100余项
目录
1. ASCO 2020: Anti-PD-1单抗Spartalizumab联合达拉非尼和曲美替尼用于BRAF V600突变晚期黑色素瘤:III期临床试验COMBI-i第一部分和第二部分疗效及安全性数据
2. ASCO 2020: 一线Spartalizumab 联合达拉非尼和曲美替尼对晚期BRAF V600突变型黑色素瘤患者外周血免疫抑制特征和临床结果的影响
3. IMPemBra:对比帕博利珠单抗单药与间断性/短期MAPK通路双靶抑制剂联合帕博利珠单抗应用于携带BRAF V600突变黑色素瘤患者的Ⅱ期研究
4. ASCO 2020: LOGIC2 : BRFA V600突变黑色素瘤患者接受Encorafenib / Binimetinib治疗进展后联合第三种小分子靶向药物的II期多中心研究
5. PD-1抑制剂辅助治疗后早期复发黑色素瘤患者的管理
1. Anti-PD-1单抗Spartalizumab联合达拉非尼和曲美替尼用于BRAF V600突变晚期黑色素瘤:III期临床试验COMBI-i第一部分和第二部分疗效及安全性数据
研究背景:免疫检查点抑制剂和BRAF/MEK抑制剂治疗晚期黑色素瘤的多项临床研究已获得成功,然而以上两种方案的5年生存率仅为30%~50%,结果仍不能令人满意。PD-1抑制剂与达拉非尼、曲美替尼的联合方案在早期临床试验 (KEYNOTE-022; TRIDeNT)中已看到了初步疗效。近期报道的III期临床试验IMspire 150数据表明,PD-L1抑制剂(阿替利珠单抗)联合BRAF/MEK抑制剂(维莫非尼+考比替尼)较BRAF/MEK疗法疗效显著提高。
研究方法:ASCO 2020壁报(10028#)报道了大型III期临床试验COMBI-i(NCT02967692)的第一部分(安全性导入)和第二部分(生物标志物分析)汇总的疗效和安全性数据,该试验探讨了anti-PD-1 Spartalizumab (S, 代码PDR001) (400 mg Q4W) 联合达拉非尼(150 mg BID)和曲美替尼(2 mg QD)治疗初治的BRAF V600突变晚期黑色素瘤的相关疗效和安全性内容。疗效和安全性分析基于第一部分(n=9)和第二部分(n=27)共36例患者数据汇总分析,数据截止至2019年8月19日。如研究设计图(图1-2)所示,两部分入组患者均为IIIC/IV期BRAF突变未经系统治疗的不可切除/转移患者。
研究结果:Spartalizumab(S)+达拉非尼(D)+曲美替尼(T)在第一部分和第二部分入组患者中位随访时间24.3 m (20.8~29.5 m),数据截止时仍有10例患者在接受治疗。从最佳疗效数据看到(表1, 图3),客观有效率78%,疾病控制率94%;36例患者中16例完全缓解(44%),12例部分缓解(33%)。27% LDH水平升高的患者获得完全缓解。S+D+T方案有望实现快速和持续缓解,中位PFS 22.7 m (95%CI, 12m-NR) ,2年PFS率和OS率分别为41%(95%CI,23%~59%)和74%(95%CI, 56%~86%)。基线LDH水平正常(n=19)患者的PFS及OS均有更多获益,2年PFS率和OS率分别为46%(95%CI,14%~73%)和88%(95%CI, 59%~97%)(图4)。S+D+T方案的安全性方面,无新的不良反应出现,AEs谱与研究药物各自的不良反应相一致;总体来讲,S+D+T的AEs可控,多数AEs可逆,只有17%患者在接受三药联合过程中停药。本次更新的数据基于两个单臂试验,样本量较小,可能存在一定的局限性。全球、空白对照、随机分组的III期临床试验(COMBI-i 第三部分)仍在进行,期待进一步结果报道。
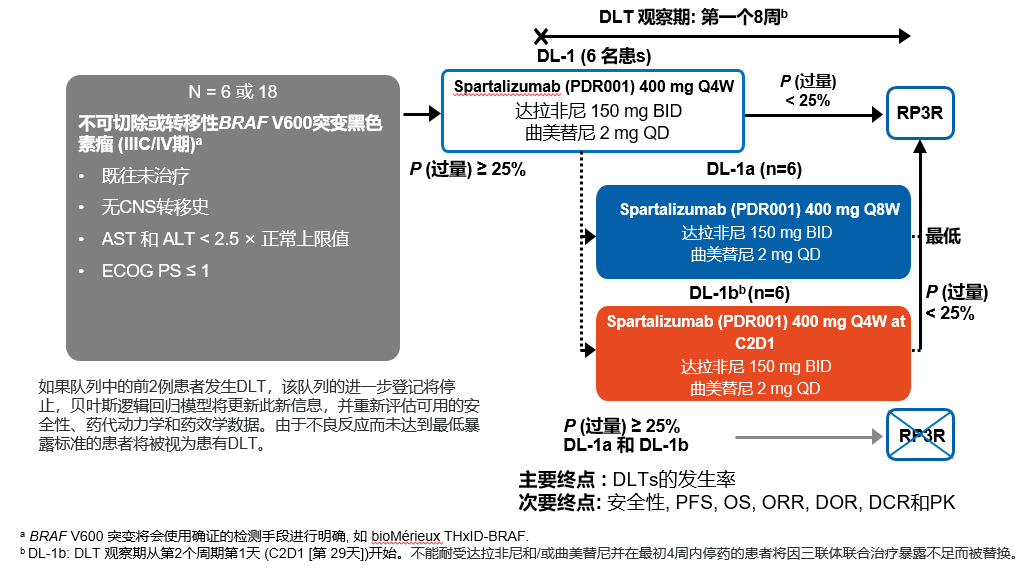
图1. COMBI-i 实验设计第一部分:安全性导入
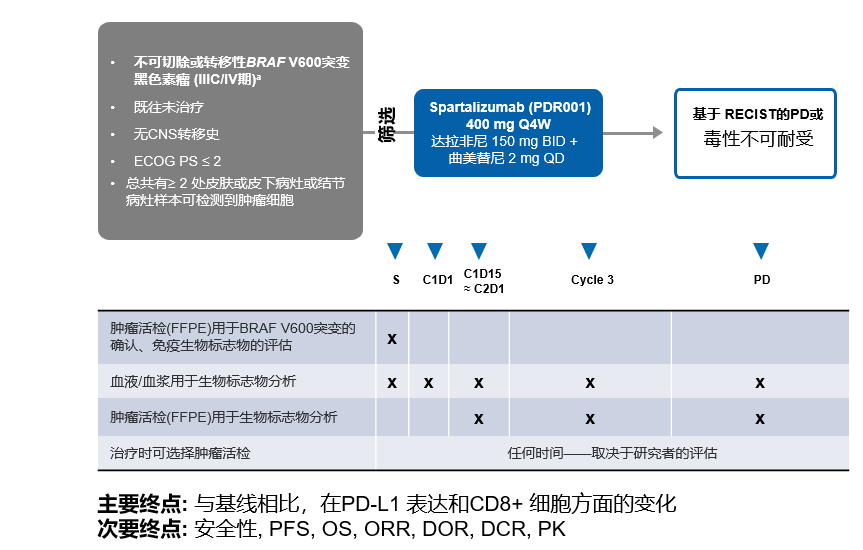
图2.COMBI-i实验设计第二部分:生物标志物分析
表1.S+D+T最佳疗效
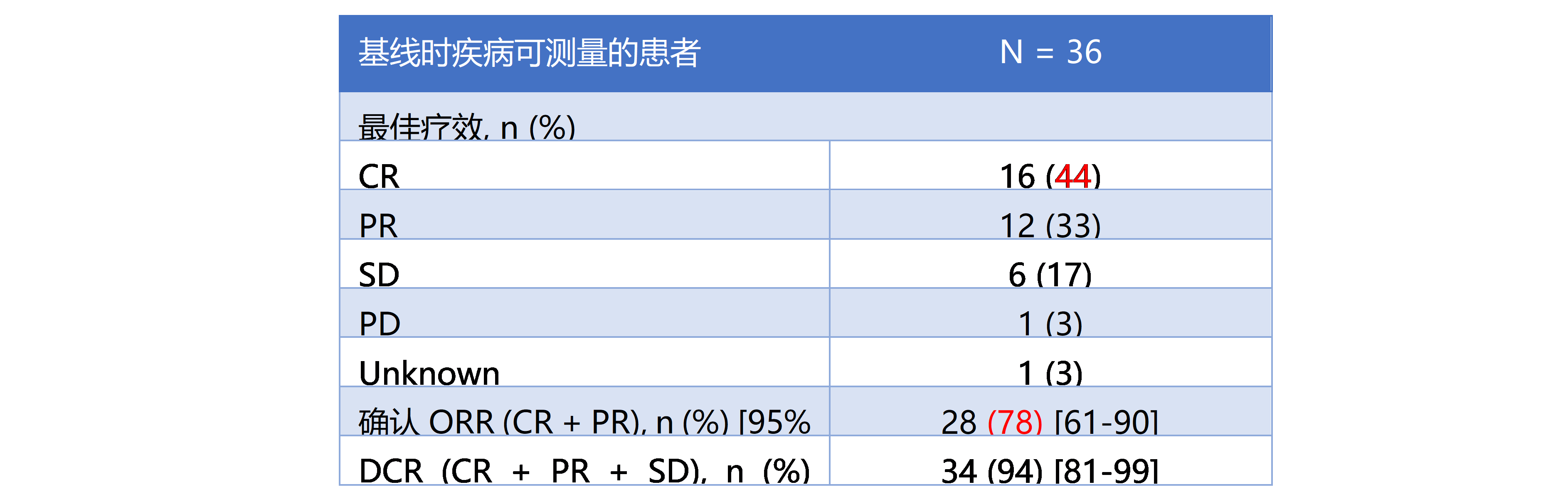
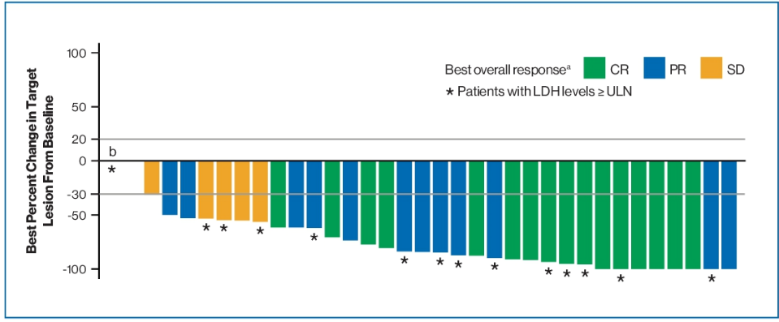
图3:S+D+T最有效率瀑布图

图4.S+D+T的PFS和OS Kaplan-Meier曲线
近年来,针对BRAF突变晚期皮肤黑色素瘤,BRAF抑制剂和/或MEK抑制剂联合免疫检查点抑制剂(ICI)的相关研究正陆续开展。理论上,靶向治疗起效迅速、深度缓解,在部分患者中长期获益显著,但仍有部分患者最终会经历耐药;而ICI单药在部分患者中疗效持久,但起效慢、缓解率低,因此,将靶向药物与ICI联合使用可能发挥疗效协同的作用,但两者联合的时机、剂量、组合方式等仍在探讨之中。另外,两者联合势必引起药物不良反应的种类增加和部分不良反应的叠加,对医生的管理经验和医院综合实力提出更高的要求。已公布的一些研究结论不一,在IMspire150和Keynote-022研究中,维莫非尼+考比替尼+阿替利珠单抗三联治疗和达拉非尼+曲美替尼+帕博利珠单抗,PFS均较对照组延长5个月左右,P值分别为0.0249和0.043,但是两项研究的主要终点设置存在差异,得出了不同的结论。而且两项研究中试验组的有效率并未优于对照组,也令人困惑不解,提示免疫联合靶向治疗的组合方式仍需要进一步探索和研究。
在2020 ASCO大会上公布的COMBI-i 研究中,共36例患者(第1部分,n=9;第2部分,n=27)中,接受达拉非尼 + 曲美替尼 + spartalizumab(PD-1抑制剂)方案治疗,ORR为78%,包括CR为44%,几乎所有患者的肿瘤病灶较基线减小≥ 50%,且D + T + spartalizumab带来持久的缓解,24个月的PFS率和OS率分别为41%和74%。这一结果令人惊喜,COMBI-i Ⅲ期临床研究结果将于2020 ESMO公布,让我们共同期待。
2. 一线Spartalizumab联合达拉非尼和曲美替尼对晚期BRAF V600突变型黑色素瘤患者外周血免疫抑制特征和临床结果的影响
背景:尽管免疫检查点抑制剂和靶向治疗在不可切除或转移性黑色素瘤患者中表现出了长生存获益,但是大多数患者随后还是会经历疾病进展。早期研究表明,在BRAF V600突变黑色素瘤患者中,PD-1抗体联合BRAF抑制剂和MEK抑制剂可以诱导高频率的快速而持久的缓解。COMBI-i是一个包含3部分的Ⅲ期临床研究,旨在评估PD-1抗体Spartalizumab+达拉非尼+曲美替尼在BRAF V600突变黑色素瘤患者中的作用。COMBI-i第1部分(安全性导入)和第2部分(生物标记物队列)的结果显示:客观缓解率为78%(36名患者中的28例),其中包括44%的完全缓解(CRs);中位无进展生存(PFS)≈2年;免疫抑制肿瘤微环境(TME)的基线值与CR缺乏和PFS较短相关。ASCO 2020壁报10034#分析了COMBI-i第1部分和第2部分注册患者的外周血生物标记物,来评估液体生物标记物是否也可以用来预测Spartalizumab+达拉非尼+曲美替尼的缓解率和临床获益。
方法:基于截止到2019年8月19日的数据,对来自COMBI-i第1部分(n=9)和第2部分(n=27)的患者人群共计36人进行了生物标记物分析(分别在基线和接受Spartalizumab+达拉非尼+曲美替尼治疗2周到4周和8周到12周及疾病进展时采集了血液和组织样本)。通过细胞因子分析和RNA测序的方式评估了36位患者的血液标记物(血浆中的细胞因子通过使用电化学发光的复合三联免疫测定进行量化,Meso Scale Diagnostics)。将组织样品制备为福尔马林固定石蜡包埋片,并从每个可用样品中共提取DNA / RNA,再提取用于RNA测序的RNA。患者基于以下标准被分为2组:(1)PFS>1年(n=24)vs <1年(n=12);(2)CR vs PR/SD/PD(无CR)
结果:对使用Spartalizumab+达拉非尼+曲美替尼的患者治疗前的血液生物标记物分析发现:高乳酸脱氢酶(LDH)水平、高中性粒细胞与淋巴细胞比(NLR)和高中性粒细胞计数与PFS<1年最具相关性;高淋巴细胞计数和血清白蛋白水平与PFS>1年最具相关性。基线时较高的LDH水平和NLR,显示出与缺乏CR呈中度趋势的相关性。通过分析患者血液样本中45种细胞因子发现基线时白介素8(IL-8)是同时与PFS和CR状态最相关的生物标记物,较低的IL-8水平与实现CR和更长的PFS相关。治疗前肿瘤活检的分析表明,与基线血液IL-8水平相关的基因表达特征(GES)包含免疫抑制信号相关例如中性粒细胞标记物(循环IL-8水平高的患者,对其肿瘤组织的基因表达信息进行RNA测序,发现具有高的中性粒细胞酶信号和中性粒细胞标记水平特征)。Spartalizumab+达拉非尼+曲美替尼治疗后,血液循环IL-8水平较基线下降。
结论:血液生物标记物分析结果,支持从COMBI-i入组患者的组织样本中获得的最新发现,证实基线时存在免疫抑制特征可能难以实现CR,且与生存预后不佳相关;该结果展示了除了LDH水平外,基线时较低的NLR与更长的PFS相关,和其他疗法所报道的一样。在基线时评估的45种血清细胞因子中,IL-8是PFS和CR的预后指标,且基线IL-8水平似乎与免疫抑制TME相关。用Spartalizumab+达拉非尼+曲美替尼治疗后,IL-8水平下降,与既往靶向药物单药治疗相关报道一致。IL-8可能会增加其他血液标记物(包括LDH和NLR)的预后价值,但需要进一步验证。

图5. 较低的基线IL-8水平与PFS>1年和有CR相关
表2.与PFS>1年相关的血液生物标记物


图6.Spartalizumab联合D+T期间IL-8水平变化
达拉非尼 + 曲美替尼 + spartalizumab治疗晚期黑色素瘤取得很好的初步疗效,但疗效预测因子仍不清楚。本项研究显示,患者LDH水平升高和NLR(中性粒细胞/淋巴细胞比值)以及中性粒细胞计数与PFS <1年最具相关性,高淋巴细胞计数和血清白蛋白水平与PFS>1年最具相关性,基线IL-8水平与更高的PFS和CR相关。另外,血液生物标记物分析证实患者在基线时存在免疫抑制特征可能难以实现CR,且与生存预后不佳相关。在基线时评估的45种血清细胞因子中,IL-8是PFS和CR的预后指标,且基线IL-8水平似乎与免疫抑制TME相关。研究结果给了我们很好的启示,未来仍需要在更大样本中进一步验证。
3. IMPemBra:对比帕博利珠单抗单药与间断性/短期MAPK通路双靶抑制剂联合帕博利珠单抗应用于携带BRAF V600突变黑色素瘤患者的Ⅱ期研究
背景:已经有多项研究在探索持续使用MAPK通路抑制剂(MAPKi)联合PD-(L)1抗体,以改善BRAF V600突变阳性黑色素瘤患者的预后。持续性联合治疗的主要困难是3-4级治疗相关不良事件(TRAE)的发生率较高(〜60%),其中许多患者需要中断治疗(〜40%)。在临床前模型中,我们曾提出短时间使用MAPKi可诱导T细胞浸润并与PD-1抑制剂协同作用。 患者短期使用MAPKi后T细胞浸润增加,但> 2周后,这种现象通常会减少。这项2b期临床试验的目的是从安全性,可行性和免疫激活能力方面证实达拉非尼(BRAFi)+曲美替尼(MEKi)的MAPKi联合帕博利珠单抗(PD-1抑制剂)的最佳持续时间。
方法:BRAF V600 E / K突变阳性的晚期初治黑色素瘤患者,开始时使用帕博利珠单抗(PEM),200mg每3周一次,并在第6周随机分组为:仅继续使用PEM(队列1)或接受间断性使用达拉非尼(D)150 mg每天2次 +曲美替尼(T )2mg每天1次,持续2 x 1周(队列2),2x2周(队列3)或连续6周(队列4)。 所有队列均继续使用PEM到2年。主要研究终点是安全性和治疗依从性。次要研究终点是对比基线时、第6、12、18周的客观缓解率(ORR,RECIST 1.1)、以及无进展生存期(PFS)。
结果:
缓解率:
第6、12、18周的总体缓解率,队列1分别为38%,62%和62%,队列2分别为25%,62%和75%,队列3分别为25%,50%和75%, 队列4分别为0%,62%和50%(图8)、队列2-4联合使用D + T第6周时,缓解率升高,完全缓解率更多。
无进展生存期:
PFS分析中将队列2-4的患者汇总与队列1的患者进行比较。在中位随访17.4个月后,接受PEM单药治疗患者的中位PFS为10.6个月,而所有使用PEM联合短期/间断性D + T治疗患者的中位PFS为27.0个月(图9)。
安全性:
在队列1、2、3和4中,分别有12%,12%,50%和62%的患者观察到3-4级TRAE。 毒性是剂量依赖性的,因为3-4 TRAE与D + T的持续时间有关。 在队列2、3和4中,分别有87%,63%和38%的患者接受了所有计划的D + T治疗。大多数患者由于发烧或肝酶升高而需要中断或终止D + T治疗。
循环肿瘤DNA:
从EDTA血浆中提取DNA,并使用Bio-Rad QX200微滴式数字PCR(ddPCR)进行突变检测,使用Bio-Rad PrimePCR ddPCR突变检测进行BRAF检测。 在第6周和第12周之间,接受D + T治疗的所有患者BRAF突变的等位基因频率均下降。 在某些患者中,帕博利珠单抗治疗6周后已出现下降。
结论:D+T+PEM三药联合的间断给药方案似乎比持续给药方案更可行,且耐受性更好,尤其是当D+T以2×1周给药模式时;早期疗效数据表明, D + T + PEM三药联合的间断给药方案可能与连续给药方案的疗效相当:短期使用D+T的患者出现D+T耐药的概率可能更低,因此当他们出现疾病进展时,可使用D+T作为二线治疗;全面的生物标记物分析正在进行中,目的是为了监测治疗导致的肿瘤和血液学改变,用来识别从PEM或者D+T+PEM间断给药模式中获益的患者:ctDNA的BRAF突变情况可以作为评估患者能从D+T+anti-PD-1联合治疗模式获益的潜在生物学指标。
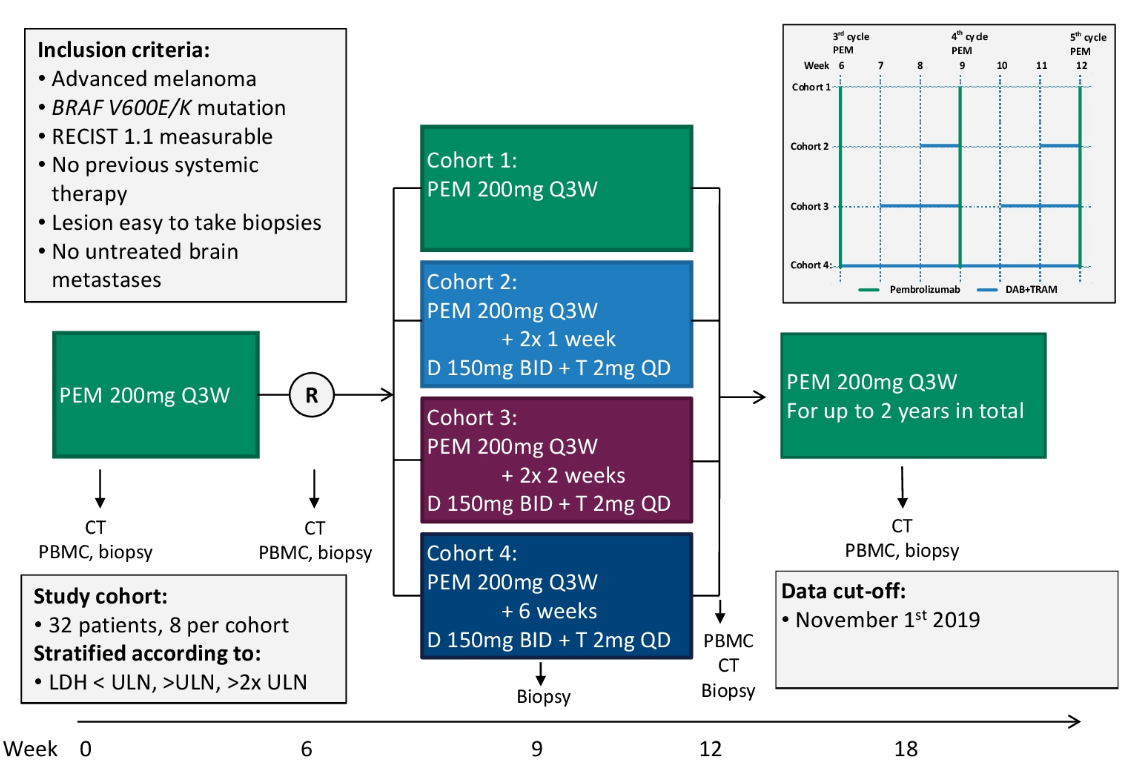
图7.IMPemBra研究设计
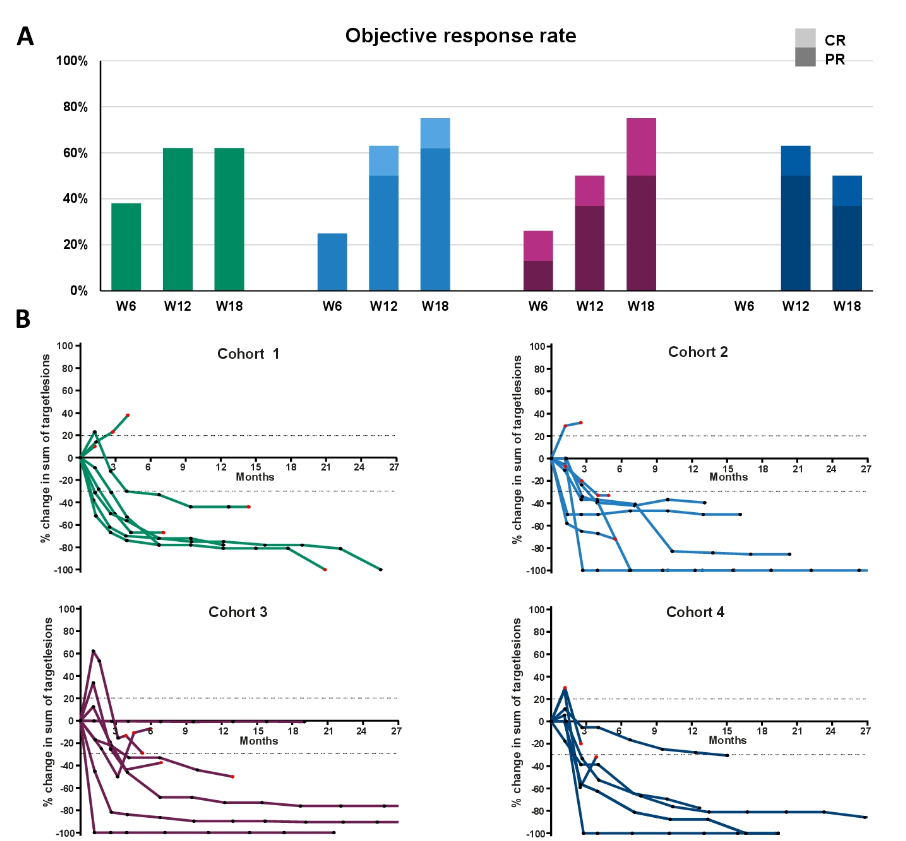
图8.每个队列在6,12和18周的客观缓解率(A)和靶病灶随时间变化的动态缓解率(B),新病灶用红色标记
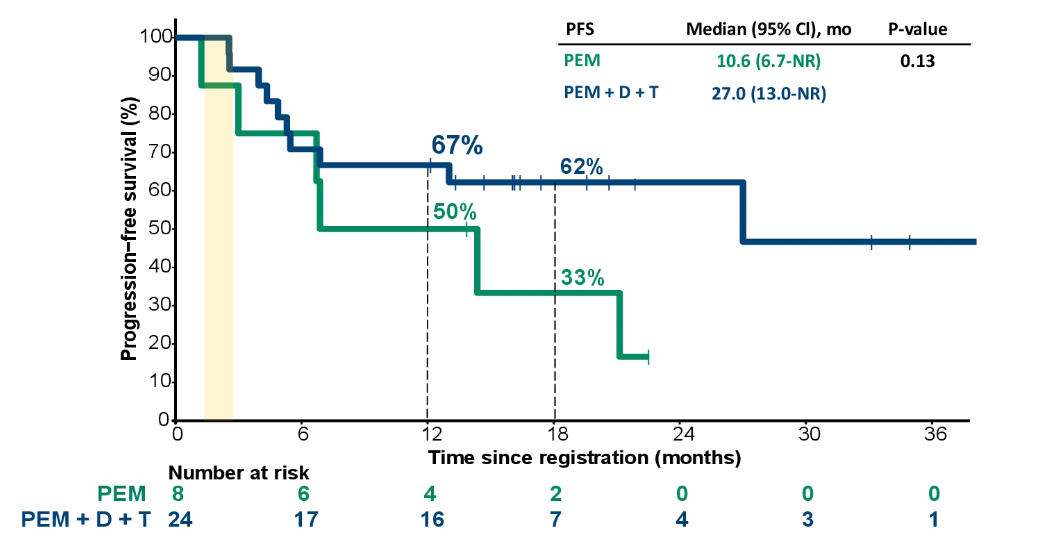
图9.PFS曲线
本项研究纳入32名BRAF V600E/K突变型晚期初治黑色素瘤患者,比较4种组合方式的疗效,帕博利珠单抗单药200 mg Q3W,6周后随机分为:队列1:帕博利珠单抗单药;队列2:达拉非尼+曲美替尼用1周,停2周,联合帕博利珠单抗; 队列3:达拉非尼+曲美替尼用2周,停1周,联合帕博利珠单抗;队列4:达拉非尼+曲美替尼连续使用,联合帕博利珠单抗。
从结果来看,在队列2、3和4中,88%、63%和38%的患者接受了所有计划的D+T治疗。第6周、第12周和第18周评估ORR:队列1中分别为38%、62%和62%,队列2中分别为25%、62%和75%,队列3中分别为25%、50%和75%,队列4中分别为0%、62%和50%。经17.4个月的中位随访,单用帕博利珠单抗治疗的患者的中位PFS为10.6个月,而PEM联合短期/间歇D+T治疗的患者的中位PFS为27.0个月(p=0.13)。研究表明,与三药联合持续用药相比,帕博利珠单抗联合D+T间歇疗法疗效相近,耐受性更好,需要更大样本研究证实。另外,黑色素瘤的新辅助治疗相关研究在国外正在进行中,大多采用PD-1抑制剂联合CTLA-4抑制剂。在本项研究中,与免疫单药治疗相比,免疫联合靶向治疗的CR率明显增加,可能成为黑色素瘤新辅助治疗新的有力武器。
4. LOGIC2 : BRFA V600突变黑色素瘤患者接受Encorafenib / Binimetinib治疗进展后联合第三种小分子靶向药物的II期多中心研究
背景: BRAF抑制剂联合MEK抑制剂与单药相比,能够显著提高BRAFV600突变的黑色素瘤患者的生存获益,但大部分患者对双靶治疗最终会产生耐药。LOGIC2研究的第二部分是一项II期,多中心的临床试验,旨在评估BRAFV600突变的黑色素瘤患者接受Enco联合Bini治疗进展后,根据肿瘤基因背景,再联合第三种靶向药物治疗的三联模式的疗效及安全性。(NCT02159066)
研究方法:LOGIC2是一项多中心,开放标签,2个部分的II期临床研究。用于评估Enco联合Bini治疗BRAFV600突变的局部晚期不可切除或转移性黑色素瘤(第1部分)的疗效及安全性以及进展后联合第三种靶向药物(第2部分)的疗效。
第1部分:
两组患者接受Enco联合Bini治疗直到肿瘤进展。A组为初治患者,B组为既往接受过其它治疗的患者。肿瘤进展后,获取进展的肿瘤组织活检并进行NGS测序,根据测序结果增加第三种靶向药物。
第2部分:
所有患者接受Enco联合Bini,并根据增加的不同靶向药物分为以下四组:A组:Ribociclib (LEE011 [LEE]),口服的CDK4/6抑制剂;B组:Buparlisib (BKM120 [BKM]),有效的口服泛I类PI3K抑制剂;C组:Capmatinib (INC280 [INC]),c-MET受体酪氨酸激酶的小分子可逆的ATP竞争性抑制剂;D组:Infigratinib (BGJ398 [BGJ]),口服的FGFR1-3激酶选择性ATP竞争性抑制剂;所有患者根据NGS测序结果匹配四种靶向药物,如果没有发现相关基因改变,则由研究者评估后分配至最适当的治疗组。
主要研究终点:
为评估Enco联合Bini进展后使用三联治疗的抗肿瘤活性。
次要研究终点:
为评估第三种靶向药的最大耐受剂量,安全性,抗肿瘤活性,药代药动学,肿瘤组织在研究第二部分起始以及进展的基因组学改变。
结果:本研究第2部分入组58例患者,其中A组38例,B组6例,C组13例,D组1例。其中29例根据Enco联合Bini进展后肿瘤组织活检的NGS测序结果匹配入组,其余29例为研究者评估后分配入组。第1部分的初治患者接受双靶治疗的ORR为73.3%,非初治患者ORR为24.1%。第2部分的A,B,C组的ORR分别为2.6%,0%和0%。DCR分别为26.3%,16.7%和15.4%。安全性与既往已知的第三种靶向药物的安全性一致。
结论: BRAF抑制剂联合MEK抑制剂治疗后出现的新型基因改变,包括新发突变,缺失和扩增,被认为是双靶治疗耐药的可能机制。 接受Enco/Bini治疗进展后,根据基因突变状态选择联合第三种小分子靶向药物的三联治疗模式是可行的,然而临床观察到的疗效有限。未来更多的关于双靶耐药机制以及新增药物对于其它信号通路影响的机制研究,有望更好的帮助提高第三种新增药物的疗效。
表3.第2部分研究患者的基因背景改变

表4.第2部分研究的客观反应率(Enco/Bini治疗进展后)

表5.BRAF/MEK抑制剂治疗进展后新发突变

本项研究探索BRAF突变黑色素瘤接受encorafenib / binimetinib双靶联合方案出现进展后,根据再次活检标本的基因改变,选择加予第3种靶向药物的疗效和安全性,但从研究结果来看,疗效并不令人满意,提示双靶联合方案耐药机制的复杂性。未来需要研究靶向药物耐药后肿瘤异质性的变化,不同分子变异在肿瘤发展过程中的权重,以及肿瘤微环境的改变对肿瘤的影响。
5. PD-1抑制剂辅助治疗后早期复发黑色素瘤患者的管理
背景:抗 PD-1抑制剂可延长高危可切除黑色素瘤的无复发生存,然而,大约25%~30%的患者在一年内复发。本研究描述了辅助使用PD-1抑制剂治疗后复发患者的复发模式、治疗和结局。
患者人群和研究方法:患者人群来自16 个研究中心手术切除后的 III/IV 期黑色素瘤患者,且接受PD-1抑制剂辅助治疗后复发。回顾了患者复发特征、治疗和结局;粘膜黑色素瘤患者单独分析。
研究结果:在接受辅助PD-1抑制剂治疗的 850 例患者中有 147 例 (17%) 发生黑色素瘤复发。在皮肤黑色素瘤患者中 (n = 136),中位复发时间为 4.6 个月(范围 0.3-35.7);104 例 (76%) 在接受辅助PD-1抑制剂治疗期间复发(ON:包括治疗中和停止治疗后一个月内),中位时间为 3.2 个月,32 例 (24%) 在治疗终止后复发(OFF),中位时间12.5 个月,其中 21 例 (15%) 因毒性提前终止治疗。复发患者中59 例 (43%)首次复发表现为局部区域疾病复发,77 例 (57%)表现为伴远处转移。局部复发患者中,22/59 (37%) 随后远处转移。89 例 (65%) 患者复发后接受全身治疗。在接受辅助治疗中(ON)复发的患者,PD-1 单药治疗无一例 (0/6) 缓解;伊匹木单抗(单药或联合 PD-1)治疗 8/33 例可评价患者 (24%) 缓解,BRAF/MEK 抑制剂治疗 18/23 例 (78%) 缓解。在辅助治疗终止后( OFF)复发的患者中,2/5 (40%) 对 PD-1抑制剂治疗有反应,2/5 (40%) 对基于伊匹木单抗的治疗有反应,9/10 (90%) 对 BRAF/MEK 抑制剂有反应。
结论:尽管接受PD-1抑制剂辅助治疗,大多数早期复发的患者主要表现为远处转移。在接受PD-1抑制剂治疗期复发(ON)的患者中,进一步 PD-1 单药治疗的活性极小,但伊匹木单抗(单药或与 PD-1 联合)以及BRAF/MEK 抑制剂具有临床获益。PD-1抑制剂再治疗可能对PD-1辅助治疗终止后(OFF)复发患者有效。
拓展解读
对于伴BRAFV600突变 III期可切除的黑色素瘤术后辅助治疗,中国唯一且仅有一个获批的药物是达拉非尼联合曲美替尼。
今年ASCO大会上双靶辅助治疗COMBI-AD研究更新了5年的随访数据,此项分析是迄今为止关于BRAF V600突变的Ⅲ期黑色素瘤患者接受标准辅助治疗的3期临床研究中随访时间最长的,达拉非尼+曲美替尼带来长期的RFS(5年RFS>50%),且治疗组RFS曲线长期随访均趋于平稳,而且在所有AJCC 7 Ⅲ期亚组患者中,均可带来一致的RFS获益,结果提示使用达拉非尼+曲美替尼联合治疗12个月可为BRAF V600突变的Ⅲ期黑色素瘤患者带来长期生存获益。
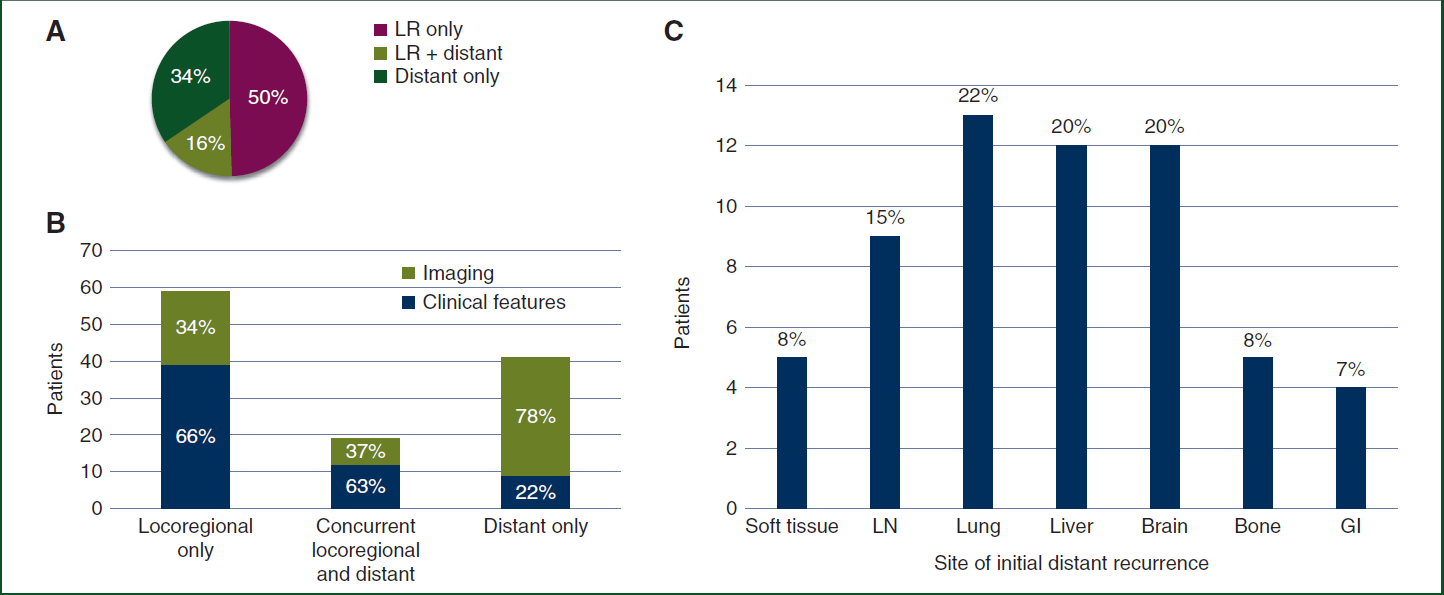
图10.(A)119名Ⅲ期皮肤黑色素瘤孵化患者的复发模式分析,60例(50.4%)首次复发表现为伴为伴远转移;(B)Ⅲ期皮肤黑色素患者不同复发模式后疾病表现形式;(C)复发伴远处转移患者的转移病灶分析,显示伴远处转移的患者N=60,其中脑转移占20%
表6.不同治疗方法对108例复发后不可切除患者的疗效
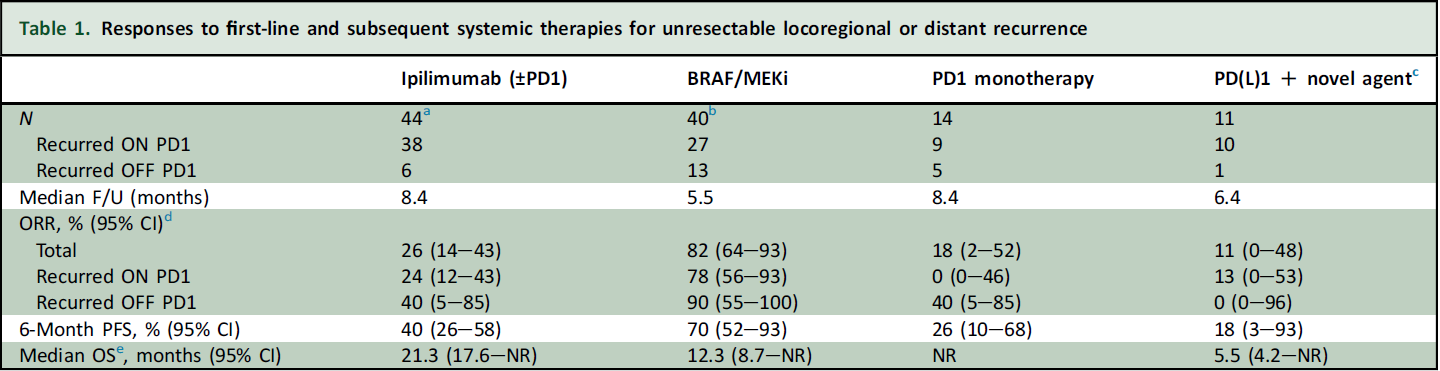
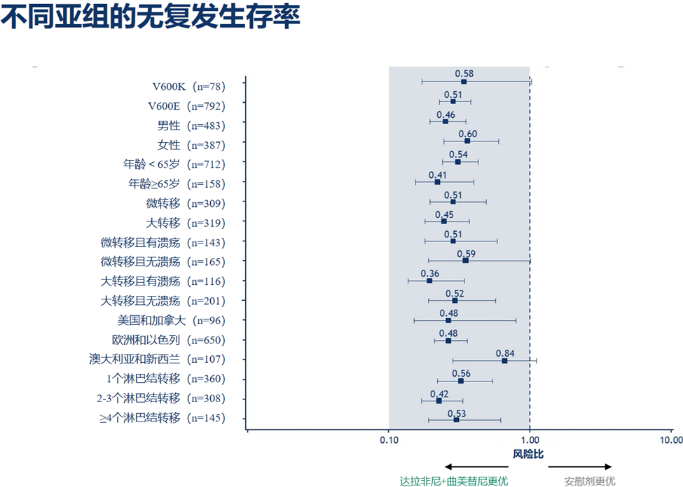
图11.COMB-AD 亚组分析
BRAF抑制剂、免疫药物治疗晚期黑色素瘤在疗效和生存期上远超传统的化疗,推动两类药物向术后辅助治疗进军,并在多项研究(CheckMate238、KEYNOTE-054、BRIM-8、COMBI-AD)中证实对无复发生存的明显改善,已获得国内外指南的一致推荐。但是接受PD-1单抗辅助治疗的患者,第1年复发的比率约25%~30%,此研究为不同模式下复发患者的后续管理有重要参考意义。
另外,此次大会上报告了COMBI-AD研究5年分析的数据,并成为大会为数不多的口头报告之一,吸引众多目光。迄今为止,在关于BRAF V600突变的Ⅲ期黑色素瘤患者接受标准辅助治疗的3期临床研究中,这是随访时间最长的。研究结果显示达拉非尼+曲美替尼带来长期的RFS(5年RFS>50%),且治疗组的RFS曲线均趋于平稳。在所有Ⅲ期亚组中,均可带来一致的RFS获益。上述结果提示使用达拉非尼+曲美替尼联合治疗12个月可为BRAF V600突变的Ⅲ期黑色素瘤患者带来无复发生存的明显获益,期待未来报道的最终OS结果。
[1]. The anti-PD-1 antibody spartalizumab in combination with dabrafenib and trametinib in advanced BRAF V600-mutant melanoma: efficacy and safety findings from parts 1 and 2 of the phase III COMBI-i trial. ASCO 2020 poster #10028
[2]. Effect of first-line spartalizumab + dabrafenib + trametinib on immunosuppressive features detected in peripheral blood and clinical outcome in patients with advanced BRAF V600-mutant melanoma. ASCO 2020 poster #10034
[3]. The IMPemBra trial, a phase II study comparing PEMBRO with intermittent/short‐term dual MAPK pathway inhibition plus PEMBRO in melanoma patients harbouring the BRAFV600 mutation. ASCO 2020 poster #10021
[4]. A phase II, multicenter study of encorafenib/binimetinib followed by a rational triple-combination after progression in patients with advanced BRAF V600-mutated melanoma (LOGIC2). . ASCO 2020 poster #10022
[5]. Management of early melanoma recurrence despite adjuvant anti-PD-1 antibody therapy. Annals of Oncology, 2020, in press. doi.org/10.1016/j.annonc.2020.04.471
MCC号TFM20063004有效期2021-06-17,资料过期,视同作废。
责任编辑:肿瘤资讯-Nathan
排版编辑:肿瘤资讯-Vincent
精彩回顾
黑色素瘤文献月评 | 第一期 BRAF突变转移性黑色素瘤的最佳治疗方案决策
黑色素瘤文献月评 | 第二期 BRAFi+MEKi调节免疫微环境机制提供双靶治疗长期缓解理论基础
黑色素瘤文献月评 | 第三期 日本真实世界数据验证达拉非尼联合曲美替尼为东亚患者带来显著治疗获益
黑色素瘤文献月评 | 第四期 达拉非尼+曲美替尼持续给药较间断给药为患者带来更长的无进展生存
版权声明















 苏公网安备32059002004080号
苏公网安备32059002004080号


