2019年已近尾声,新的一年即将到来。回顾过去的一年中,骨与软组织肉瘤(STS)治疗领域取得一系列重磅进展。为了及时向国内肿瘤专家们传递这一年中骨与软组织肉瘤领域的最新研究成果,正大天晴药业集团股份有限公司于2019年11月09日至2019年12月21日在全国多地举办“包罗万象,刚柔并济——骨与软组织肉瘤热点速递”大会。【肿瘤资讯】特将会议内容精编如下,以饕读者。
多地开启,众咖云集,看点十足!
肉瘤是肿瘤中的“小众肿瘤”,尽管发病率低,但类型众多,异质性强,需要依靠综合治疗模式。“包罗万象,刚柔并济——骨与软组织肉瘤热点速递”大会聚集全国知名领域专家,就肉瘤化疗、靶向治疗和免疫治疗三方面的最新热点资讯进行汇总梳理,让国内学者能更快速地了解最新的骨与软组织肉瘤研究进展。为更广泛地覆盖国内肉瘤领域医生,此系列大会分别在郑州、成都、北京、上海、杭州、武汉、长沙、西安、哈尔滨等多个城市举办,并邀请国内非常著名的肉瘤领域专家如蔡启卿、李建民、胡侦明、屠重棋、牛晓辉、董扬、叶招明、陈静、房永宏、李先安、王臻、曲国蕃等教授(按会议召开时间顺序)担任大会主席,以及多位全国肉瘤领域知名专家对骨与软组织肉瘤精彩会议内容进行分享与解读,共同探讨最新的临床治疗研究进展对中国临床实践的影响和启示。
一、化疗与免疫—琴瑟和鸣
化疗和免疫治疗是当今恶性肿瘤的两大治疗手段。如果说,历经70余年的化疗堪称“经典”手段,那么从发现人类肿瘤抗原,到各种免疫治疗用于临床只有短短10年时间,实为肿瘤治疗“新贵”。无论是“传统”还是“新贵”,提高肿瘤患者疗效仍是学者们追逐的目标。
1.传统化疗
(1)高风险STS的药物选择
高风险STS起病时多无法手术,需行新辅助化疗。化疗方案以异环磷酰胺(ifosfamide, IFO)和阿霉素(adriamycin,DOX)为主。STS亚型众多,有些亚型对IFO+DOX化疗方案不敏感。针对具体的不同亚型,如果采用个体化的治疗方案而非标准的化疗方案,能否带来生存获益?西班牙、法国等多国协作组比较了IFO+epiADM的标准治疗组和基于病理亚型的个体化治疗组对STS无病生存(DFS)和总生存(OS)的影响。研究随机入组287例患者,病理亚型包括未分化多形性肉瘤(UPS)、黏液样脂肪肉瘤(LPS)、滑膜肉瘤(SS)等。中位随访时间为45.44个月。生存分析显示,在低风险组,两组疗效无显著差异;在高风险组,标准化疗组OS优于基于病理亚型的个体化治疗组(图1)。该研究结果与前两次意大利肉瘤协作组(ISG)试验的结论一致,对于高风险、肢体/躯干的STS,应继续执行基于DOX的新辅助化疗方案,而对于新辅助化疗中使用标准或基于病理亚型的个体化方案并未给出最终结论。
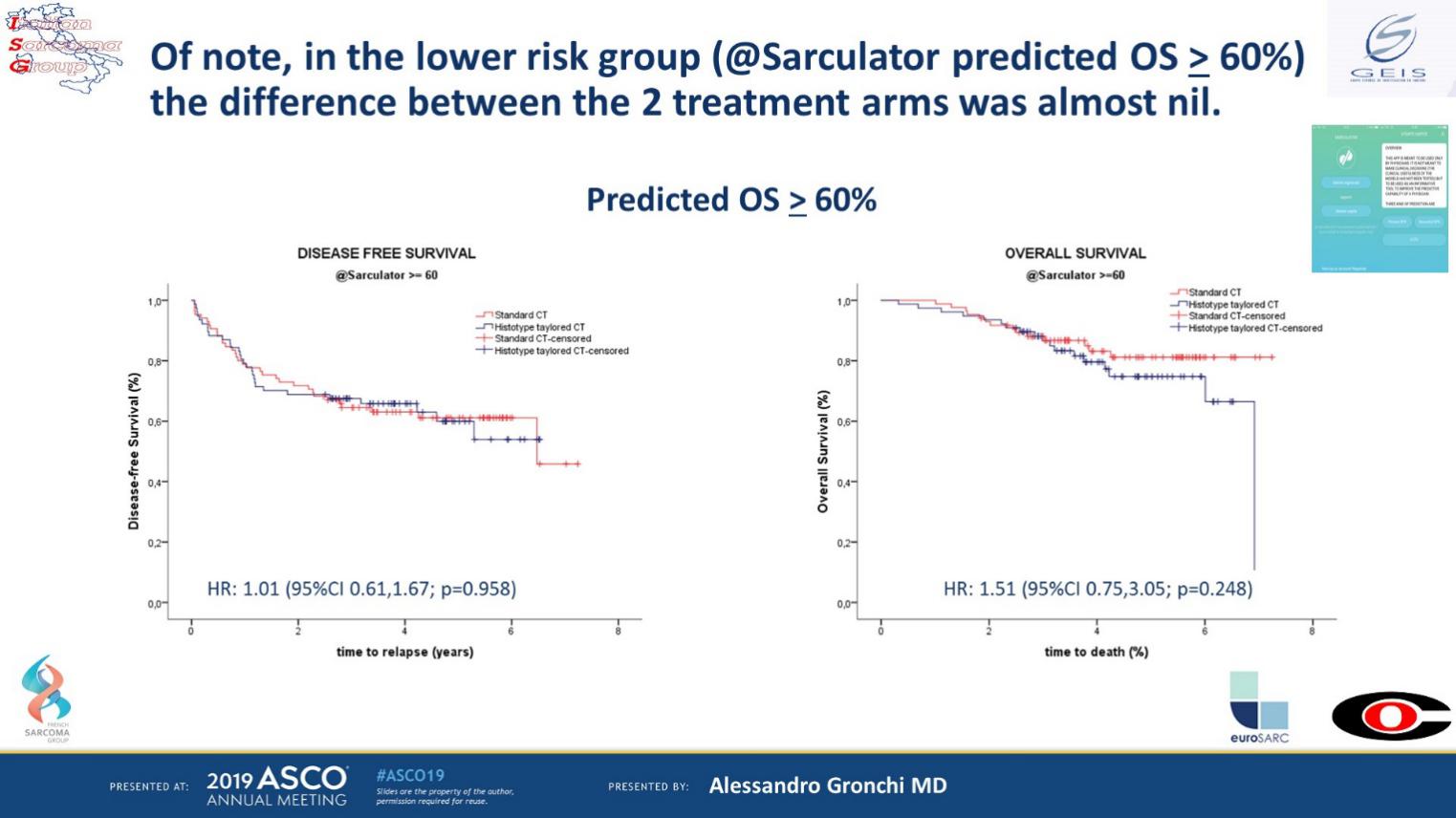
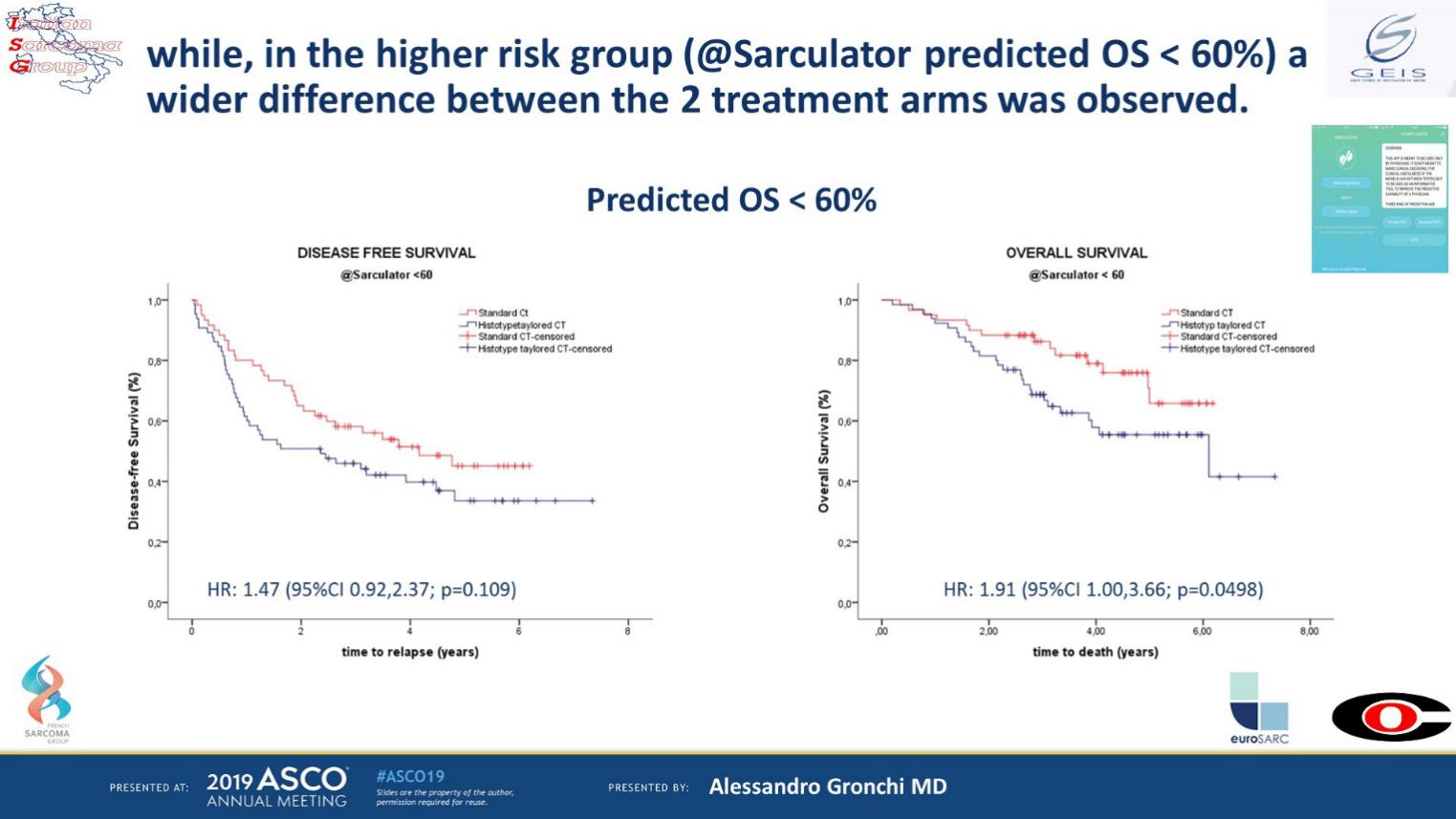
图1 在低风险STS中,两组无显著性差异;在高风险STS中,标准化疗组的OS优于基于病理亚型化疗组
(2) 真实世界研究中的艾日布林
艾日布林(eribulin)是作用于微管蛋白、抗有丝分裂的细胞毒药物。本次欧洲肿瘤内科学会(ESMO)公布的研究探讨了艾日布林在少见亚型(非L型肉瘤)中的疗效和安全性。该项在日本人群中开展的研究共入组256例患者。1年中期结果显示,艾日布林不仅可用于平滑肌肉瘤(LMS)和平滑肌肉瘤(LPS),对非L型肉瘤亚型(如未分化多形性肉瘤[UPS]、血管肉瘤[AS]等)也均有一定的疗效,OS为10.8个月,ORR为8.1%。安全性方面,85.9%的患者发生不良事件(83.5%与治疗相关),70.6%的患者发生3级或3级以上不良事件。从以上数据来看,艾日布林不仅可以用于平滑肌肉瘤和LPS患者,对其他少见亚型的患者也有疗效。
(3) 曲贝替定联合放疗治疗STS
曲贝替定(trabectedin)是一种新的非铂类细胞凋亡诱导剂,可同时作用于肿瘤细胞和肿瘤微环境。对于转移性的进展期STS患者,在至少接受过1次蒽环类化疗后选择曲贝替定联合低剂量放疗,疗效如何?来自西班牙、法国、意大利肉瘤协作组的Ⅱ期临床试验探讨了曲贝替定联合低剂量放疗治疗转移性STS的疗效。前期研究结果显示曲贝替定单药客观反应率(ORR)为13.7%,PFS为3.12个月,LPS的PFS为5.13个月。曲贝替定联合放疗治疗STS的PFS率为75%,结果表明曲贝替定联合放疗在多种STS中显示出良好活性,其中1例滑膜肉瘤患者在接受曲贝替定联合放疗的治疗后,肺转移瘤明显缩小(图2)。
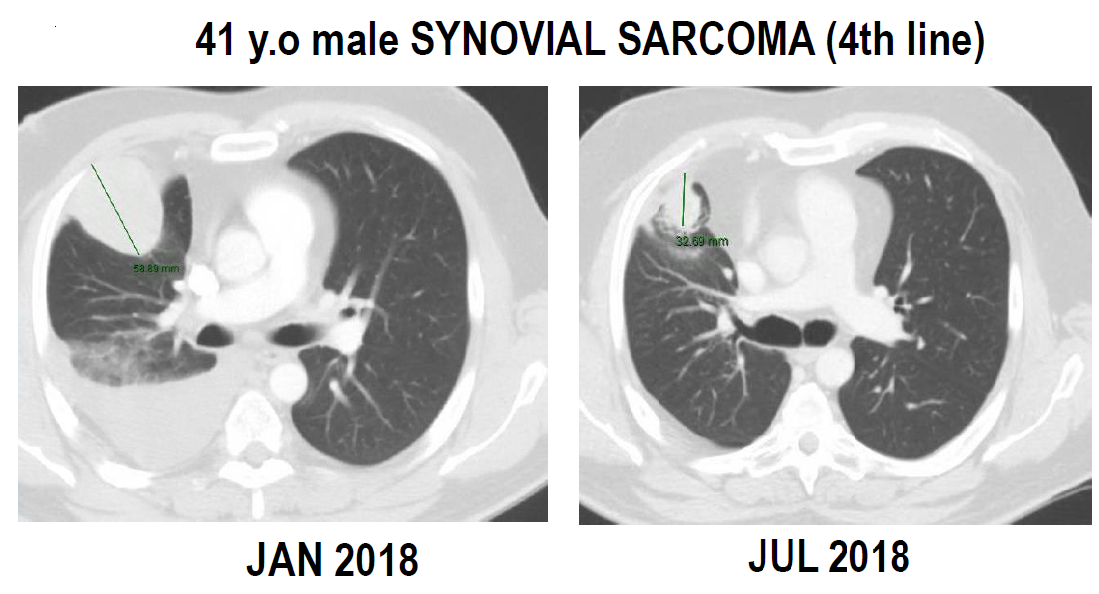
图2 曲贝替定联合放疗对滑膜肉瘤患者疗效(长径由58.89mm减小到32.69mm)
2.“新贵”免疫治疗进展
尽管传统化疗对STS疗效有一定提高,但始终未达到理想水平。免疫治疗作为研究热点,研究者们一直寻求其在STS上的突破。
(1)从免疫角度看肉瘤
众所周知,UPS是一类分化差、异质性强的肿瘤。2019年ESMO报道的一项研究拟从组学方法和免疫表型角度分析UPS的免疫特征对UPS进行描述和分类,以便寻找可能的靶向治疗方法。研究对25例初治高级别UPS患者进行分析,基因组测序发现,突变负荷> 5mut/MB的患者均为高免疫型,≤5mut/MB为低免疫型。另外,CD8细胞RNA测序结果与免疫组化检测结果高度相关,进一步RT-PCR和Western-blot结果显示低免疫型FGFR2高表达。蛋白质组化研究显示低免疫组上皮间质转化相关通路的相关蛋白和MYC癌基因相关靶蛋白高表达。2019ESMO的另外一项研究探索了软组织肉瘤免疫学分类与疗效预测的关系,主要按免疫浸润程度将213例患者从极低到高分为5类,免疫浸润极低的患者OS明显差于较高免疫浸润、高免疫浸润组(图3),再次证明了免疫检查点抑制剂的疗效与浸润和活性免疫细胞及免疫相关因子有关,有助于为接受免疫检查点抑制剂的患者提供依据。
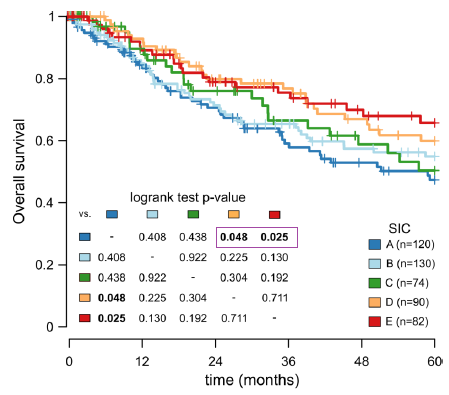
图3 极低免疫组(A组)OS显著低于较高免疫组(D组)和高免疫组(E组)
(2)免疫治疗在STS患者中的探索
免疫检查点抑制剂或使部分高免疫浸润肉瘤患者获益。有研究(SARC028扩大试验)在原SARC028(UPS 10例,LPS 10例)基础上,UPS和LPS各增加入组30例,探索帕博利珠单抗单药(pembrolizumab,P)治疗晚期STS的疗效,入组人群为年龄≥18岁的晚期难治性STS患者。结果显示,帕博利珠单抗安全性好;UPS患者的ORR为23%,达到主要研究终点;LPS患者的ORR为10%,未达到主要研究终点;UPS和LPS两组的中位PFS分别为12周和8周,中位OS分别为13周和12周(图4)。对有治疗响应的患者进一步分析发现75%的UPS患者PD-L1表达阳性,而2/8例UPS和3/3例LPS患者PD-L1表达阴性。该研究提示,UPS属于一种未分化肉瘤,在后续免疫治疗中仍需要寻找生物标志物;黏液纤维肉瘤在性质上类似UPS,可以尝试免疫治疗。
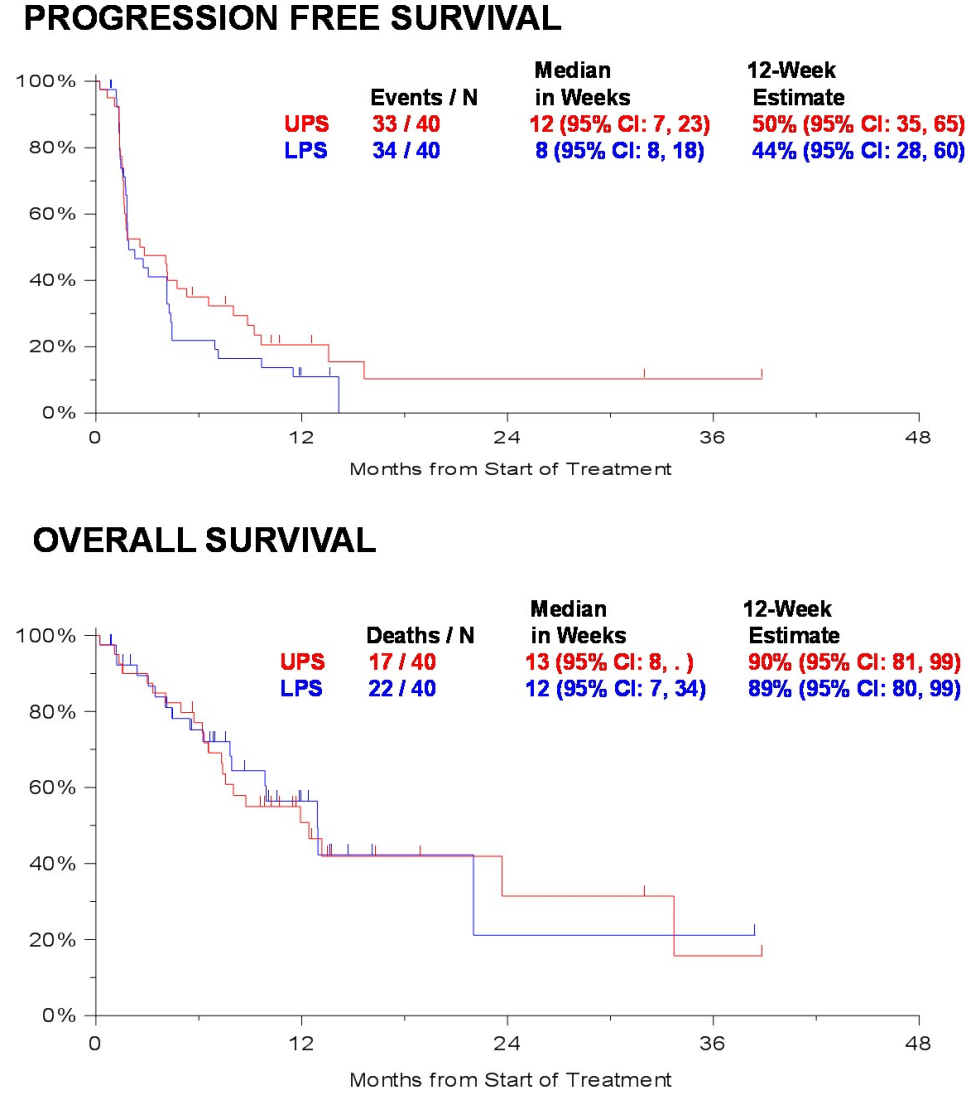
图4 帕博利珠单抗对UPS和LPS的生存分析
(3)TCR-T疗法—ADP-A2M4 T细胞疗法治疗滑膜肉瘤
TCR-T疗法的原理为通过转导嵌合抗原受体或TCRα/β异二聚体来提高TCR(T细胞抗原受体)特异性识别肿瘤相关抗原(TAA)的亲和力。ADP-A2M4(MAGE A4) SPEAR T细胞疗法是表达识别人类白细胞抗原-A2限制性肽MAGE-A4230-239的TCR,在临床试验中治疗滑膜肉瘤取得了良好的治疗响应。从目前的数据看,治疗具有较长的持续响应时间(图5),但样本量较小,还需进一步验证。
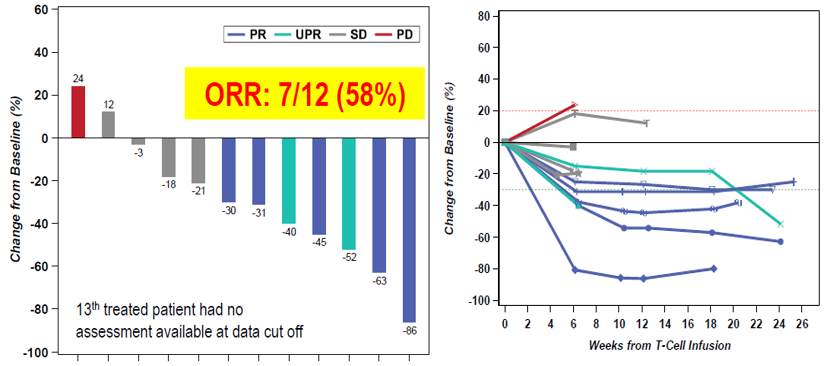
图5 ADP-A2M4 T 细胞疗法治疗滑膜肉瘤具有较长的持续响应时间
3. 传统与“新贵”联合
传统与“新贵”这两种治疗方法各有千秋,若将两者结合,理论上认为细胞毒药物可提高免疫检查点阻断后的反应率。那么,真实世界中,两者的结合会擦出怎样的火花?
2019年美国临床肿瘤学会(ASCO)会议公布的帕博利珠单抗+多柔比星治疗转移/不可切除肉瘤的I/II期研究表明DOX+Pem治疗耐受性良好,与历史对照组相比,可显著改善PFS。这与其他肿瘤(如头颈部肿瘤)的发现是一致的。I期研究确定DOX剂量为75mg/m2。令人遗憾的是,这项研究未能达到主要研究终点(目标客观缓解率29%)。该研究表明DOX+Pem改善了肉瘤患者的临床结局,但未显著提高缓解率,可能与入组亚型的选择具有相关性。
二、刚柔并济,靶向治疗研究进展
如果说化疗药因作用于全身多器官,被喻为“钢铁大炮”,那么针对肿瘤突变靶点的靶向药,可称为“绕指柔”。STS领域具有代表性的靶向药物有奥拉单抗(olaratumab)﹑培唑帕尼(pazopanib)﹑EZH2抑制剂tazemetostat以及中国自主研发的安罗替尼(anlotinib)等。
(1) 奥拉单抗一线治疗晚期STS的研究
奥拉单抗是针对PDGFRα靶向药。2019年ASCO会议上公布的随机、双盲、安慰剂对照的3期研究旨在探讨比较奥拉单抗 +阿霉素与阿霉素+安慰剂一线治疗晚期STS的疗效及安全性,主要终点是OS。总体而言,奥拉单抗组和安慰剂组的OS分别为20.4个月和19.7个月,该研究结果未显示出奥拉单抗疗效的优越性。III期研究结果与II期差异较大原因归结于可能与研究设计不同、肉瘤的多样性等因素有关。
(2)培唑帕尼一线用于不适合化疗的晚期STS的研究
培唑帕尼是一种小分子抗血管生成抑制剂,靶向作用于血管内皮生长因子受体(VEGFR),通过抑制对肿瘤供血的新血管生成而起作用。该研究共入组56名不适合化疗的患者,中位年龄为78.7岁,主要研究终点为16周的临床获益率(CBR)。结果显示,16周的临床获益率为38%。该研究达到了主要研究终点(35%),不适合化疗的晚期STS患者可从培唑帕尼一线治疗中获益(图6);同时未发现新的不良事件,III-IV级最常见不良反应仍然为高血压和肝功能异常。
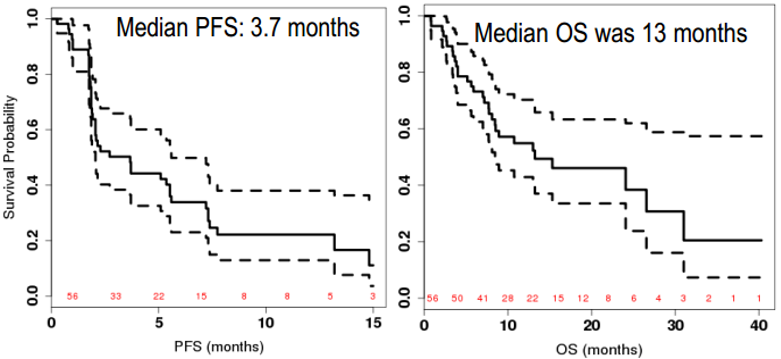
图6 培唑帕尼一线用于不适合化疗的晚期STS
(3)安罗替尼治疗晚期STS的研究(anlotinib vs placebo)
安罗替尼是我国自主研发的一个新型小分子多靶点酪氨酸激酶抑制剂(TKI),属“中国制造”。2018年ASCO会议公布的安罗替尼IIB期研究纳入多种亚型共233例患者,均至少接受过1程蒽环类化疗且出现治疗后病情进展(腺泡状软组织肉瘤、透明细胞肉瘤除外)。主要研究终点PFS。与安慰剂组相比,安罗替尼组显著延长PFS 4.8个月,疾病进展风险降低67%(图8)。亚型分析结果显示安罗替尼显著延长滑膜肉瘤、平滑肌肉瘤、腺泡状软组织肉瘤等多种亚型的PFS(图7)。2019年ESMO公布了安罗替尼在晚期平滑肌肉瘤和腺泡状软组织肉瘤的疗效和安全性。对于平滑肌肉瘤而言,安罗替尼显著延长了PFS(5.83 vs 1.43个月,P<0.0001),提高了患者的疾病控制率(DCR;62.96% vs 7.14%,P=0.001)。安罗替尼组大于15%发生率的不良事件主要为高血压、促甲状腺激素升高和手足皮肤反应;对于腺泡状软组织肉瘤,安罗替尼组的中位PFS为18.23个月,与安慰剂组相比延长了15.23个月(P<0.0001)。从现有的数据来看,安罗替尼无论处在1线或≥2线治疗均可使腺泡状软组织肉瘤患者获益,ORR和DCR高于安慰剂组。
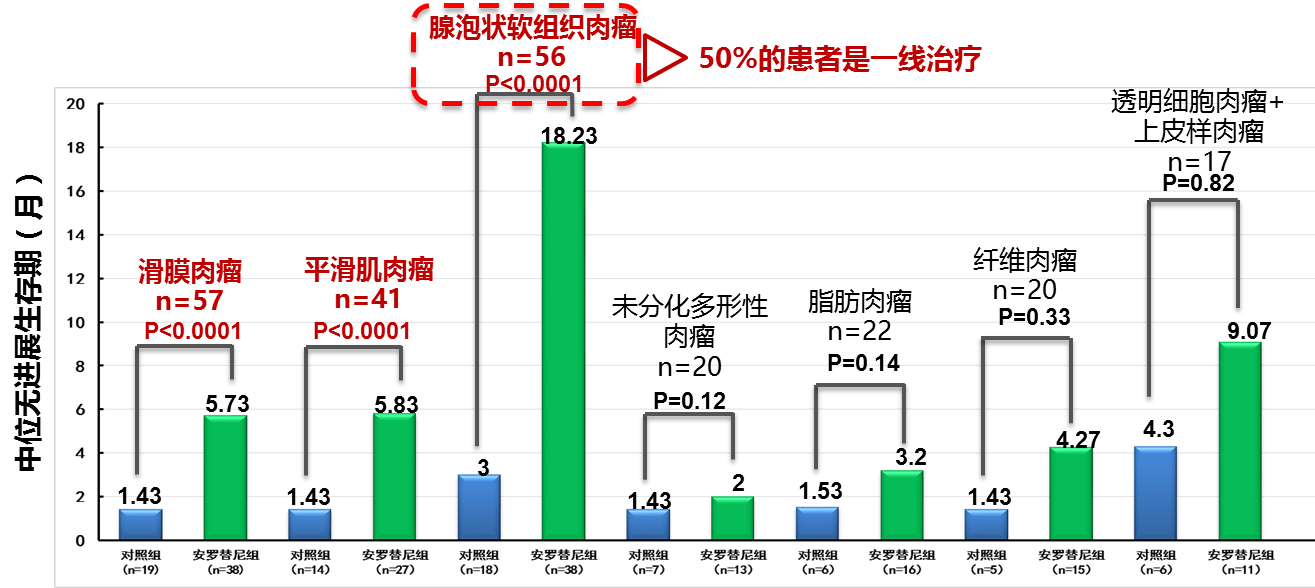
图7 亚型分析结果显示:安罗替尼显著延长滑膜肉瘤、平滑肌肉瘤、腺泡状STS等多种亚型的PFS
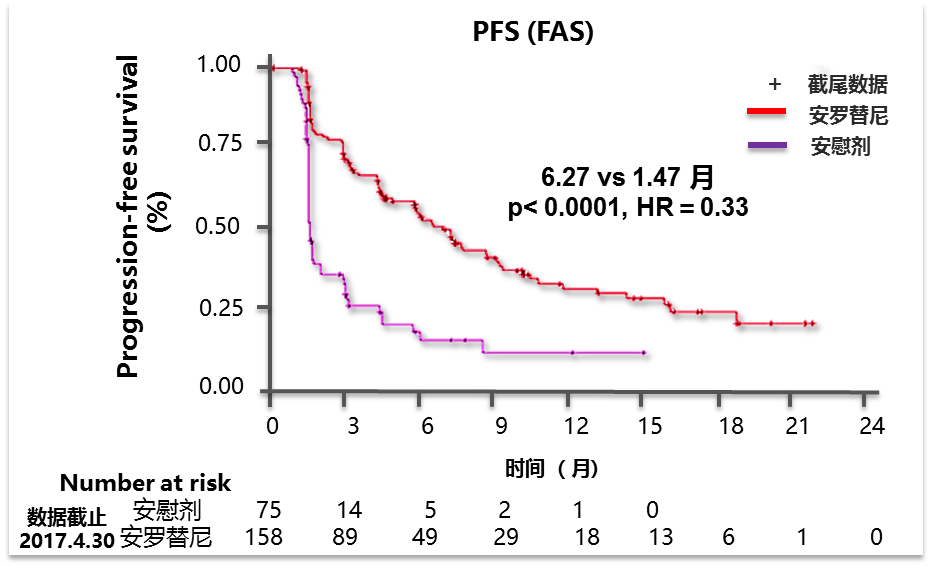
图8 与安慰剂组相比,安罗替尼显著延长PFS 4.8个月,疾病进展风险降低67%
(4)培唑帕尼治疗晚期血管肉瘤的研究(pazopanib+TRC105 vs pazopanib)
TRC105是抗内皮糖蛋白(CD105)单克隆抗体,协同增强TKI药物疗效。有III期随机对照研究比较了培唑帕尼单药和培唑帕尼联合TRC105的疗效,共入组128例血管肉瘤患者,结果显示培唑帕尼联合TRC105没有延长患者的PFS,独立影像学评价的中位PFS为4.3 vs 4.2 个月;联合组OS有获益趋势,中位OS未达到(图9);联合组不良事件发生率高于培唑帕尼单药组。
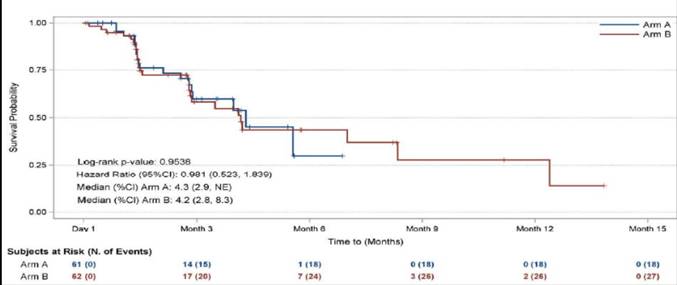
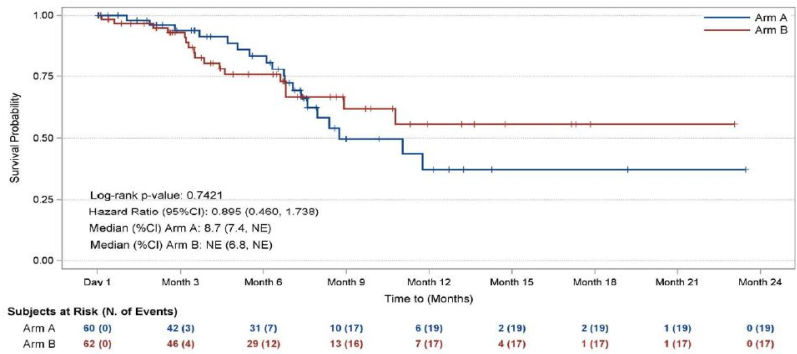
图9 培唑帕尼联合TRC105没有延长血管肉瘤的PFS
(5) EZH2抑制剂治疗上皮样肉瘤(ES)的研究
Tazemetostat是一种潜在的特异性的口服EZH2抑制剂,在INI1阴性肉瘤模型中证实了其对肿瘤的抑制作用,在其他INI1阴性的肿瘤中也有客观反应。ES中INI1缺失的比例高达90%。2019年ASCO上公布了tazemetostat治疗ES的研究结果。主要研究终点为ORR。结果显示tazemetostat在上皮样肉瘤中显示出较好的疗效,ORR为15%,DCR为26%(图10),反应持续时间(DOR)尚未达到,21.3%的患者PFS超过1年,而且安全性良好。
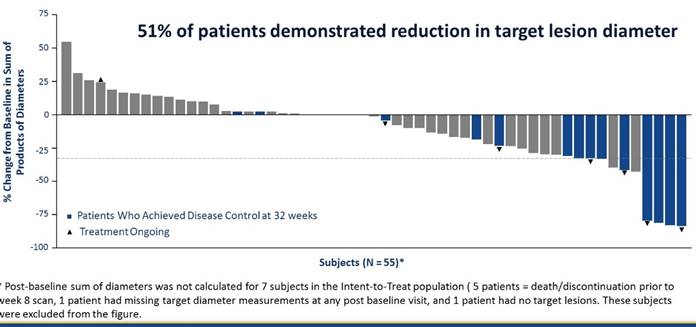
图10 Tazemetostat在上皮样肉瘤中显示出较好的疗效
(6) 新型mTOR抑制剂nab-Sirolimus治疗恶性血管周围上皮细胞瘤(PEComa)的研究
2019年ASCO口头公布了nab-Sirolimus治疗PEComa的疗效和安全性数据。入组34例局部晚期转移或无法手术且未使用过mTOR抑制剂的患者,所有患者接受nab-Sirolimus治疗。初步研究结果证实PEComa对nab-Sirolimus响应较好,ORR为42%;虽然应用剂量较高,但与传统mTOR抑制剂相比,未出现新的不良反应,无疑为无标准治疗方案的罕见和侵袭性肉瘤患者带来新的选择。
(7) 瑞戈非尼治疗软骨肉瘤的研究
2019ESMO公布了REGBONE研究中瑞戈非尼(regorafenib)治疗局部晚期或转移﹑复发软骨肉瘤的随机安慰剂对照II期研究结果。结果显示,瑞戈非尼治疗晚期软骨肉瘤的12周PFS为54.2%,高于安慰剂组的37.5%,中位PFS为19.4周,但结果仅达到了安慰剂组的预设值(50%)。最常见的3~5级不良反应为高血压、皮肤毒性、虚弱、腹泻等。
(8) 安罗替尼治疗晚期标准治疗失败的尤文肉瘤研究
晚期标准多模式治疗失败的尤文氏肉瘤一直是治疗难题。2019年ASCO上展示了安罗替尼和伊立替康治疗晚期标准治疗失败的尤文氏肉瘤的Ib/II期研究结果。结果显示,安罗替尼联合长春新碱、伊立替康的用药方案对晚期尤文肉瘤有良好的治疗效果,≥16岁和<16岁患者的12周ORR分别为62.5%和83.3%(图11);安全性方面,患者可耐受联合用药方案,最常见的3/4级不良事件为白细胞减少症、中性粒细胞减少、贫血和腹泻。
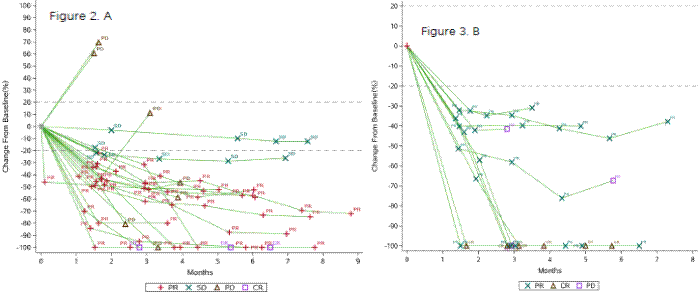
图11 安罗替尼联合长春新碱、伊立替康的用药方案对晚期尤文肉瘤有治疗效果,≥ 16岁和<16岁尤文肉瘤患者12周的ORR分别为62.5%和83.3%
(9) 仑伐替尼治疗复发/难治骨肉瘤的研究
2019年ESMO上报告了仑伐替尼+异环磷酰胺+依托泊苷治疗复发/难治性骨肉瘤的I/II期研究。该研究的主要研究终点为4个月PFS率。Ib期最终确定仑伐替尼联合化疗的剂量为14 mg/m2;Ib/II期研究中接受14mg/m2仑伐替尼联合化疗患者的4个月PFS率为79.9%,ORR为12.5%(仑伐替尼单药6.9%);除气胸外,Ib与II期不良反应发生率相似,发生气胸的比例为19%,高于仑伐替尼单药组,但与骨肉瘤中其它TKI观察到的结果相近。该研究结果表明,仑伐替尼联合化疗可用于治疗复发/难治骨肉瘤,未来将开展进一步的研究。
三、靶向治疗与免疫治疗的“强强”联合
新兴的靶向药物与免疫治疗联合,能否产生1+1>2的疗效?对此,研究者一直在寻找答案。2018年ASCO、2019年ASCO以及2019年ESMO均公布了相关进展。
1. 阿昔替尼联合帕博利珠单抗治疗晚期肉瘤
2018年ASCO公布的一项单臂、单中心2期研究首次报道了免疫检查点抑制剂联合抗血管生成药物用于软组织肉瘤的疗效,3个月PFS率为65.6%,,阿昔替尼联合帕博利珠单抗有进一步探索的价值。由于已知阿昔替尼单药对腺泡状软组织肉瘤(ASPS)基本无治疗响应,推测联合方案对ASPS的疗效与免疫治疗有关。
2. 纳武单抗联合舒尼替尼治疗STS
2019年ESMO会议报道了西班牙和意大利肉瘤协作组针对纳武单抗联合舒尼替尼治疗多种STS亚型的I/II期研究结果。研究方案中明确先给予舒尼替尼诱导治疗,之后给予舒尼替尼和纳武单抗联合治疗。观察到3个月和6个月的PFS率分别为69%和50%,中位PFS为5.9个月(图12),1例患者达完全缓解(CR),无治疗相关死亡。纵观全部病例,有意义的是,达到部分缓解(PR)的亚型均为对抗血管治疗敏感的亚型,而6例UPS患者无1例PR。
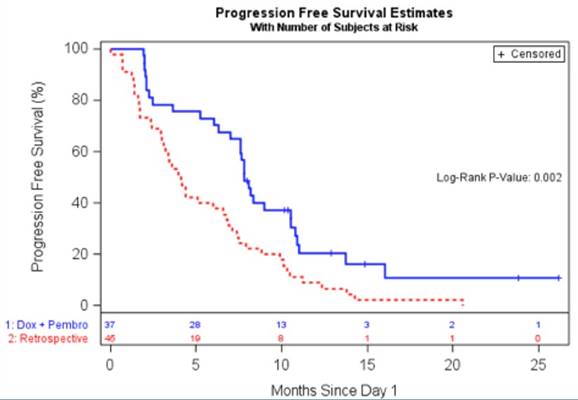
图12 帕博利珠单抗+多柔比星治疗转移/不可切除肉瘤,与历史对照相比,延长PFS
3. NKTR-214联合纳武单抗治疗转移性高级别肉瘤的初步研究
免疫疗法治疗STS之所以疗效欠佳,是因为STS在免疫微环境上属于“冷”肿瘤。如何刺激肿瘤中D8+CTL﹑NK﹑CD4+helper细胞生成,减少调节性T细胞(Treg)细胞产生,将STS“冷”的免疫微环境转变为“热”肿瘤,成为研究热点之一。2019年ASCO公布的NKTR-214联合纳武单抗治疗转移性高级别STS的队列研究,初步结果显示只有未分化多形性肉瘤(UPS)组ORR值达到主要研究终点20%(图13)。对疗效较好的患者进一步分析发现,高PD1表达、高免疫浸润、低Ki67表达、高TMB与较好的治疗反应相关,而且NKTR-214联合纳武单抗方案是安全、可耐受的。
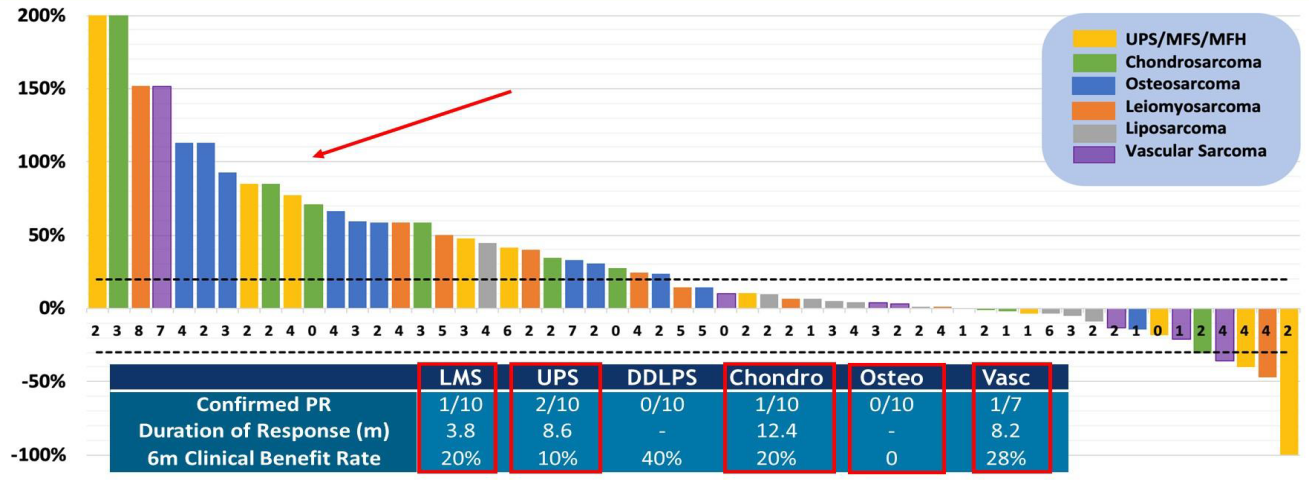
图13 NKTR-214联合纳武单抗治疗转移性高级别肉瘤的疗效分析
4. 帕博利珠单抗+epacadostat治疗晚期肉瘤
吲哚胺2,3-双加氧酶1(IDO1)抑制CD8+T细胞的增殖和功能,同时产生的犬尿酸会诱导T细胞向调节性T细胞分化,从而抑制抗肿瘤的免疫功能。Epacadostat是首个高效、高选择性的口服IDO1抑制剂,与帕博利珠单抗联用能否增强帕博利珠单抗的抗免疫功能?令人遗憾的是,2019年ASCO公布的帕博利珠单抗+epacadostat 治疗晚期肉瘤的临床试验观察到的疗效有限,但对于晚期肉瘤患者,epacadostat联合帕博利珠单抗安全且耐受性良好。
结语
肉瘤发病率低,类型众多,治疗复杂。驻足当下,优化化疗方案;展望未来,寻找靶点,不断研发以安罗替尼为代表的靶向药物,实现精准化治疗。。做到“老树新花,交相辉映,刚柔并济”,三架马车抗肉瘤,希冀不断提高肉瘤患者生存。
部分会议现场掠影





哈尔滨站















 苏公网安备32059002004080号
苏公网安备32059002004080号


