免疫治疗在肺癌、肾癌、膀胱癌和黑色素瘤等多种实体肿瘤中的发展非常迅猛,但乳腺癌因其自身特性,存在肿瘤突变负荷低、免疫原性弱等特点,在免疫治疗研究中的进展较为缓慢。而在三阴性乳腺癌,因其突变率、肿瘤浸润性T细胞水平等免疫原性特征高于其他分型,使其成为免疫治疗的潜在瘤种。IMpassion130研究的成功可以说开启了乳腺癌免疫治疗的新纪元,目前尤以PD-1/ PD-L1抑制剂在乳腺癌领域的研究发展迅速。

复旦大学附属妇产科医院乳腺外科主任
中华医学会外科分会乳腺学组委员
中国医师协会乳腺外科医师委员会常委
中国妇幼保健协会乳腺保健专业委员会副主任委员
中国抗癌协会肿瘤标志专业委员会肿瘤标志物临床转化研究协作组副组长
上海市抗癌协会乳腺癌专业委员会常委
美国临床肿瘤学会ASCO会员
美国缅因州医疗中心外科、香港大学外科学系高级访问学者
PD-1抑制剂与PD-L1抑制剂有何不同?
有效的抗肿瘤免疫反应的产生是一个复杂的过程,对免疫过程的认识为免疫治疗提供了合理的策略。PD-1,即程序性死亡受体1,表达于T细胞表面,至少有2个配体,一个是PD-L1,另一个是PD-L2。PD-L1是PD-1的主要配体,广泛表达于T细胞、B细胞、树突状细胞、巨噬细胞等多种细胞上;而PD-L2在癌症中相对少见,其表达的普遍性低于PD-L1。PD-L1、PD-L2与其受体PD-1结合可以导致T淋巴细胞失活,在保护周围组织免受过度炎症中发挥着重要作用。PD-L1除了与PD-1结合,还可能与包括B7.1在内的其他蛋白相互作用,介导免疫抑制功能[1]。癌症作为一种慢性且常引发炎症的疾病,在疾病进展过程中可通过上调PD-L1表达逃避宿主免疫反应。PD-1抑制剂可同时阻断PD-1与PD-L1、PD-L2结合,解除对T细胞的抑制作用,但也增加了炎症性毒性的可能。PD-L1和PD-L2均被认为在维持免疫平衡方面发挥着重要作用,尤其是在肺内。针对PD-1抗体的研究报道了严重的,甚至是致命的肺自身免疫不良事件[2]。临床前模型中也表明缺乏PD-L2或PD-L2被阻断的老鼠表现为辅助性T细胞2(Th2)超敏反应,伴有白细胞介素(IL)-4升高相关的呼吸道炎症加重等[3]。与PD-1抑制剂相比,PD-L1抑制剂除了抑制PD-1/PD-L1,还具有抑制额外PD-配体相互作用的优势。例如对T细胞反应有独特抑制作用的PD-L1/B7.1,从而解除其免疫抑制作用。体内研究也发现,PD-L1抑制剂相比PD-1或PD-L2抑制剂有更强的抗肿瘤作用[1]。在安全性上,PD-L1抑制剂并不影响PD-1/PD-L2的结合,一定程度保留了免疫稳态,有助于预防自身免疫反应[1]。Michot JM教授在2016年的一篇综述中就提到,PD-L1相比PD-1在免疫相关不良事件有一定优势[4]。
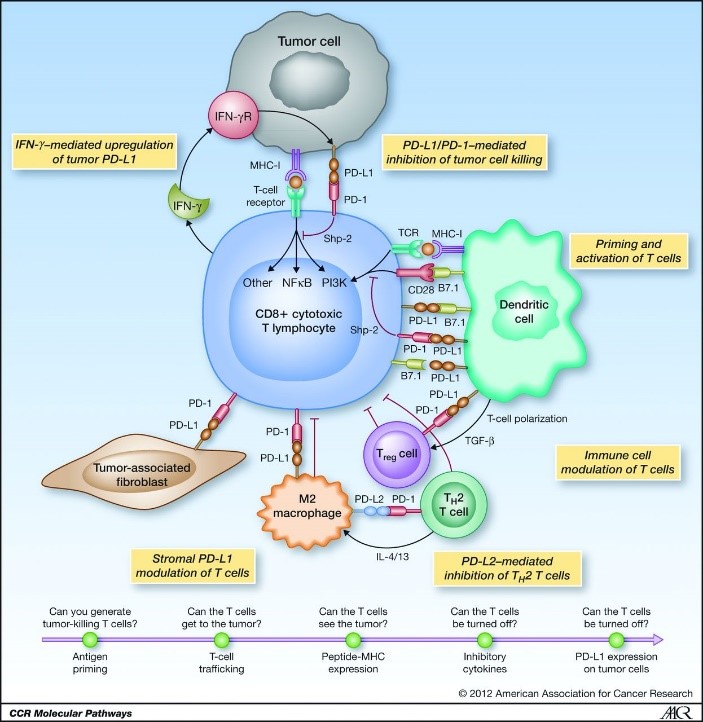
图1 肿瘤免疫机制和PD-L1/PD-1 通路
免疫治疗单药还是联合,哪种更有效?
在乳腺癌领域,无论是应用PD-1抑制剂还是PD-L1抑制剂,研究者们都进行了诸多尝试。Ⅰb期KEYNOTE-012研究中,32名PD-L1表达阳性三阴性乳腺癌患者接受了帕博利珠单抗单药治疗,对其中27例患者进行评估发现,客观缓解率(ORR)为18.5%,中位至缓解时间为17.9周,1例患者完全缓解,4例患者部分缓解,7例患者疾病稳定[5]。Ⅱ期临床研究KEYNOTE-086进一步评估帕博利珠单抗单药在三阴性乳腺癌中的疗效和安全性,共计纳入了170例转移性三阴性乳腺癌患者,分为经治(队列A,≥1次既往系统治疗)和初治(队列B, 既往未接受转移性疾病的全身治疗)两组,结果显示队列A整体ORR为5.3%,其中PD-L1阳性患者ORR为5.7%[6],队列B中PD-L1阳性患者ORR为21.4%[7]。Ia期研究PCD4989g入组了115例三阴性乳腺癌评估Atezolizumab的安全性和疗效,其中一线患者ORR为26%,后线患者ORR为11%[8]。尽管反应相对较低,但观察到对免疫治疗达到缓解的患者具有良好的预后,且一定程度上表明越早开展免疫治疗,患者获益的概率越高。免疫治疗单药Ⅲ期研究KEYNOTE-119在2019年ESMO会议上公布了数据,该研究主要评估帕博利珠单抗单药对比研究者选择(卡培他滨、艾立布林、吉西他滨、长春瑞滨)在2/3线治疗转移性三阴性乳腺癌,其主要研究终点总生存时间(OS)并未显著改善[9]。从目前已有的研究数据来看,免疫治疗单药相比化疗没有太大的优势,因此,免疫治疗的主要挑战是找到增强肿瘤对免疫治疗应答的方法,并将无应答者转变为应答者。
IMpassion130研究是目前唯一的免疫治疗在转移性三阴性乳腺癌的Ⅲ期试验中取得阳性结果的研究。该研究入组902例既往没有针对晚期三阴性乳腺癌进行系统性治疗的患者,按1∶1随机进入试验组atezolizumab +白蛋白紫杉醇组和对照组白蛋白紫杉醇组。在2018年ESMO会上IMpassion130研究公布了第一次中期分析的结果:在ITT人群中,无进展生存(PFS)从5.5个月增加到7.2个月(HR=0.8,P=0.0025),OS从17.6个月增加到21.3个月,其中PD-L1阳性人群中,PFS从5.0个月增加到7.5个月(HR=0.62, P<0.0001),OS从15.5个月延长至25.0个月,延长近10个月[10]。基于该数据,美国FDA加速批准atezolizumab联合化疗治疗无法切除的局部晚期或转移性PD-L1阳性三阴性乳腺癌,使得atezolizumab成为第一个被批准用于乳腺癌的免疫治疗药物。在2019年ASCO 年会上,IMpassion130研究进一步更新了OS结果,在PD-L1阳性的患者群体中,试验组和对照组的中位OS分别为25个月和18个月(HR=0.71,95%CI 0.54~0.91),治疗组较对照组中位OS改善近7个月[11]。该研究的成功,进一步激发了研究者们探索乳腺癌免疫治疗的热情。
KEYNOTE-522是免疫治疗在早期三阴性乳腺癌中首个公布结果的研究。该研究是新辅助阶段帕博利珠单抗+化疗对比安慰剂+化疗,后辅助阶段帕博利珠单抗对比安慰剂的Ⅲ期研究。研究结果显示,在铂类新辅助化疗中添加帕博利珠单抗,pCR(ypT0/Tis ypN0)提高13.6%, 目前无事件生存(EFS)尚未成熟,仍在进一步随访中[12]。
免疫治疗联合何种化疗?治疗时序如何?
2012年《自然》杂志(Nature)上发表了关于化疗对于免疫系统的激活,不同的药物可能存在一些细微的差别[13]。目前免疫治疗联合不同化疗药物的多项研究正在探讨中,如IMpassion131(NCT03125902)探索了atezolizumab联合紫杉醇在一线转移性三阴性乳腺癌中的应用,IMpassion132 (NCT03371017)研究探索atezolizumab联合不同的化疗方案(吉西他滨+卡铂或者卡培他滨),KEYNOTE-355(NCT02819518)研究探索了帕博利珠单抗联合白蛋白紫杉醇或紫杉醇或吉西他滨/卡铂等多种不同化疗药物的探索,期待这些研究结果能更好地指导临床治疗。
关于免疫治疗的时序,有研究显示免疫治疗前短周期的治疗可能可以更好地帮助进行抗原提呈,提升免疫治疗抗肿瘤活性。2017年ESMO会上公布的TONIC研究数据,这是一项针对三阴性乳腺癌诱导治疗后,应用纳武利尤单抗治疗的II期随机、非对照临床试验。该研究入组55例、最多接受3线化疗的患者,分成5组分别先进行放疗、多柔比星、环磷酰胺、顺铂或无治疗,进行诱导,2周后活检,之后进行纳武利尤单抗治疗,ORR 24%、中位PFS 3.4个月,进一步分析发现顺铂及多柔比星能更好地提高肿瘤对免疫治疗的反应性[14]。目前有关免疫治疗时序的问题还有待进一步探索和研究。
免疫治疗联合靶向治疗异常火热
乳腺癌常见的靶向治疗药物如曲妥珠单抗、CDK4/6抑制剂均显示可增强抗肿瘤免疫原性,因此免疫治疗与靶向治疗的联合将非常有潜力,而一些新型的药物AKT抑制剂、MEK抑制剂等与免疫治疗的联合也成为目前的研究热点。
PANACEA研究探讨了帕博利珠单抗联合曲妥珠单抗用于曲妥珠单抗耐药的HER2阳性晚期乳腺患者的疗效,结果显示,在PD-L1阳性患者中ORR为15.2%,PD-L1阴性患者中无患者缓解[15]。KATE2研究探索了T-DM1联合atezolizumab在曲妥珠单抗经治HER2阳性乳腺癌疗效,结果显示ITT人群试验组T-DM1联合atezolizumab相比对照组无统计学差异,但是亚组分析提示PD-L1阳性亚组中,atezolizumab联合T-DM1组的PFS数值(8.6个月)优于T-DM1+安慰剂组(4.1个月);在第二次OS分析中,OS数值更倾向于T-DM1+atezolizumab组,分层HR=0.74 (95%Cl 0.42~1.30),生存曲线在1年后出现分离,为HER2阳性晚期乳腺癌带来治疗新局面[16,17]。基于这些结果,HER2靶向药物联合atezolizumab治疗既往接受过治疗的HER2阳性PD-L1 IC+晚期乳腺癌有必要进一步研究。帕博利珠单抗联合abemaciclib的Ⅰb期研究显示出了临床获益,并且安全性可接受,ORR为28.6%。
COLET研究是为评估PD-L1抑制剂+MEK抑制剂联合紫杉类一线治疗局部晚期或转移性三阴性乳腺癌的疗效的首个研究,PD-L1免疫细胞(IC)阳性 vs. PD-L1 IC阴性ORR为39% vs 20%,但由于患者数较少,尚不能得出明确的结论[18]。AKT抑制剂ipatasertib联合atezolizumab及化疗(紫杉醇或者白蛋白紫杉醇)在局部晚期或转移性三阴性乳腺癌一线治疗的Ib期临床试验显示ORR可达到73%,且与PD-L1状态和PIK3CA/AKT1/PTEN突变状态无关[19]。ICB联合PARP抑制剂同样具有前景,奥拉帕利联合durvalumab以及尼拉帕利联合帕博利珠单抗治疗乳腺癌都是非常热门的抗癌组合。
免疫治疗疗效预测及生物标志物探索
免疫治疗疗效预测也是很重要的一环,既往与抗PD-L1/PD-1治疗临床获益相关的免疫生物学标志物主要包括肿瘤细胞 (TC)的PD-L1表达、CD8+T细胞和间质内肿瘤浸润淋巴细胞 (sTILs)水平。IMpassion130研究探索性分析发现,使用SP142 IHC检测发现,三阴性乳腺癌的PD-L1主要在肿瘤浸润免疫细胞上表达,PD-L1在 IC亚组的阳性人群占41%,包含了绝大部分肿瘤细胞PD-L1表达的患者,IHC CD8+人群中只有同时PD-L1 IC+的患者才有临床获益,间质内TIL患者中只有同时PD-L1 IC+的患者才有临床获益,BRCA1/2突变的患者只有同时为PD-L1 IC+才可以得到临床获益 (PFS/OS)。免疫细胞上PD-L1的表达状态 (PD-L1 1C+/-) 是预测atezolizumab联合白蛋白紫杉醇治疗转移性三阴性乳腺癌获益的生物标志物[20],但是PD-L1的检测是目前临床面临的一大问题,目前可及的试剂包括SP142、22C3、SP263等多种试剂,在IMpassion130亚组探索性分析评估22C3和SP263与SP142检测PD-L1的一致性,显示无论样本来自原发肿瘤组织还是转移性组织,在SP142 PD-L1 IC+亚组中均观察到临床活性,SP142的总符合率分别为64%(22C3)和69%(SP263),分析一致性低于标准值(< 90%),多种检测方法不等效,该分析进一步表明SP142检测是识别最有可能从atezolizumab+白蛋白紫杉醇获益的方法[21]。
展望
乳腺癌免疫治疗的其他大型研究尚有:新辅助治疗领域的IMpassion031研究(NCT03197935),辅助治疗领域的SWOG S1418/NRG BR006(NCT02954874)研究、IMpassion030(NCT03498716)研究,晚期治疗领域的KEYNOTE-355(NCT02819518)、IMpassion131(NCT03125902)等。抗血管生成与免疫疗法联合能产生明显的协同效应,更多相关临床研究的结果指日可待。
除了系统性治疗的联合,局部治疗如放疗,也可以诱导抗原释放并促进肿瘤特异性免疫反应,几项评估免疫治疗联合放疗治疗乳腺癌的临床试验正在进行中,包括帕博利珠单抗联合放疗治疗HR阳性乳腺癌和三阴性乳腺癌(NCT02303366、NCT02608385、NCT02730130和NCT03051672)以及CTLA-4抑制剂tremelimumab联合脑部放疗,加/不加曲妥珠单抗治疗HER2阳性患者(NCT02563925),同时ICB联合术前放疗用于早期三阴性乳腺癌患者的试验(NCT03872505)也正在进行中,另外一种联合的形式——冷冻消融联合免疫治疗正在研究用于早期乳腺癌患者乳房切除术。期待随着将来更多研究数据的公布,免疫治疗可以在乳腺癌领域中大展身手!
[1]Chen DS, Irving BA, Hodi FS. Molecular pathways: next-generation immunotherapy--inhibiting programmed death-ligand 1 and programmed death-1[J]. Clin Cancer Res,2012 ,18(24):6580-6587.
[2]McDermott DF, Drake CG, Sznol M. A phase I study to evaluate safety and antitumor activity of biweekly BMS-936558 (anti-PD-1, MDX-1106/ONO-4538) in patients with RCC and other advanced refractory malignancies[J]. J Clin Oncol ,2011 (suppl; abstr 331).
[3]Akbari O, Stock P, Singh AK, et al. PD-L1 and PD-L2 modulate airway inflammation and iNKT-celldependent airway hyperreactivity in opposing directions[J]. Mucosal Immunol, 2010,3:81–91.
[4]Michot JM, Bigenwalda C,Champiat S ,et al. Immune-related adverse events with immune checkpoint blockade: a comprehensive review[J]. Eur J Cancer,2016 ,54:139-148.
[5]Nanda R, Chow LQ, Dees EC ,et al. Pembrolizumab in patients with advanced triple-negative breast cancer: phase Ib KEYNOTE-012 study[J]. J Clin Oncol,2016,34(21):2460-2467.
[6]Adams S, Schmid P, Rugo H, et al. Pembrolizumab monotherapy for previously treated metastatic triple-negative breast cancer: cohort A of the phase II KEYNOTE-086 study[J]. Ann Oncol,2019 ,30(3):397-404.
[7]Adams S, Loi S,Toppmeyer D, et al. Pembrolizumab monotherapy for previously untreated, PD-L1-positive, metastatic triple-negative breast cancer: cohort B of the phase II KEYNOTE-086 study[J]. Ann Oncol,2019 ,30(3):405-411.
[8]Emens LA, Cruz C,Eder JP ,et al. Long-term clinical outcomes and biomarker analyses of atezolizumab therapy for patients with metastatic triple-negative breast cancer: a phase 1 study[J]. JAMA Oncol,2019 ,5(1):74-82.
[9]Cortés J, et al. KEYNOTE-119: phase III study of pembrolizumab (pembro) versus single-agent chemotherapy (chemo) for metastatic triple negative breast cancer (mTNBC). ESMO 2019, LBA21.
[10]Schmid P, et al. Atezolizumab and nab-paclitaxel in advanced triple-negative breast cancer[J]. N Engl J Med,2018 ,379(22):2108-2121.
[11]Schmid P, et al. IMpassion130: updated overall survival (OS) from a global, randomized, double-blind, placebo-controlled, Phase III study of atezolizumab (atezo) + nab-paclitaxel (nP) in previously untreated locally advanced or metastatic triple-negative breast cancer (mTNBC). ASCO 2019, abstract 1003.
[12]Schmid P, et al. KEYNOTE-522: Phase III study of pembrolizumab (pembro) + chemotherapy (chemo) vs placebo (pbo) + chemo as neoadjuvant treatment, followed by pembro vs pbo as adjuvant treatment for early triple-negative breast cancer (TNBC).ESMO 2019, LBA8.
[13]Galluzzi L, et al. The secret ally: immunostimulation by anticancer drugs[J]. Nat Rev Drug Discov,2012,11(3):215-233.
[14]Voorwerk L, et al. Immune induction strategies in metastatic triple-negative breast cancer to enhance the sensitivity to PD-1 blockade: the TONIC trial[J]. Nat Med,2019 ,25(6):920-928.
[15]Loi S, et al. Pembrolizumab plus trastuzumab in trastuzumab-resistant, advanced, HER2-positive breast cancer (PANACEA): a single-arm, multicentre, phase 1b-2 trial[J]. Lancet Oncol, 2019 ,20(3):371-382.
[16]Emens LA, et al.Results from KATE2, a randomized phase ii study of atezolizumab + transtuzumab emtansine(T-DM1) vs placebo+T-DM1 in previously treated HER2+ advanced breast cnacer[J]. SABCS 2018, Abstract PD3-01.
[17]Emens LA, et al. Overall survival (OS) in KATE2, a phase II study of programmed death ligand 1 (PD-L1) inhibitor atezolizumab (atezo)+trastuzumab emtansine (T-DM1) vs placebo (pbo)+T-DM1 in previously treated HER2+ advanced breast cancer (BC). ESMO 2019, 3050.
[18]Adam Brufsky, et al. Phase II COLET study: atezolizumab (A) + cobimetinib (C) + paclitaxel (P)/nab-paclitaxel (nP) as first-line (1L) treatment (tx) for patients (pts) with locally advanced or metastatic triple-negative breast cancer (mTNBC).ASCO 2019, Abstract 1013.
[19]Schmid P, Loirat D, et al. Phase 1b study evaluating a triplet combination of ipatasertib, atezolizumab, and paclitaxel or nab-paclitaxel as first-line therapy for locally advanced/metastatic triple-negative breast cancer. AACR 2019.
[20]Emens LA, et al. IMpassion130 biomarkers. SABCS 2018 (program #GS1-04).
[21]Rugo HS, et al. Performance of PD-L1 immunohistochemistry (IHC) assays in unresectable locally advanced or metastatic triple-negative breast cancer (mTNBC): Post-hoc analysis of IMpassion130. ESMO2019, LBA20.











 苏公网安备32059002004080号
苏公网安备32059002004080号


