辅助内分泌治疗在激素受体阳性乳腺癌系统性治疗中具有重要意义。尽管完成5年的辅助内分泌治疗,激素受体阳性乳腺癌仍有很高的后期复发风险。虽然超出治疗后5年仍存在复发风险,但这并不一定意味着更长时间的辅助内分泌治疗将减少乳腺癌复发风险从而改善患者乳腺癌患者的结局。随机研究表明,绝经前早期乳腺癌患者完成5年他莫昔芬治疗后,延长他莫昔芬治疗总时间至10年或更改为芳香化酶抑制剂(aromatase inhibitor, AI),都可降低乳腺癌复发风险。然而,首诊后第一个5年内接受AI辅助内分泌治疗的绝经后患者,延长辅助内分泌治疗的时长是否有获益目前尚未解决。美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)就AI内分泌治疗时长和延长AI辅助内分泌治疗的问题进行了临床实践指南更新,相关研究于2018年11月发表在《临床肿瘤学杂志》(Journal of Clinical Oncology)上。本期【新见】栏目谨对该研究进行介绍,并邀请上海第九人民医院黄浦分院的汪成教授对该研究进行点评。

上海交通大学医学院附属第九人民医院黄浦分院
上海第九人民医院黄浦分院乳腺外科行政副主任
上海市黄浦区卫生领军医学人才、优秀学科带头人
上海市抗癌协会乳腺癌专业委员会 常委
中国抗癌协会康复会乳甲分会 副主任委员
中国医促会乳腺疾病分会青委会 副主任委员
中国抗癌协会整合肿瘤心脏病学分会 委员
中国抗癌协会肿瘤心理学专业委员会 委员
中国医师协会微无创分会乳腺专业委员会 委员
中华医学会肿瘤学分会乳腺肿瘤学组 青委
中国抗癌协会乳腺癌专业委员会 青委
中国中医药研促会乳腺病专业委员会 委员
上海市生物医药行业协会精准医疗专委会 常委
上海市医师协会医学科学普及分会 委员

《新见》是由中华医学会肿瘤分会乳腺肿瘤学组组织的国际会议期刊文献解读与点评。
研究背景
美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)关于激素受体阳性女性乳腺癌患者辅助内分泌治疗的临床实践指南最近更新并发表于2016年1月。ASCO指南定期进行更新,因此可能会有新的证据提供修改建议并追加额外的更新。本次ASCO2018焦点问题更新,是响应一篇新的同行评议文章,该文章对2014年以来发表更新的有关延长芳香化酶抑制剂(aromatase inhibitor, AI)治疗的6个随机临床试验(randomized clinical trials, RCT)进行了系统综述。
本次焦点问题更新经临床实践指南委员会批准。旧版指南主要探讨了第一个5年的内分泌治疗他莫昔芬单药的用药时长。本次新版指南基于最新的证据更新内分泌治疗时长问题,对2014年以来更新的文献进行系统综述和分析,重点探讨绝经后女性乳腺癌辅助AI内分泌治疗时长和延长AI辅助内分泌治疗的问题。针对2010年、2013年、2016年版指南中其他临床问题,本次2018年版指南不作解答。附录表A1(仅在线)对既往以上旧版指南进行了总结,这些指南仍然是最新的。
研究方法
本次ASCO临床实践指南焦点问题更新是基于对相关文献(2012年—2018年)的深入解读,并给出具体的专家修订建议。修订版的完整指南和附加信息可参见www.asco.org/breast-cancer-guidelines。完整的专家建议列表,包括更新的推荐见附录表A1。
本次更新的建议是由一个多学科专家小组(附录表A2,仅在线)修订的。该专家小组包含一例患者代表和一名有健康研究方法学专业知识的ASCO指南专员,利用III期RCT的证据以及临床经验作为指导。临床实践指南更新由ASCO临床实践指南委员会批准。通过PubMed对从2012年-2018年间的文献以及2017年以来的会议摘要进行系统综述。
如文章符合以下标准则作为临床证据,纳入系统综述中:
在医学文献领域发表的期刊文章
Ⅲ期RCT试验
获口头汇报/壁报的会议摘要
英语撰写
有或没有进行荟萃分析的系统评价
研究人群为绝经后女性
文章如有以下情况则在系统综述中排除:①其他形式的评论(来自共识、叙事文章、专家小组、指南);②述评、评论、信件、新闻文章、案例报告;③非英语撰写。每一条建议均包含推荐等级、证据强度和可能的偏倚(见补充方法中的等级定义)。
研究结果
研究特征
6项Ⅲ期RCT临床试验符合系统综述的纳入标准,并在证据的基础上对延长AI治疗的时长给出了建议。如图1和表1所示,每一个研究都探讨了超过5年的AI辅助内分泌治疗对Ⅰ-Ⅲ期绝经后激素受体阳性女性乳腺癌的获益。来曲唑治疗接受过5年芳香酶抑制剂治疗的女性原发性乳腺癌患者的疗效(MA.17R)试验纳入1,918例之前已接受5年AI(4.5~6年,在此之前大多数是他莫昔芬)的女性乳腺癌患者,对比后续辅助10年AI与5年AI的治疗效果(来曲唑2.5 mg/每日,对比安慰剂)。入组患者均未出现疾病复发,且美国东部肿瘤协作组(Eastern Cooperative Oncology Group)体能评分<3分、预期寿命>5年。美国乳腺与肠道外科辅助治疗项目(National Surgical Adjuvant Breast and Bowel Project, NSABP)B-42 试验纳入3,923例已完成5年AI内分泌治疗(包括单纯AI 5年或者小于3年他莫昔芬序贯AI共计5年)的患者,探讨后续是否应继续5年来曲唑2.5 mg/每日(对比安慰剂)治疗。不同时长的辅助阿那曲唑治疗(Different Durations of Adjuvant Anastrozole, DATA)试验纳入1,660 例经2~3年他莫昔芬治疗的患者,比较后续6年与3年辅助阿那曲唑(1 mg/每日)治疗的疗效。入组女性患者均无局部区域复发或远处转移的迹象。探究延长辅助来曲唑(Investigation on the Duration of Extended Adjuvant Letrozole, IDEAL)试验。纳入接受过5年内分泌治疗的1,824例无疾病复发女性患者,随机分为后续延长来曲唑2.5年或5年。纳入标准包括世界卫生组织(World Health Organization, WHO)体能评分≤ 1分,完成5年内分泌治疗(他莫昔芬5年,AI 5年,或两者序贯5年)。澳大利亚乳腺癌研究组试验16 (Austrian Breast Cancer Study Group trial 16, ABCSG 16)随机纳入3,484例已完成初始 4~6年辅助内分泌治疗(他莫昔芬、AI、他莫昔芬序贯AI)的无疾病复发的女性患者,比较后续延长2年或5年阿那曲唑治疗的疗效。延长来曲唑(Study of Letrozole Extension, SOLE)试验纳入4,884例已完成5辅助内分泌治疗的淋巴结阳性的女性乳腺癌患者,被随机分配至5年来曲唑连续用药组或5年来曲唑间歇用药组(最初1-4年来曲唑连用9个月停3个月,第5年来曲唑连用12个月)。以上所有研究的主要研究终点是无病生存期(disease-free survival, DFS),次要研究终点是总生存期(overall survival, OS)和不良事件(adverse events, AE)。
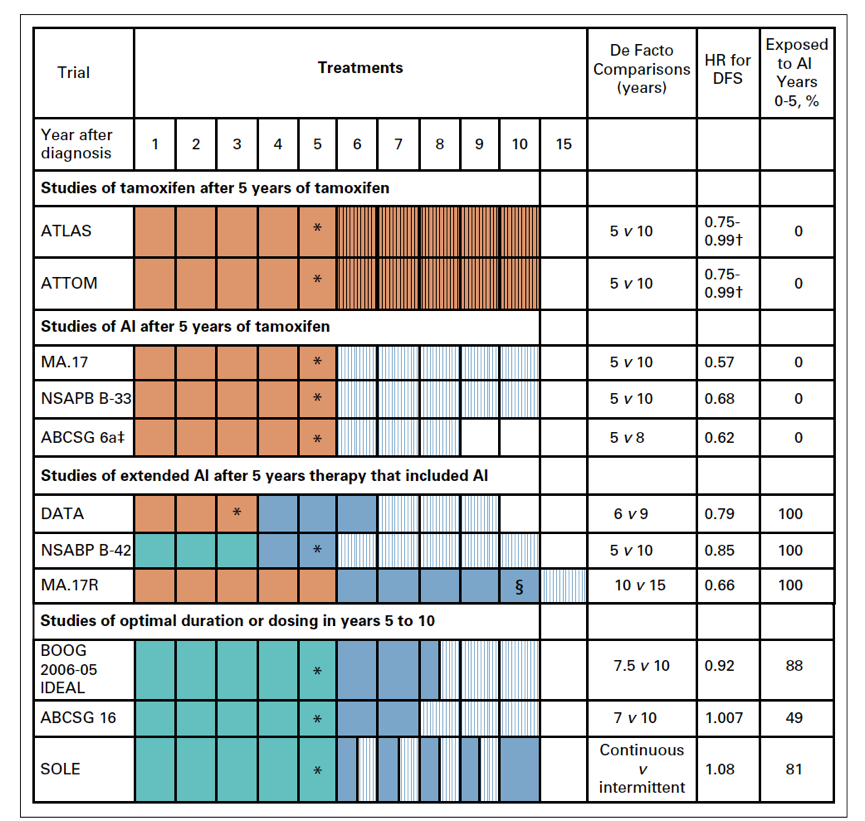
图1 6项随机临床研究的治疗模式图
表1 6项随机研究总结
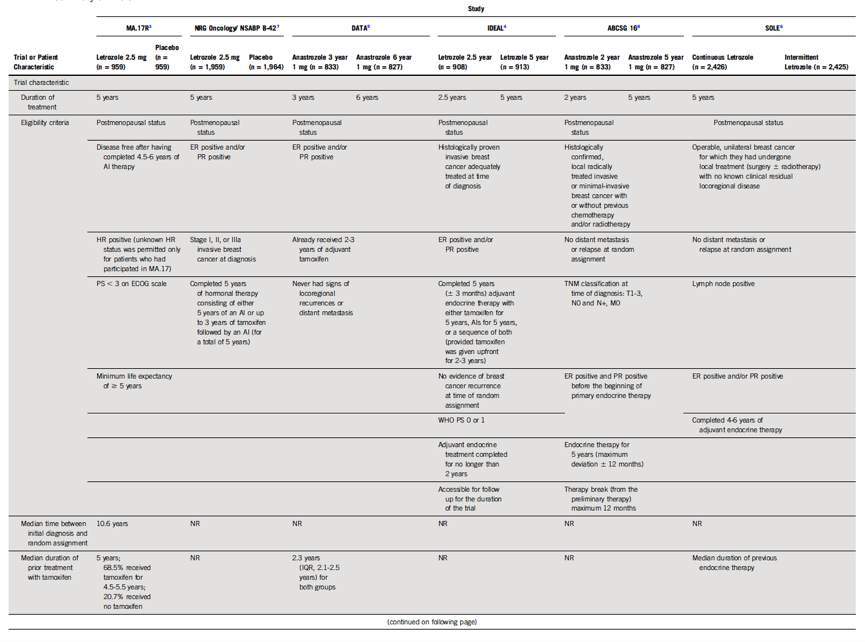
表1 (续表)
研究质量
对纳入的6个临床试验均进行常规的质量评估。有关试验设计的质量由一名评审员评估,其余相关因素包括盲法、分配隐藏、安慰剂对照、治疗的目的、资金来源等由另一名评审员评估。纳入的临床试验的偏倚风险评估为低危或中危。具体的质量评估和总体风险偏倚评级的定义可参考补充数据里的方法部分。
建议
对于绝经后激素受体阳性的女性乳腺癌患者,5年内分泌治疗后延长治疗是否可以带来临床获益(DFS、OS、生活质量、毒性)?如果可以,哪些患者应该接受延长治疗,以及如何延长治疗?
焦点问题更新建议
建议1. 对于淋巴结阴性的女性乳腺癌患者,基于预后因素有复发风险者应考虑包括AI在内的10年延长辅助内分泌治疗。然而,因该人群复发风险相对较低,可能获益相对有限。对于低风险的淋巴结阴性患者不推荐延长辅助内分泌治疗。
建议2. 对于淋巴结阳性的女性乳腺癌患者应接受包括AI在内的10年延长辅助内分泌治疗。
建议3. 女性接受延长的辅助内分泌治疗总体时间应不超过10年。
建议4. 应对延长内分泌治疗的主要获益即可预防二次乳腺癌或对侧乳腺癌的发生进行讨论。
建议5. 在医生团队与患者讨论治疗决策时,应权衡延长内分泌治疗带来的临床获益与持续的副作用。
资格声明
目前,没有任何临床试验表明延长内分泌治疗可以改善总生存。因此,推荐延长辅助AI治疗是基于其可以预防远处复发和二次乳腺癌的发生。
文献综述和分析
本部分总结了2018年更新的系统综述中纳入的6个临床试验。感兴趣的数据的结果见表2和表3。
表2 疗效数据
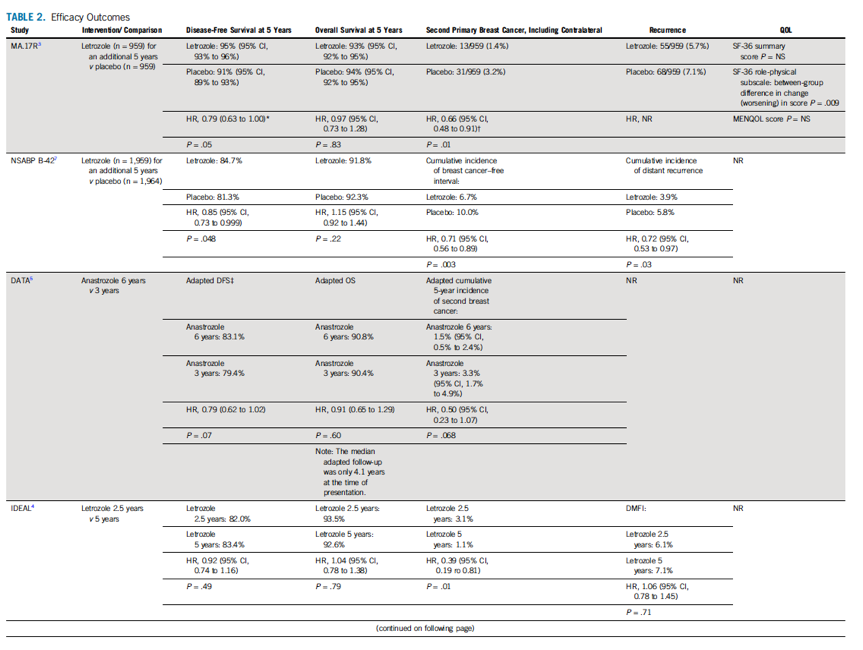
表2 (续表)
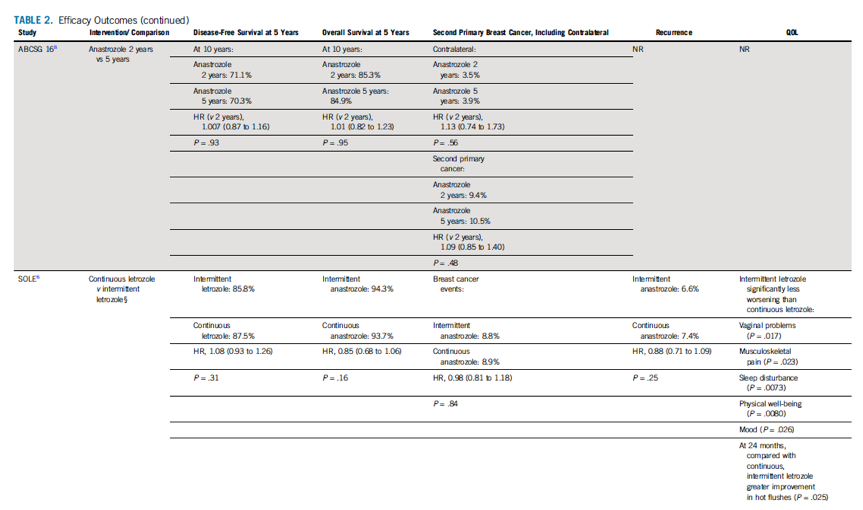
表3 不良事件
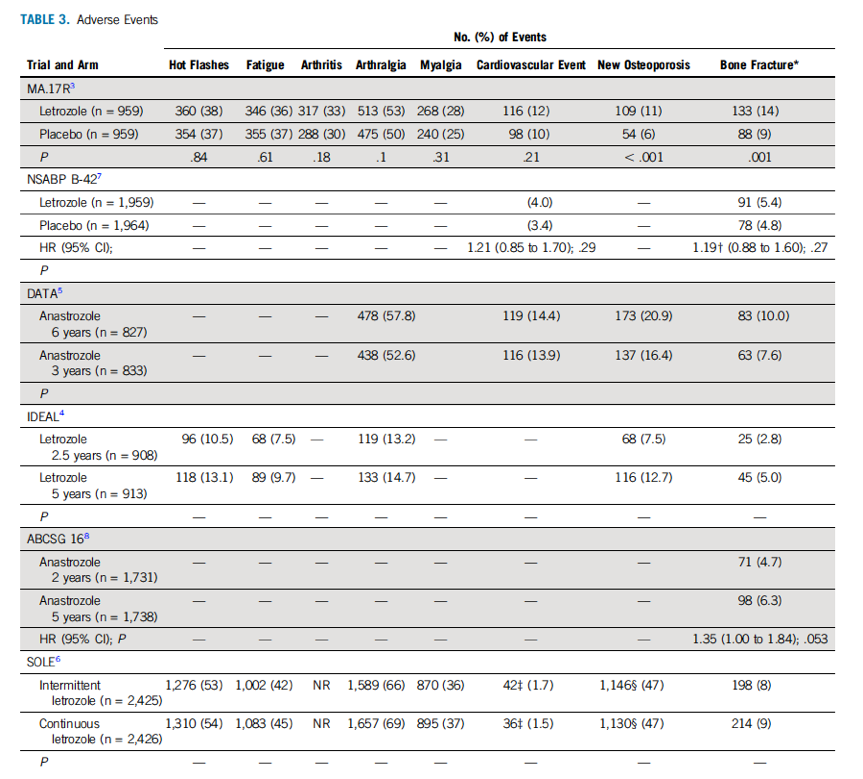
DFS
DFS是纳入的所有临床试验的主要研究终点,虽然各临床试验的DFS定义有所不同。MA.17R试验证实了延长内分泌治疗组比安慰剂组显著提高了患者5年DFS,其DFS的定义为从随机分组至出现复发(局部复发、区域复发、远处转移)或出现第二次原发乳腺癌的时间。根据分层因素(包括淋巴结状态、初始辅助化疗方案、AI结束与随机分组的时间间隔、试验前初始使用他莫西芬和AI的持续时间)调整的多变量分析结果显示延长内分泌治疗组的疾病复发风险、对侧乳腺癌风险或死亡风险降低了21%(风险比,0.79;95% CI,0.63 ~ 1.00;P = 0.05)。NSABP-42、DATA和IDEAL试验均显示了延长AI治疗组有更长的DFS,但没有达到统计学意义。ABCSG 16试验中10年和7年的辅助内分泌治疗并未察到DFS的差别。SOLE试验中并未发现间歇治疗10年与连续延长AI辅助治疗10年之间有DFS的差异。
对侧/二次原发乳腺癌发生间隔时间/OS
MA.17R试验报道延长AI 辅助内分泌治疗10年与安慰剂组相比,乳腺癌复发风险和对侧乳腺癌风险总体降低了34%(P = 0.01)。当仅考虑对侧乳腺癌年发病
率时,与随机分配至安慰剂组的女性相比,接受延长AI辅助内分泌治疗的女性发病率下降 58%。NSABP B-42试验中延长AI助内分泌治疗可显著改善无乳腺癌间隔时间,可减低乳腺癌复发风险或对侧乳腺癌风险29%,同时降低累积远处复发率28%。IDEAL试验发现延长内分泌可降低仅1%但有统计学意义的二次原发性乳腺癌的绝对风险,没有发现降低无远处转移间隔时间。ABCSG 16试验和SOLE试验中均未降低对侧乳腺癌发生风险。在6个临床试验中,延长AI 内分泌治疗还没有带来OS的获益。
生活质量
MA.17R试验中延长内分泌治疗组与安慰剂组相比,不论是采用36-项健康调查简表(36-Item Short Form Survey, SF-36)总分,大多数SF-36子量表得分,或是绝经后生活质量问卷(Menopause-Specific Quality of Life Questionnaire, MENQOL)症状分量表,并未发现两组间生活质量得分有明显差异。然而,当SF-36中考虑躯体角色功能时,跟安慰剂组相比,来曲唑组生活质量得分更低(P = 0.009)。在SOLE 试验中患者上报的前2年结果表明,与连续性AI辅助治疗相比,间歇性AI辅助治疗减少的身体健康状态、情绪和睡眠障碍恶化。然而,长期的健康相关生活质量数据尚未公布。
AEs
在纳入的6个临床试验中延长AI治疗可导致描述良好的AEs的增加。在 MA.17R试验中,延长AI内分泌治疗组比随机安慰剂组骨相关AEs的发生频率更高。其他临床试验中,延长AI内分泌治疗组也报道了更高骨质疏松性骨折发生率,绝对风险升高 0.6%~2.4%,但差异没有达到统计学意义。延长AI内分泌治疗组的动脉血栓事件的风险也呈增加趋势,但差异也没有达到统计学意义。没有发现其他的在统计上有显著差异的AEs的报告。最近的一项荟萃分析计算了随机分组到延长AI治疗与安慰剂或不治疗组之间AEs的发生率。延长AI治疗可增加心血管事件[优势比(OR,1.18;95% CI,1.00 ~ 1.40;P = 0. 05;产生较差结局的病例数(NNH),122],骨折(OR,1.34;95% CI,1.16 ~ 1.55;P < 0. 001;NNH,72),因AE中止治疗(OR,1.45;95% CI,1.25 ~ 1.68;P < 0. 001;NNH,21)。延长AI治疗第二恶性肿瘤发生率(OR, 0.93;95% CI,0.73 ~ 1.18;P = 0.56)和非乳腺癌复发死亡率(OR,1.11;95%CI,0.90 ~ 1.36;P = 0.34)。
研究讨论
辅助内分泌治疗是雌激素受体(ER)阳性乳腺癌系统性治疗的基石。然而,尽管完成5年的辅助内分泌治疗,ER阳性肿瘤仍有很高的后期复发风险;事实上,在当前的治疗下,诊断5年后比第一个5年内有更高的复发率。这种临床结局促使产生了多个延长(超过5年)内分泌治疗的临床试验。与后期复发相关的预后因素是相对明确的(表4),包括解剖分期(肿瘤大小,尤其是淋巴结状态)和特定的病理特征。更高的肿瘤分级(如肿瘤ER水平低表达)与低的肿瘤分级(如肿瘤ER表达水平高表达)相比后期复发风险更高。基因检测高风险分数也被证明是后期复发的预后因素。腔面A型肿瘤较腔面B型更少出现复发;21基因检测复发分数低或其他多种商业化基因检测评分低的肿瘤(表4)后期复发风险也较低。有趣的是,确诊后行内分泌治疗的ER阳性的乳腺癌其早期的复发风险是相同的。也就是说,高复发风险的肿瘤在确诊后的整个时间内其复发风险都是更高的,而且没有区分早期和后期复发模式的独特的标记物。
表4. 5年辅助内分泌治疗后复发进展风险
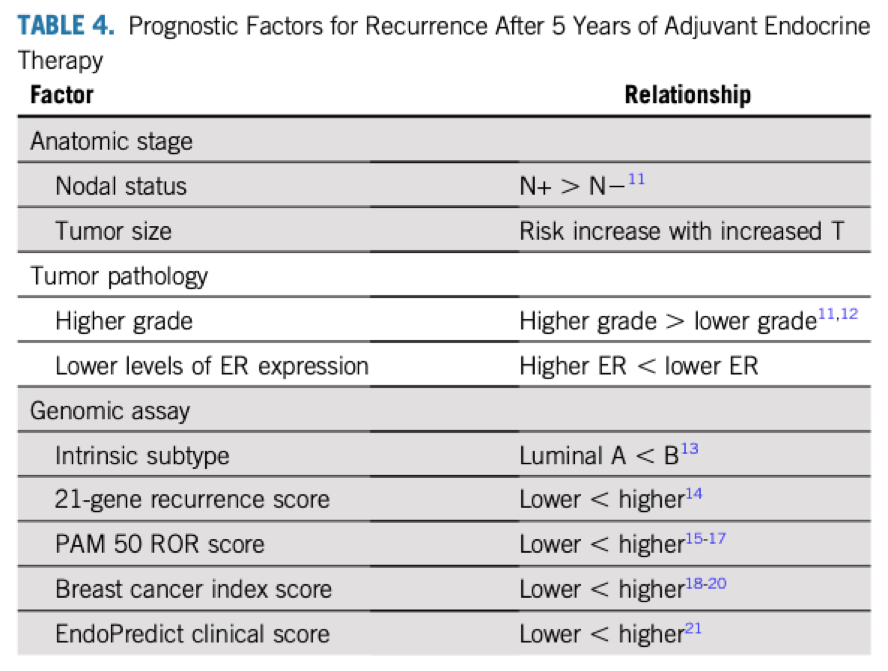
虽然超出治疗后5年仍存在复发风险,但这并不一定意味着更长时间的辅助内分泌治疗将减少乳腺癌复发风险从而改善患者乳腺癌患者的结局。随机研究表明,完成5年他莫昔芬治疗后继续延长内分泌治疗可减少女性乳腺癌复发风险。延长他莫昔芬治疗总时间至10年或更改为AI以延长内分泌治疗都可降低乳腺癌复发风险(图1)。基于这些证据,既往指南中对于有辅助内分泌治疗耐药或者较大后期复发风险的患者,专家小组已推荐使用以上两种方式的延长内分泌治疗方案。
一个尚未解决的临床问题是在首诊后第一个5年内接受AI辅助内分泌治疗的患者,延长辅助内分泌治疗的时长是否有获益。如果有获益,那么如何优化延长内分泌治疗的方案。临床实践证明AI成为绝经后女性乳腺癌常规使用的早期辅助治疗药物,即可以替代他莫昔芬也可以与他莫昔芬序贯使用。这种临床实践的转变意味着当很多女性完成了第一个5年的AI治疗后,新的临床试验数据需要解决内分泌治疗时长问题。在既往专家小组更新的指南中,没有足够的数据来解决这一问题。
目前有多个随机临床试验(图1)解决以下问题:对于初始已完成5年AI辅助治疗的女性乳腺癌患者来说,继续延长AI治疗是否会降低复发风险?NSABP B-42、 MA.17R和DATA试验均包含既往使用过AI并延长AI治疗的女性患者。在这些临床试验中,延长AI治疗可减少相对15%到20%的复发风险(HR,0.79 ~ 0.85),对平均复发风险患者可转化为2 %到4%的DFS获益。这些都是可计算的,并且差异不大。通过传统推算和亚组分析发现,延长AI内分泌治疗对于临床分期晚期复发风险较高的患者在降低复发风险方面获益更大,而对于复发风险较低的患者(通常为Ⅰ期患者)平均获益较少。
这些临床试验均支持一个普遍观点即与5年他莫昔芬相比,10年的他莫昔芬或者5年他莫昔芬后追加5年AI,可降低乳腺癌复发风险。基于各个临床试验之间的间接对比(图1),专家小组指出既往接受他莫昔芬治疗而后追加 AI 延长内分泌治疗的患者相对获益最高。相比之下,他莫昔芬单药延长内分泌治疗至10年或者既往接受0~5年的AI后延长AI治疗至10年的患者相对获益较少。这些间接比较的真正意义尚未知。但是可能预见的结果是在第一个5年和延长内分泌治疗中,AI为基础的内分泌治疗比他莫昔芬单药内分泌治疗有微弱但可重复的获益。基于这些发现,虽然治疗的最佳时间尚不清楚,但是专家小组再次推荐对于绝经女性患者应使用包含AI为基础的辅助内分泌治疗。对于AI治疗不能耐受的患者应该接受他莫昔芬的治疗。
相当大一部分的DFS改善来源于预防对侧乳腺癌的发生。因此,对于保留完整的乳房的女性患者而言AI治疗的效益更为明显。相比之下对于接受双侧乳房切除的患者而言,不存在二次乳腺癌的发生风险,延长AI治疗的获益则相对更少。
已经观察到与接受5年他莫昔芬治疗的患者相比,接受10年的他莫昔芬或5 年他莫昔芬后追加5年AI治疗可以带来生存获益。但到目前为止尚无研究指出延长AI治疗可带来生存获益,这可能与事件发生率相对较低和随访时间不够有关。在延长他莫昔芬治疗的研究中发现延长治疗的获益具有时间依赖性,随访时间越长其减少复发和死亡率的获益越显著。在延长AI治疗的临床试验中也观察到了相同的非线性风险下降,所以需要强调长期随访才能充分评估延长治疗的获益。尽管如此,由于缺乏生存获益的报道,在讨论是否采用延长内分泌治疗决策时要权衡风险和获益。
研究也关注了AI治疗中常见但持久性的治疗相关的AEs。这些AEs包括雌激素匮乏的相关症状(表3)比如潮汗/盗汗、关节痛、肌痛和性功能障碍。多年来许多研究表明,这些症状对乳腺癌幸存者的生活质量有决定性的影响,并导致更差的治疗依从性。延长AI治疗尤其值得关注的是骨骼健康问题。多项临床试验表明,随着 AI治疗时间延长,新发骨质疏松症或骨折发生率有显著差异(表3)。从绝对值角度看,处于低风险或者平均风险的乳腺癌患者中,骨折风险的增加几乎等同于乳腺癌复发风险的降低。在接受AI治疗的女性中,诸如监测骨质密度和使用骨修饰剂等干预措施可以降低AI治疗中骨质疏松症或骨折的发生率。然而,在AI延长治疗的临床研究的某些时间点和人群中这些干预措施已被广泛使用,但尽管如此骨折和骨质疏松症发生率仍然很高。
另有临床试验(图1)探索以下问题:哪些患者需要延长AI治疗,延长内分泌治疗的最佳时长是多长时间?ABCSG 16试验和IDEAL试验对比了7~7.5年与 10年的延长内分泌治疗。SOLE试验中总治疗时间为10年,与持续性治疗相反,间断性治疗在治疗第 5-9年来曲唑连用9个月停药3个月。在复发事件和对侧乳腺癌发生率上,这些试验均未显示出有统计意义的显著差异。这些数据表明,AI治疗的持续时间超过 5 年存在潜在的临床获益,但超过7或8年的之后的获益可能会很小。低复发风险或平均复发风险的患者可放弃最后1-2年的延长治疗,因为这段延长治疗不太可能改善他们的长期预后。
权衡AI延长治疗的获益和风险后,专家小组提出了以下建议。这些建议适用于既往接受AI治疗或者初始5年作为辅助治疗的绝经后女性患者,因此与延长治疗的临床试验人群相一致。正如前面提到的,专家小组建议已完成5年他莫昔芬治疗的患者应该接受他莫昔芬或者AI的延长内分泌治疗。
1. 对于多数淋巴结阴性的女性乳腺癌患者,有基于预后因素所建立的复发风险者应考虑10年的延长辅助内分泌治疗。使用“多数”一词是强调并非所有的淋巴结阴性乳腺癌患者能在延长AI治疗中获益。对于淋巴结阴性的女性乳腺癌患者而言,T分期、组织学分级和基因组特征均是已知的5年内分泌治疗后复发的风险因素。专家小组对于高复发风险的淋巴结阴性患者,包括肿瘤T2/T3或肿瘤T1c伴高复发风险的患者推荐延长内分泌治疗。这一推荐是建立在更高潜在复发的风险会转化为更大临床效益的假设基础上的。延长治疗的选择参见概要列表框中。
2. 相反,专家小组认为对于肿瘤T1a / T1b或肿瘤T1c伴低复发风险的女性乳患者,5年AI治疗已足够。这一推荐也是建立在更低潜在复发的风险会转化为更小临床效益的假设基础上的。对于低复发风险的T1ab女性患者,专家小组建议选择5年他莫昔芬或者以AI为基础的治疗方法。
专家小组指出目前尚没有延长辅助治疗的临床试验根据组织学分级或者基因标记对患者进行分层,只有一项研究采用了基因检测作为延长辅助治疗的预后标记物。然而,专家小组认为回顾性研究中所建立重要的预后因素,包括分期、组织分级和基因特征(表4)均可以作为早期和后期复发风险评估强有力的风险分层因素,并根据这些预后因素制定延长AI治疗的决策。在某种程度上,这些决策也说明对于早期癌症而言延长治疗的临床获益有限,也没有观察到生存获益。专家小组预计这些数据将在未来会帮助组织学分级和基因检测作为延长辅助治疗的预后指标。
3. 对于淋巴结阳性的女性乳腺癌应接受包括AI在内的10年的延长辅助内分泌治疗。专家小组认为在权衡持续的AEs治疗风险下,延长治疗可明确降低高复发风险淋巴结阳性乳腺癌患者的复发风险。专家小组同时指出伴有少量淋巴结转移(如1~2枚淋巴结阳性)的患者临床预后相对较好,临床医生和患者可权衡患者个体化的AEs、治疗耐受性以及其他的预后因素(表4)合理放弃延长治疗。延长治疗的首选方案包括10年的AI,或2~3年的他莫昔芬后接着7~8年的AI,或5年他莫昔芬后或接着5年的AI。在既往的指南中,对于绝经前女性、不能耐受AI或不愿意选择AI为基础治疗的绝经后女性,专家小组建议选择10年的他莫昔芬治疗方法。
4. 延长辅助内分泌治疗的女性应接受不超过10年时长的治疗;数据显示超过 10 年治疗获益非常少故而不推荐。现在有多个探索治疗时长为10年的临床试验,包含他莫昔芬单药或AI单药或基于他莫西芬治疗后AI治疗。这些研究为10年的治疗目的提供了坚实的证据。目前MA.17R试验是唯一一个探索更长内分泌治疗时间的研究,该试验中70%的患者接受了超过10年的治疗。专家小组特别指出的是即便从初诊开始接受AI治疗,目前也没有使用AI治疗超过10年的数据。考虑这些局限性和有限的临床获益,专家小组建议10年作为常规的治疗时长。
有两个临床试验对比了较短时间的延长治疗和较长时间的延长治疗。在这两个试验中,女性患者在接受初始5年辅助内分泌治疗后再接受2~2.5年或者5年的AI 延长治疗。这些临床试验并未发现疾病复发率差异,但是IDEAL研究中延长 2.5 年治疗组在数值上有更低的复发风险率。SOLE试验比较了间歇性和连续性延长AI 治疗并且发现两者的DFS无差别。不过,连续性延长AI治疗组再次在数值上有更低的复发风险率。鉴于这些研究结果和10年治疗的潜在临床获益,专家小组通常推荐总持续时间10年的治疗。然而,专家小组认为这些前瞻性研究也表明将10年治疗缩短为8年治疗也并没有降低治疗的获益。专家小组认为这些数据为患者和临床医生采用7年或8年的治疗而不是10年治疗以及治疗中断几个月后再恢复提供了安全保障,且对于平均复发风险的患者的长期预后并没有造成影响。
辅助内分泌治疗的依从性已被广泛研究。众所周知,很大一部分患者会因AEs、个人倾向以及药物可及性的原因缺乏辅助内分泌治疗的依从性。专家小组鼓励临床医生关注依从性的问题,减轻影响依从性的症状或障碍,鼓励患者接受医生提供的或者临床试验中提供的药物。来自SOLE、IDEAL和ABCSG 16试验的结果表明,在延长内分泌治疗时少许的非依从性问题可能并不影响临床获益。因此,患者和临床医生对此不必担心。
5. 专家组强调,当需要与患者讨论关于延长AI治疗的决策时,需要在与患者共享以下因素的基础上做出决定,包括患者本人的复发风险、治疗经历、第一个5 年治疗期间的耐受性、预防同侧或者对侧二次乳腺癌可能的获益、缺乏已知的延长 AI 单药治疗的生存获益。专家组指出,由于所有考虑延长AI治疗的女性患者都已经历了数年的抗雌激素治疗,她们应当熟知延长治疗对她们的症状和生活质量的影响。AI治疗既可带来确切的健康问题如骨质疏松症和骨折,也可带来明确影响身体健康的症状如更年期症状、性功能障碍、脱发、关节痛。对于这些治疗已带来严重负担或对生活质量造成显著的负面影响的女性患者而言,需要权衡降低复发风险和持续不良事件之间的利弊。对于骨质疏松/骨折高风险的女性患者而言,权衡延长 AI 治疗的优缺点后可能难以做出抉择。尽管女性乳腺癌患者已接受了5年的治疗但仍有较高的复发风险,因此延长治疗可能会带来更大的生存获益。延长治疗的获益出现很慢但持续时间很长;大多数试验表明,只有在延长4年或更长时间后才能出现可测量的差异。因此,那些预期寿命实际上并不包括在这个时间范围内的患者,不太可能从延长内分泌治疗中获益。
6. 对于有对侧或二次乳腺癌发生危险的女性患者更可能从延长AI治疗中获益(图 1),专家组建议对于这部分女性患者无论初始病情分期如何均建议考虑延长 AI治疗。多项延长AI治疗的研究表明,延长AI治疗可将二次乳腺癌发生相对风险降低至少50%,这相当于约5年随访复发风险在数值上降低1%~2%。使用他莫昔芬或AI的抗雌激素治疗与既往内分泌辅助治疗研究中的风险降低相一致。相反,对于乳房切除术特别是双侧乳房切除术作为其治疗计划的一部分的女性而言,不会通过延长AI治疗降低二次乳腺癌的发生而获益。这种个性化的获益/风险评估可预测可能的首选治疗方案。
研究总结
ER阳性乳腺癌患者尽管接受5年的辅助内分泌治疗,但后期仍有复发的风险。多种延长(超过5年)治疗策略已被证明可降低复发风险并降低对侧乳腺癌风险。根据前瞻性随机临床试验的数据,ASCO辅助内分泌治疗专家小组建议采用以下任一延长治疗的策略:10年AI;他莫昔芬2~3年,随后AI 7~8年;他莫昔芬5年,随后AI 5年;他莫昔芬10年。
延长治疗会出现持续的治疗相关的不良事件,这些不良事件可能影响患者的生活质量或增加其他健康问题的风险。基于这些原因,并且由于延长治疗对于一般复发风险患者来说降低复发风险的绝对获益较小,临床医生和乳腺癌患者必须根据患者癌症分期、后期复发风险以及患者迄今为止所经历的治疗耐受性和不良事件来制定个体化的治疗决策。对于有已知预后因素(淋巴结受累、较大的肿瘤和其他不良预后特征)复发风险高的女性患者,更有可能从延长治疗中获益,因此应接受长达 10年的内分泌治疗。对于后期复发风险较低的女性(通常患有较低复发风险特征的Ⅰ期疾病),除非是为了预防后期复发和/或对侧/二次乳腺癌的强烈目的,5年治疗后可合理停止治疗。患者个人倾向、共享决策过程、告知潜在获益大小和治疗相关风险,对决定治疗5年后是否延长治疗至关重要。临床团队应该帮助患者缓解延长治疗的症状,以确保期望接受内分泌治疗的患者可以获得相应的治疗。
汪成教授精彩点评
既往美国SEER数据库,国际乳腺癌研究组(IBCSG)的数据以及早期乳腺癌试验协作组(EBCTCG)的数据均说明5年内分泌治疗后激素受体阳性(HR+)早期乳腺癌患者复发转移风险依然存在。为了进一步降低内分泌治疗5年后患者的复发转移风险,延长内分泌治疗的试验应运而生。
是否需要延长内分泌治疗?如何延长内分泌治疗?哪些患者需要延长内分泌治疗?关于这些问题,多年来从未停止过研究。随着新的循证医学证据的不断涌现,我们的临床实践也在逐渐改变,与此同时又带来更多新的问题。
辅助内分泌治疗的药物及时长的变革
2005年发表在《柳叶刀》(The Lancet)的一项荟萃研究表明,他莫昔芬(TAM)辅助内分泌治疗可以显著降低HR+早期乳腺癌的复发风险和死亡率。但完成5年辅助他莫昔芬治疗的患者的复发率和死亡率仍然很高,分别为33.2%和25.6%。随着芳香化酶抑制剂(AI)时代的到来,BIG-198,ATAC,TEAM三项大型Ⅲ期临床研究显示,与TAM相比AI可进一步降低绝经后HR+患者的复发风险。AI成为绝经后HR+早期乳腺癌辅助内分泌治疗的标准用药。到此,临床普遍的辅助内分泌治疗方案为:绝经前患者TAM 5年;围绝经期患者TAM+AI 5年;绝经后患者AI 5年。
为了进一步降低HR+早期乳腺癌的远处复发转移风险,延长内分治疗成为临床上较受认可的强化内分泌策略。TAM治疗5年后的TAM治疗研究:ATLAS和aTTOM试验一致提示10年TAM辅助治疗具有长期生存获益。既然5年AI和10年TAM均具有一定的获益,那么两者结合是否疗效更佳?TAM治疗5年后的AI治疗研究:MA.17,NSABP B-33以及ABCSG-6a均提示5年TAM治疗后序贯3-5年AI获益。到此,临床普遍的辅助内分泌延长治疗方案为:绝经前患者TAM 5年后TAM延长治疗5年;围绝经期患者TAM 5年后AI延长治疗5年。
相应地,绝经后HR+早期乳腺癌内分泌延长治疗方案又该如何?是否AI治疗5年后延长至10年?是否可仅延长AI至7年或8年?是否延长AI治疗可间断性用药?接受包括AI在内的内分泌治疗后延长AI治疗:MA.17R,NSABP B-42,DATA,IDEAL,ABCSG 16,SOLE,AERAS以及今年2019ASCO报道的GIM4研究,正是试图回答这一系列的问题。
常言道,这世界并没有一蹴而就的事情,我们都要做好长跑的准备,乳腺癌辅助内分泌治疗的革新与优化也不例外。多年来,有关乳腺癌辅助内分泌治疗的重大临床研究结果相继公布,各大指南和专家共识也就相关内容做出相应更新。其中最为核心关键的问题就是辅助内分泌治疗药物的选择和疗程。由TAM到AI,从5年到10年,变革随着时间的轨迹向前推移,同时也让辅助内分泌治疗这把利刃的轮廓愈渐清晰。乳腺癌辅助内分泌治疗的下一站又将如何?路漫漫其修远兮,学术界将上下而求索。
个体化而非全或无的治疗模式
虽然绝经前患者TAM 5年后TAM延长治疗5年可以进一步降低远处复发转移风险,但是长期使用TAM,仍然存在子宫内膜癌、血栓性疾病等患病风险的增加。为此,如何准确的筛选获益人群、定期检测子宫内膜厚度、评估月经状态、是否联合卵巢功能抑制(OFS)等,成为个体化TAM延长治疗不得不深入探索的问题。今年ASCO会议报道了Trans-aTTom研究,该研究皆在应用乳腺癌指数(BCI(H/I))预测TAM辅助延长内分泌治疗HR+乳腺癌患者的生存获益。研究表明,BCI (H/I)-高的N+亚组患者使用TAM治疗10年对比5年的获益具有显著性差异,而BCI (H/I)-低的N+亚组患者显示TAM额外5年延长治疗的获益无统计学意义。
本次ASCO的系统评价共纳入了6个Ⅲ期RCTs临床试验,每一个研究都探讨了超过5年的AI辅助内分泌治疗对绝经后HR+早期乳腺癌的获益。这些临床研究均未证实超过5年以上的AI辅助内分泌治疗可以带来OS的获益。但是,延长AI治疗可显著降低乳腺癌复发风险和对侧二次原发乳腺癌的发生风险。然而,延长AI治疗也不可避免的增加了骨质疏松和骨折的发生,以及更年期症状、脱发、关节痛、性功能障碍。为此,ASCO专家小组对绝经后HR+早期乳腺癌的延长AI治疗给予了个体化的推荐:①对于淋巴结阴性的低危患者,不建议常规延长AI内分泌治疗;②对于多数有预后因素所建立的复发风险的淋巴结阴性的患者,可个体化的考虑延长AI治疗至10年,需权衡复发风险获益与药物副反应两方面的综合因素,必要时可与患者共同讨论决定;③对于淋巴结阳性的患者,建议延长内分泌治疗至不超过10年。
已有研究提示,延长乳腺癌内分泌治疗与常规5年内分泌治疗相比,虽然更多的乳腺癌得到了临床治愈,但患者总体的生存并没有延长!这种延长治疗最终成为了零和干预!2017年发表在《美国医学会杂志:心脏病学》(JAMA Cardiology)的研究显示,仅一半乳腺癌患者死于乳腺癌本身。为此,我们不得不均衡延长内分泌治疗的复发风险获益和药物副反应。到底延长内分泌治疗治疗是敌是友?一时间,我们似乎陷入了“囚徒困境”的博弈论之中。亦或许,当初的延长只是枉然。因此,在患者实施延长内分泌治疗过程上,且行且珍惜。
谨慎解读新的临床试验和数据
就在本篇指南更新发布之余,有关HR+早期乳腺癌延长AI治疗的研究进展使得这个话题再次引起热议。2018年12月SABCS大会上公布的一项延长AI治疗(5年AI后,序贯5年AI或停止用药)的Ⅲ期AERAS研究表明,10年AI治疗组DFS获益可达7.5%(91.9% vs. 84.4%,HR = 0.548,P = 0.004)。仔细分析,我们不难发现约4%的DFS获益来自于降低乳腺癌复发转移风险,而其余的3%的DFS获益主要来自于第二非乳腺癌原发肿瘤的减少。然而,预防非乳腺癌的这部分DFS获益的真正价值目前尚不明确。因此,整体数据呈阳性结果的AERAS研究还需谨慎解读和进一步深入探讨。
2018 SABCS同期还公布了一项EBCTCG荟萃分析。这项荟萃分析共纳入了12项随机试验、2万余例患者。结果提示,5年TAM治疗后绝经的HR+早期患者,延长5年AI治疗可降低35%的复发风险;5年TAM序贯AI或5年AI治疗后绝经的HR+早期患者,延长3~5年AI治疗可降低20%的复发风险。就绝对获益而言:①延长内分泌治疗与不延长相比,仅能够降低2.5%的乳腺癌复发事件;②5~10年的TAM和AI联合或者序贯治疗仅能够降低2.1%的乳腺癌复发事件;③5年AI后再延长AI治疗仅能够降低1.2%的乳腺癌复发事件。总之,这些绝对获益都是比较低的,这也提示我们真正能够从延长内分泌治疗中获益的人群仅占一部分,并非所有HR+早期患者都适合延长内分泌治疗。
在今年ASCO会议上公布了一项来自意大利乳腺癌小组(GIM)序贯内分泌治疗后来曲唑延长辅助治疗的随机、Ⅲ期临床研究。该研究共入组2056例患者(对照组1030例,延长治疗组1026例),主要研究终点为无浸润性疾病生存(iDFS),次要研究终点为总生存(OS)和不良事件。研究结果显示,2~3年他莫昔芬治疗后,序贯来曲唑5年较来曲唑2~3年可降低19%的iDFS事件(HR = 0.81;0.65 ~ 1.00;P = 0.051)。该研究结果提示,存在乳腺癌复发风险的患者可考虑使用2~3年他莫昔芬序贯5~6年AI的治疗方案。
世界上没有两片完全相同的树叶,更没有完全相同的两个临床试验。我们可以看到,尽管都是探索乳腺癌延长辅助内分泌治疗的临床研究,但研究有设计不同,入组人群也存在差异,其得到的结论也不一甚至还互相矛盾。这也给我们指定临床决策造成了困难,荟萃分析似乎可以冲淡这些可能的缺陷,但依然无法做到完美诠释。正如同跋山涉水,横看成峰侧成岭,远近高低各不同。
未来的内分泌治疗之路
未来的延长内分泌治疗如何有的放矢应用于有适应症的人群做到精准治疗,将成为临床实践中的重要问题。把传统临床病理指标如患者年龄、淋巴结状态、肿瘤分级、肿瘤分期等与先进的基因及分子检测手段项结合,将有助于充分评估患者复发转移风险,尤其是远期复发风险之于延长内分泌治疗的意义。此外,延长内分泌治疗依然无法回避内分泌耐药的问题。随着靶向药物的不断兴起,内分泌联合靶向药物是否可以减少内分泌耐药,进一步降低HR+早期乳腺癌的复发和死亡风险正在不断积极探索中。
Burstein Harold J, Lacchetti Christina, Griggs Jennifer J, et al. Adjuvant Endocrine Therapy for Women With Hormone Receptor-Positive Breast Cancer: ASCO Clinical Practice Guideline Focused Update.[J] .J Oncol Pract, 2019, 15: 106-107.
精彩回顾
【新见】徐莹莹教授&邢鹏教授:剂量密集型化疗在靶向治疗时代的价值
【新见•ASCO特刊】余科达教授:NSABP乳腺癌研究60年奥德赛之旅
【新见•ASCO特刊】郑亚兵教授:PALOMA-3:ER+晚期乳腺癌患者在氟维司群联合/不联合哌柏西利治疗中早期进展的基因组标记物
【新见•ASCO特刊】叶松青:GeparOLA Ⅱ期临床研究: 奥拉帕利联合紫杉醇对比紫杉醇/卡铂并序贯表阿霉素/环磷酰胺用于HRD阳性,HER2阴性的早期乳腺癌患者新辅助治疗的疗效
【新见•ASCO特刊】史艳侠教授:TALA in Breast Cancer
【新见•ASCO特刊】李兴睿教授:晚期乳腺癌患者的手术意义探讨
【新见•ASCO特刊】徐莹莹教授:探寻阿喀琉斯之踵--乳腺癌诊疗四十年
【新见•ASCO特刊】陈前军教授&许锐教授:HER2阳性乳腺癌的升阶治疗和降阶治疗的热点
【新见•ASCO特刊】宋东教授:精准诊疗时代乳腺癌治疗亟需生物标志物的精准选择
【新见】马力教授:Aplelisib 治疗激素受体阳性、PIK3CA突变的晚期乳腺癌
【新见】吕志栋教授:HER2阳性早期乳腺癌4年DFS数据更新:6个月曲妥珠单抗辅助治疗疗效并不劣于12个月
【新见】张聚良教授:CBCSG-036研究-内分泌联合新辅助化疗显著提高ER阳性HER2阴性患者的ORR
【新见】唐鹏教授:绝经后HR+/HER2-转移性乳腺癌一线或二线治疗——内分泌为基础治疗较化疗更优
【新见】黄亮教授&兰波教授:CYPTAM研究——他莫昔芬的药物遗传学改变和活性代谢产物浓度不影响治疗结果












 苏公网安备32059002004080号
苏公网安备32059002004080号


