
第39例
在原发性乳腺癌患者中观察到有25%~30%的患者HER2基因过度表达,而HER2阳性型乳腺癌的肿瘤侵袭性更强,预后更差。抗HER2靶向治疗可以明显改善患者的预后,延长生命并提高生活质量。随着近年来的规范化治疗,越来越多的乳腺癌患者从中获益,本文通过回顾一个曲妥珠单抗治疗HER2阳性型乳腺癌多次复发后长期生存,总生存时间达16余年的病例,介绍目前有关该类患者的临床治疗思路。

舟山医院乳腺病诊治中心主任
吉林医药学院教授
中国整形美容协会肿瘤整复分会委员
UCOM浙江乳腺癌专委会常委
浙江省抗癌协会乳腺癌专业委员会委员
浙江省免疫学会临床分会委员
中国医药教育学会乳腺疾病专业委员会委员

浙江省舟山医院乳腺外科副主任
从事肿瘤外科以及乳腺外科工作近20年
浙江省医学会肿瘤学青年委员
病例简介
患者为中年女性,2002年6月12日行右乳腺癌改良根治术。术后病理:右乳浸润性导管癌,脉管内见癌栓,肿块大小2.5cm×2.0cm×1.4cm,淋巴结6/13癌转移。免疫组化:ER(+),PR(+),HER2(++), Ki-67情况不详,FISH未做。2003年行左侧卵巢切除+右侧卵巢囊肿剥除术+子宫次全切除。诊断:右乳浸润性导管癌(pT2N2M0,ⅢA期,HR阳性HER2未知)。术后使用CEF方案化疗6周期后放疗、内分泌治疗。
第一次复发
2006年6月发现右侧胸壁结节,活检示:胸壁复发。未评估免疫组化。影像学检查未发现肺、肝、骨等部位转移证据。
无病生存期(DFS)为4年。
一线解救治疗
吡柔比星+多西他赛治疗6周期+再程胸壁放疗;内分泌治疗改为依西美坦。疗效评估:完全缓解(CR)。
第二次复发
2008年9月1日(术后第6年)因右侧腋下(Roter)淋巴结肿大,行右侧腋下淋巴结补充清扫术,切除标本证实为右侧腋下淋巴结转移3/3,切除标本未评估免疫组化。
肿瘤无进展生存(PFS)1为27个月。
二线治疗
吉西他滨+卡铂化疗6周期,化疗结束后影像学评估CR。
第三次复发
患者于2012年3月21日因“左腋下淋巴结肿大”行左腋下淋巴结活检术,病理示:左腋下淋巴结考虑乳腺癌转移。免疫组化:Ki-67(+,30%),ER(2+),PR(+),HER2(2+)。上海某院病理会诊结果:左侧腋下淋巴结转移性腺癌2/6,形态符合为浸润性微乳头状癌。复核免疫组化:ER(-),PR(-),HER2(3+);FISH阳性。
诊断:右乳癌(pT2N2M0,ⅢA期)术后化放疗后胸壁、右腋窝淋巴结、左腋窝淋巴结转移。分子分型:HR-/HER2+型。
PFS2为3年7个月。
三线治疗
患者于2012年4月起使用曲妥珠单抗联合卡培他滨,14个月后停用卡培他滨。
定期复查随访。2013年3月复查超声,结果示:左侧乳腺增生,左侧腋下可见淋巴结。复查心脏超声,结果示:三尖瓣轻微反流,左室舒张功能减弱,左心收缩功能未见异常。2014年8月复查超声,结果示:右乳术后,左侧乳腺增生,左侧腋下可见淋巴结。心脏超声结果示:三尖瓣轻微反流,左室舒张功能减弱,左心收缩功能未见异常。2015年8月复查超声,结果示:右乳术后,左侧乳腺增生,左侧腋下可见淋巴结。2017年2月复查心脏超声,结果示:左室舒张功能减弱,右乳切除术后,左侧腋下小淋巴结。2019年2月15日复查超声,结果示:右乳切除术后,左侧腋下小淋巴结。2019年2月16日,复查心脏超声,结果示:左室略增大,三尖瓣少量反流,左室舒张功能减弱,左心收缩功能未见异常。至今曲妥珠单抗使用已经6年11个月(患者体重波动在72.5~74 kg)。
至今PFS3为6年11个月。
总生存时间为16年9个月。
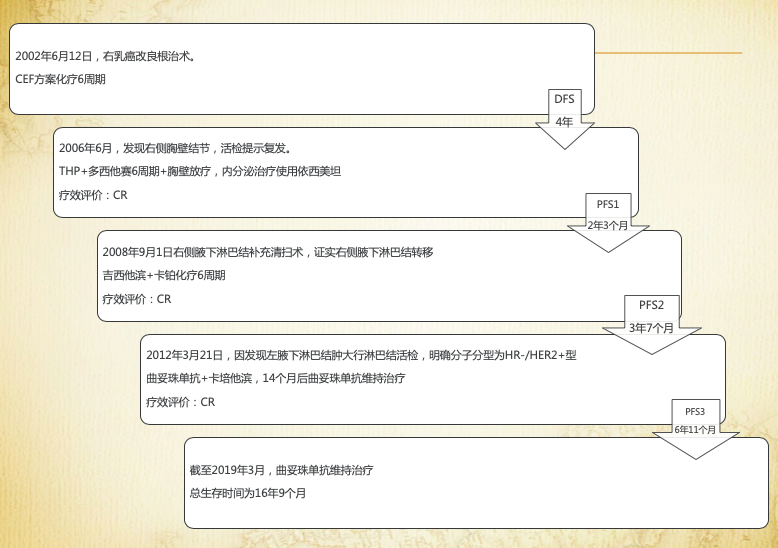
患者治疗历程图
点评专家

复旦大学附属肿瘤医院肿瘤内科行政副主任
上海市肿瘤化疗质控中心秘书
中国抗癌协会乳腺癌专业委员会委员
CSCO乳腺癌专家委员会委员
CSCO肿瘤支持与康复治疗专家委员会常务委员
CSCO青年专家委员会委员
中国研究型医院协会乳腺专业委员会青委会副主任委员
中国研究型医院协会乳腺专业委员会常务委员
上海市抗癌协会癌症康复与姑息治疗专业委员会常务委员
上海市抗癌协会青年理事
国家食品药品监督管理总局药品评审中心首批化药临床兼职审评员
JCO 中文版(泌尿男生殖系统肿瘤专刊)编委
Precision Cancer Medicine 青年编委
《中华乳腺病杂志》中青年编委
《中国癌症杂志》青年编委

复旦大学附属肿瘤医院肿瘤内科
点评
患者为年轻女性,发病年龄36岁,未绝经。该患者2002年初诊右乳癌,予以右乳癌改良根治术,术后病理:右乳浸润性癌非特殊类型,脉管内见癌栓,肿块大小2.5cm×2.0cm×1.4cm,淋巴结6/13癌转移。免疫组化:ER(+),PR(+),HER2(++),Ki-67情况不详,FISH未做。根据手术及术后病理结果,诊断为右乳浸润性癌术后(局部晚期pT2N2M0,ⅢA期,未明确分子分型)。经治疗后多次复发,第三次复发时进行转移灶的免疫组化分析,确定分子分型改变后加用曲妥珠单抗,目前总生存时间已达16年9个月,获益明显,目前未见复发转移,长期无瘤生存。
1.病理分子分型对治疗具有指导意义,应予以重视
该患者术后病理提示HER2(++),但未行FISH/CISH检验,未知HER2状态。而早期乳腺癌的辅助治疗策略,主要根据HR和HER2受体状态来决定,进而错失了抗HER2治疗这一重要环节。根据《乳腺癌HER2检测指南(2019版)》[1]和《人表皮生长因子受体2阳性乳腺癌临床诊疗专家共识2016》[2],HER2 免疫组化结果判读为IHC(++)者,表示HER2 结果不确定,应进一步通过FISH/CISH等方法进行HER2 基因状态检测。但这对于当时的技术条件及药物可及性来说也是可以理解的。
根据临床及术后病理,该患者存在的危险因素有:浸润性癌非特殊类型,脉管内见癌栓,肿块大小2.5cm×2.0cm×1.4cm超过2cm,脉管内见癌栓,淋巴结6/13癌转移≥4个转移,HER2(++),发病年龄36岁。术后复发风险分组为高危组。对于术后复发风险分组为高危组的患者,根据《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南》、NCCN指南,治疗上均建议予以紫杉类+±蒽环类联合方案治疗。根据CALG B9344[3]和NSABP B28[4]这两个临床试验,对淋巴结阳性的乳腺癌患者,在蒽环类的基础上加入紫杉类药物可显著提高疗效;ECOG 1199[5]研究进一步提示多西他赛三周方案和紫杉醇每周方案比紫杉醇三周方案疗效更佳;BCIRG 001[6]试验则提示在淋巴结阳性患者中TAC方案相比FAC方案可显著降低复发风险和死亡风险。以上临床研究均提示高危组患者应联合紫杉类与蒽环类,该病例仅仅使用CEF方案治疗,早期治疗不够充分。同时,患者首诊治疗时HR判断为阳性,根据《中国早期乳腺癌卵巢功能抑制临床应用专家共识(2018年版)》[7]中绝经前患者辅助内分泌治疗的方案,年龄小于等于35岁、淋巴结4个及以上阳性的患者建议予以卵巢功能抑制(OFS)+TAM/AI等加强内分泌治疗。EBCTCG的荟萃分析[8]提示,年龄小于50岁,尤其是未做化疗者,卵巢去势治疗可改善长期生存及无复发生存。根据2017年SABCS会议上SOFT、TEXT新的随访结果,他莫昔芬基础上加入OFS可显著改善DFS,同时OFS联合依西美坦的DFS较OFS联合他莫昔芬组显著改善。但患者未进行辅助内分泌治疗,为术后复发埋下了隐患。
后续的第一次、第二次复发后,均未进行免疫组化,仅根据第一次免疫组化结果判断分子分型,予以姑息化疗及内分泌治疗等,依然存在治疗不足的的缺陷。最后一次复发后进行穿刺活检,病理会诊的结果提示分子分型的改变,转化为HR-/HER2+型,患者后续予以抗HER治疗后获益明显,第三线治疗的PFS长达6年11个月,证明明确分子分型后抗HER2治疗的重要性。已有的研究[9]也证明,肿瘤细胞接受辅助治疗的干预,或经历一定时间的生长过程,可能会出现受体表达状态的改变,而这种受体表型的改变将直接导致治疗策略的改变。国内有医院[10]比较分析了432例乳腺癌原发灶和转移灶的受体状态,发现ER、PR、HER2 免疫组化的转化率达到30%、38.7%、8.1%。由此可见,准确全面的分子分型是治疗的基石,复发转移后的肿物活检应加以重视,避免出现治疗不足的缺陷。
2.抗HER2治疗是HER2阳性乳腺癌患者治疗成功的关键
患者第三次复发转移后,病理会诊提示:左侧腋下淋巴结转移性腺癌2/6,形态符合为浸润性微乳头状癌。复核免疫组化:ER(-),PR(-),HER2(3+),FISH(+)。提示分子分型为HR-/HER2+型。
《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南》2018V1版指出:对于既往未接受过曲妥珠单抗辅助治疗的HER2阳性复发转移性乳腺癌,以曲妥珠单抗为基础联合化疗的方案是这部分患者晚期一线治疗标准方案。H0648g[11]和M77001[12]研究证实在紫杉类基础上联合曲妥珠单抗治疗能够显著提高PFS和OS,确立了曲妥珠单抗联合紫杉类在一线标准治疗的地位。CHAT研究[13]证实,对于能够耐受双药化疗的患者,曲妥珠单抗联合多西他赛加卡培他滨,比曲妥珠单抗联合多西他赛效果更好,尤其适用于考虑维持治疗的患者。曲妥珠单抗联合紫杉醇加卡铂,疗效优于曲妥珠单抗联合紫杉醇。而CLEOPATRA研究[14]则证实,相较于曲妥珠单抗+多西他赛而言,帕妥珠单抗+曲妥珠单抗+多西他赛延长了PFS(18.5月 vs 12.4月, P=0.0001)与OS(56.5个月 vs 40.8个月, P=0.0002)。目前帕妥珠单抗已在国内上市,一线治疗也可考虑双靶方案。
《HER2阳性乳腺癌临床诊疗专家共识》[2]指出:紫杉类化疗药物治疗失败的HER2阳性乳腺癌,可以使用曲妥珠单抗联合长春瑞滨[15]、铂类、卡培他滨[16]、吉西他滨[17]等其他化疗药物。研究中指出[16],曲妥珠单抗+卡培他滨联合治疗的中位OS为6.9个月。根据《中国晚期乳腺癌维持治疗专家共识》[18],接受规范的一线化疗(通常 6~8 个周期)后达到疾病控制(包括完全缓解、部分缓解和疾病稳定)的晚期乳腺癌患者,通过延长药物治疗时间,控制肿瘤进展,达到缓解症状,改善生活质量,提高PFS的目的。化疗停止后,建议继续曲妥珠单抗维持治疗。
3.本病例治疗的经验
本病例治疗获益明显,治疗是成功的。由治疗经过可知,明确分子分型后及时予以抗HER2治疗为成功的关键,生存获益较长,但也有遗憾与不足的地方。首诊为ⅢA期,局部晚期,治疗上加用新辅助治疗或许可得到更明显的获益。而术后辅助化疗强度不够、未使用内分泌治疗等治疗不够规范,可能影响患者获益。复发转移后未及时进行转移病灶的病理免疫组化进一步明确分子分型,也导致了后续一线、二线治疗的不足。本例患者转移部位依次为胸壁、右腋窝淋巴结、左腋窝淋巴结,不排除存在局部治疗不足的可能,而转移部位少、肿瘤负荷低或许也是该病例治疗成功的因素之一。
总体而言,本病例治疗过程中虽然存在部分不足,但最后治疗的获益非常明显,该临床诊疗过程可供借鉴。
[1]《乳腺癌HER2检测指南(2019)》编写组.乳腺癌HER2检测指南(2019)[J].中华病理学杂志,2019,48(3):169-175.
[2]江泽飞,邵志敏,徐兵河,等.人表皮生长因子受体2阳性乳腺癌临床诊疗专家共识2016[J].中华医学杂志,2016,96(14):1091-1096.
[3]Henderson IC,Berry DA,Demetri GD, et al. Improved outcomes from adding sequential Paclitaxel but not from escalating Doxorubicin dose in an adjuvant chemotherapy regimen for patients with node-positive primary breast cancer [J].J Clin Oncol, 2003, 21: 976-983.
[4]Mamounas EP,Bryant J,Lembersky B ,et al. Paclitaxel after doxorubicin plus cyclophosphamide as adjuvant chemotherapy for node-positive breast cancer: results from NSABP B-28[J] .J Clin Oncol, 2005, 23: 3686-3696.
[5]Sparano JA,Zhao F,Martino S,et al. Long-term follow-up of the E1199 phase Ⅲ trial evaluating the role of taxane and schedule in operable breast cancer[J]. J Clin Oncol,2015,33(21):2353-2360.
[6]Martin M,Pienkowski T,Mackey J, et al. Adjuvant docetaxel for node-positive breast cancer[J] .N Engl J Med, 2005, 352: 2302-2313.
[7]中国抗癌协会乳腺癌专业委员会.中国早期乳腺癌卵巢功能抑制临床应用专家共识(2018年版)[J].中国癌症杂志,2018,28,(11):871-880.
[8] Early Breast Cancer Trialists' Collaborative Group (EBCTCG),Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an overview of the randomised trials[J] .Lancet, 2005, 365: 1687-1717.
[9]Amir E,Clemons M,Purdie C A et al. Tissue confirmation of disease recurrence in breast cancer patients: pooled analysis of multi-centre, multi-disciplinary prospective studies[J] .Cancer Treat,2012, 38: 708-714.
[10]王英哲,司文,杨俊兰.乳腺癌复发转移前后激素受体、HER-2表达的改变及其临床意义[J].解放军医学院学报,2015,36(08):769-772+844.
[11]Slamon D J,Leyland-Jones B,Shak S et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2[J] .N Engl J Med, 2001, 344: 783-792.
[12]Marty M, Cognetti F, Maraninchi D, et al. Randomized phase II trial of the efficacy and safety of trastuzumab combined with docetaxel in patients with human epidermal growth factor receptor 2-positive metastatic breast cancer administered as first-line treatment: The M77001 study group[J]. J Clin Oncol,2005;23(19):4265-4274.
[13]Wardley Andrew M,Pivot Xavier,Morales-Vasquez Flavia et al. Randomized phase II trial of first-line trastuzumab plus docetaxel and capecitabine compared with trastuzumab plus docetaxel in HER2-positive metastatic breast cancer.[J] J Clin Oncol, 2010, 28: 976-983.
[14]Baselga J,Cortés J,Kim SB et al. Pertuzumab plus trastuzumab plus docetaxel for metastatic breast cancer[J] .N Engl J Med, 2012, 366: 109-119.
[15]Papaldo P, Fabi A, Ferretti G, et al. A phase II study on metastatic breast cancer patients treated with weekly vinorelbine with or without trastuzumab according to HER2 expression: changing the natural history of HER2-positive disease[J]. Ann Oncol,2006,17(4):630-636.
[16]Harder J, Ihorst G, Heinemann V, et al. Multicentre phase II trial of trastuzumab and capecitabine in patients with HER2 overexpressing metastatic pancreatic cancer[J]. Br J Cancer, 2012,106(6):1033-1038.
[17]Yardley DA, Burris HA,Hanson S, et al. Weekly gemcitabine and trastuzumab in the treatment of patients with HER2-overexpressing metastatic breast cancer[J]. Clin Breast Cancer,2009,9(3):178-183.
[18]徐兵河,王树森,江泽飞,邵志敏.中国晚期乳腺癌维持治疗专家共识[J].中华普通外科学文献(电子版),2018,12(01):1-5.












 苏公网安备32059002004080号
苏公网安备32059002004080号


