目前食管癌仍全球高发,在我国食管鳞状细胞癌约占全部食管癌的90%。食管癌的治疗方式包括手术、化疗及放疗等,但遗憾的是即使多种治疗方法联用,多数患者最终仍会出现肿瘤复发或转移。近年来,放疗及免疫治疗的协同作用得到了学术界的广泛关注。最近,一项发表在《肿瘤免疫学杂志》上针对转移性食管鳞状细胞癌(mESCC)的前瞻性临床研究表明,立体定向放射疗法(SBRT)与胸腺肽α1(Ta1)联用可为患者带来生存获益。本期IO治疗时讯邀请中国医学科学院肿瘤医院惠周光教授和翟医蕊医生对该项研究进行点评。
研究背景
本研究探索了立体定向放射疗法(SBRT)联合Ta1在经重度治疗的mESCC患者中的抗肿瘤作用。
研究方法
本研究共入组31例患者,每位患者至少存在2处可测量转移灶。针对每处转移灶,SBRT每日剂量为5.0 Gy,1周内总剂量为25 Gy。同时,Ta1(1.6mg)每周皮下给药2次,之间间隔3-4天,直至照射野外其它(远处)转移灶进展。主要研究终点为抗肿瘤作用,即通过CT/MRI评估其它可测量病灶。次要研究终点包括安全性、生存结局以及免疫相关的血液学参数。ClinicalTrials.gov注册号:NCT 02545751。
研究结果
3例(9.7%)患者出现部分缓解(PR),11例(35.5%)患者的转移灶稳定(SD),转移病灶控制率(DCR)为45.2%。17例(54.8%)患者远处转移灶出现肿瘤进展(PD)。中位总生存期(OS)为5.2个月(95% CI:4,3-6.1个月),中位远处无进展生存期(APFS)为2.9个月(95% CI:2.2-3.6个月)。远处控制组(远处转移灶随访12周时无进展)的中位OS和APFS分别为5.6个月(95% CI:2.4-8.7个月)和3.0个月(95% CI:1.3-4.7个月),而非控制组的中位OS和APFS分别为5.0个月(95%CI:3.6-6.3个月)和2.2个月(95%CI:1.4-3.0个月)。亚组分析显示,远处控制组与非控制组的生存结局存在显著差异(P值分别为0.035和0.044)。治疗相关毒性可接受,未发生4级急性毒性事件。淋巴细胞免疫监测表明,远处控制组与非控制组在治疗后,CD8+ T细胞的比例存在显著差异(23.18±6.41 vs 18.76±5.43,P=0.047)。
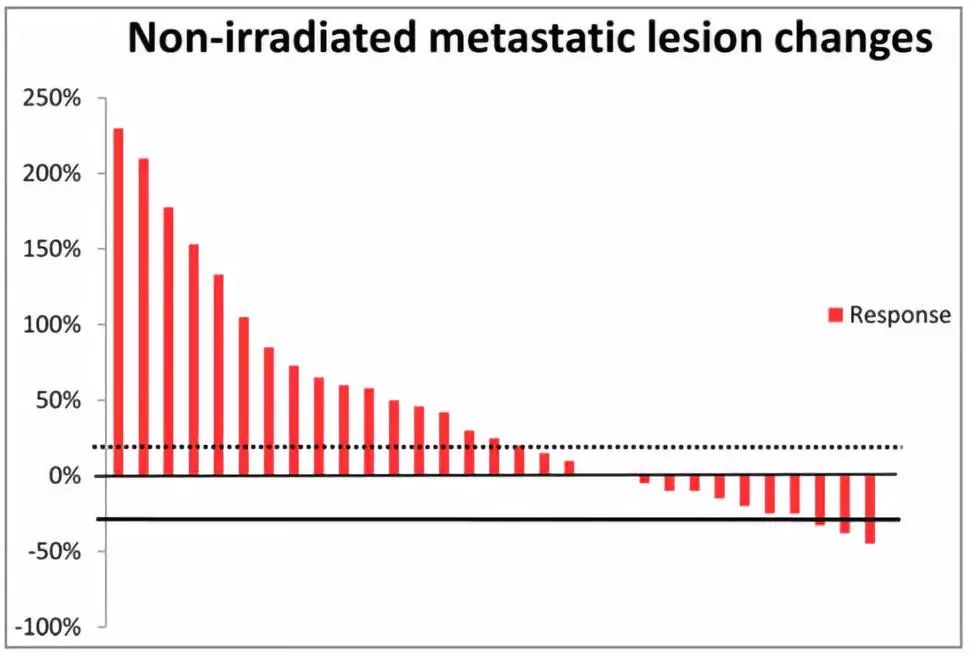
未经照射转移灶的变化瀑布图
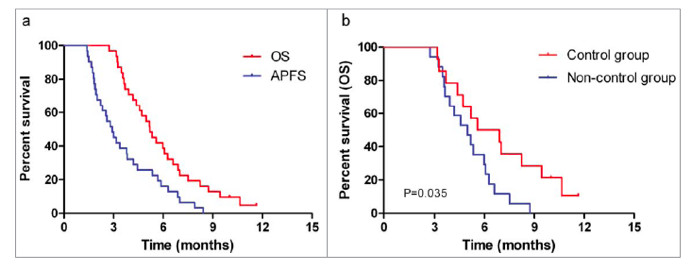
全部患者的OS及APFS曲线和远处对照组与非对照组的OS曲线
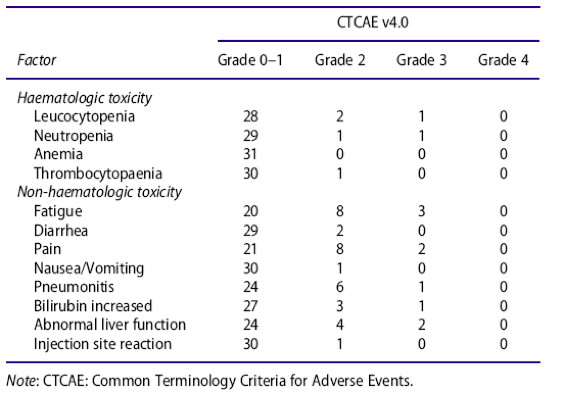
急性治疗相关不良事件
研究结论
综上所述,SBRT与Ta1联合治疗在经重度治疗的mESCC患者中产生了令人鼓舞的疗效。对放疗增强免疫治疗的研究仍需进一步探索。
专家点评

中国医学科学院肿瘤医院特需医疗部主任、干部保健处副处长,主任医师,博士生导师,协和特聘教授。中央保健会诊专家、首都十大杰出青年医生。中华医学会放疗青委会副主委、中国抗癌协会肿瘤放疗青委会副主委、中国卫生信息学会健康医疗大数据肿瘤专业委员会副秘书长。主持多项国家重点研发计划项目。

中国医学科学院肿瘤医院主治医师,博士。北京医学会放射肿瘤学分会泛京津冀术中放疗协作组秘书长,委员。8篇第一作者摘要入选美国放疗年会。主持院级课题2项;多次担任欧洲放疗学会培训班及国际胸科大会英文口译员;参编或编译多部学术论著。目前主要研究方向为胸部肿瘤的放疗及术中放疗。
近年来,肿瘤免疫治疗相关研究方兴未艾。当人们纷纷把目光投向标新立异的免疫药物、免疫靶点之时,吴式琇教授独辟蹊径,着眼于Ta1这一经典药物和放疗的紧密协作。这也是本研究的返璞归真之处。
老坛新酒,暗香盈袖
作为一种经典的提高免疫力的药物,Ta1早已经被广泛应用于临床。而同样的,SBRT作为一种常用的技术,也在早期肿瘤和转移性肿瘤中得到了大力的推广。可以说这两种治疗模式都是临床实践中非常常用的成熟的治疗模式。而这两种模式各有特色,SBRT代表了局部精确治疗,而Ta1则是提高全身免疫力的一种治疗手段。本研究将两种治疗模式应用于我国的高危、高发的病种——食管鳞癌,兼顾了全局和重点,并取得鼓舞人心的疗效。
量体裁衣,蜉蝣之羽
从入组标准看,本研究入组的是具有两个以上的复发转移灶的食管癌病例,且对于转移灶的诊断定义给出了清晰的界定。而在最后入组的病例中,治疗病灶以肺部和肝脏转移灶居多。这两个部位的转移灶也确切符合SBRT的适用标准。
在治疗实施阶段,我们知道,不同的分割剂量和总剂量可能带来的疗效和毒副作用的不同。即使在一些较大的SBRT前瞻性研究中,也存在分割剂量的异质性。而本研究中,整体采用了5Gy×5次这种较中和而通用的剂量,统一的剂量避免了剂量分割方面的偏倚。
而在安全性方面,众所周知,多项研究业已表明在放疗期间使用提高免疫力的药物可以提高放疗耐受性,减少放疗的毒副作用,故而本研究中放疗联合Ta1的毒副作用也在正如我们所料之中,3度以上的毒副作用较罕见。列表中的相对较多的3度以上的毒副作用是血液学毒性和肝功异常,而这两者的发生考虑与下列因素相关:1、所有患者既往均接受过重度治疗,对进一步治疗的耐受性较差;2、入组标准对血常规的要求相对较宽泛可能导致部分基线血常规较低的病人(如I度的WBC减少,II度血小板)也可以入组;3、腹部转移灶是入组病人的常见转移部位,其中相当一部分病人合并了肝转移。
可以说,整个研究的设计、入组流程和治疗都非常精准而得当。在这种情况下,获得一个比较成功的结果也是水到渠成了。
关山路遥,鸿雁传书
本文最大的创新点在于再次为放疗的远隔效应提供了循证依据。全部患者在治疗后,远处有效率高达45%。
所谓远隔效应,指在进行放疗之后,放疗野外的,距离原发灶较远的病灶出现消退或者达到被控制的情况。这一概念的提出,最早可以追溯到1953年。但长期以来,远隔效应仅限于个案报道,缺乏大宗病例的研究结果。
近年来,基于放射生物中免疫基因的相关研究的进展,对远隔效应的研究又再次登上了科研热榜。放疗可以诱导免疫原性细胞的死亡,从而诱导主动免疫。当肿瘤被照射时,细胞应激或损伤可能导致肿瘤相关抗原(TAA)从坏死和凋亡的肿瘤细胞和碎片中的释放出来。TAA数量和多样性的大幅度增加可以刺激肿瘤特异性的免疫反应。TAA首先被抗原提呈细胞(APC)吞噬,然后呈递给CD8+T细胞。CD8+T细胞可以识别和攻击肿瘤细胞。而大剂量分割的SBRT,可以更大程度的诱导免疫微环境的改变,从而提高了远隔效应发生的可能性。
在远隔效应的机制逐渐得以阐明的同时,多项研究也对放疗联合免疫治疗进行了大胆而成功的尝试。放疗联合免疫治疗通过增加肿瘤内源性T细胞的浸润,阻断Treg细胞,增加T细胞克隆的数目等途径,带来更为持久的全身免疫治疗效果,从而进一步提高了远隔效应发生的机会。
与此同时,在临床的观察和总结中,人们发现,远隔效应多数发生在免疫原性较强的肿瘤,如肾癌、肝细胞肝癌、恶性黑色素瘤、肺癌等。而有关食管癌的报道甚少。本研究无疑也在这方面增加了前瞻性的依据。
包罗万象,一应俱全
本文立足于食管癌这一我国特色的病种,而研究涉及到了临床常见而目前又并无行之有效的治疗手段的一线治疗后复发转移的病人。在有限的病例数目的基础上,研究者进行了全面的记录和分析,包括病人的一般资料、疗效、毒副作用、实验室检查结果等,其中尤以实验室检查方面的分析最为突出。在这其中,文章全面涉及到了淋巴细胞亚群、板淋比、粒淋比、粒单比、淋单比这些操作简单、检查方便又是近年热门的实验室指标。理论上有免疫相关的支持机制,实践上有临床获益人群筛选的需求。在此全面的分析中,作者最终认为疗末CD8+ T细胞以及板淋比可能是疗效相关的重要指标。
白璧微瑕,瑕不掩瑜
对于本文,也有一些疑问有待作者答疑解惑。
其一,本文主要针对的是复发转移且非寡转移的食管癌,且从入组的病人ECOG评分看来,大多数人的一般状况尚可,对于这部分病人而言,化疗和靶向治疗等全身治疗仍应该占据主要的位置,但文中没有述及全身治疗在这其中的介入时机、比例以及作用。
其二,在文章的结果中提到,在确切有远隔效应的病例里,绝大多数(10/14)是转移灶少的人群,有4个及以上转移灶的病人,并未发现有远隔效应。那么是否放疗加免疫治疗的远隔效应对这部分病人作用有限?或者是否可以考虑Ta1依据不同的瘤负荷给予不同的剂量?
其三,在获得远隔效应的人群中,未涉及到这部分病人放疗和未放疗的转移灶的位置。因为转移是个相对宽泛的概念,不同的部位对于局部放疗的适应症和疗效应当还是有一定的差异。
其四,如前所述,放疗本身是可以具有远隔效应的。本研究由于没有单纯照射组,那么这种远隔效应是否真的是Ta1带来的或者是提升的,仍然有待进一步的商榷。同样道理,由于缺乏单纯药物组作为对照,亦无法排除“远隔效应”实为药物的治疗作用。
何去何从,始于足下
目前放疗联合免疫治疗是国际上的研究热点。在近期的学术会议上,也该方面的研究结果也是层出不穷,但整体的证据水平都比较有限,且多数研究都在肺癌方面,有关食管癌的报道相对罕见。而作为我国的特色病种,我们也应在此路途上做更多探索,尤其是在SBRT相结合的道路上,对于不同部位、不同的处方剂量以及联合不同的免疫治疗模式方面,我们应该做更多的尝试。
1. Dexi Du, Tao Song, Hui Dai, Zhao Jing, Peng Chen & Shixiu Wu (2018): Stereotactic body radiation therapy and thymosin alpha-1-induced anti-tumor effects in heavily pretreated, metastatic esophageal squamous cell carcinoma patients, OncoImmunology, DOI: 10.1080/2162402X.2018.1450128.











 苏公网安备32059002004080号
苏公网安备32059002004080号


