【35 under 35】风采展示第二轮已经开始啦!本轮正经名叫“病例实战分析”,不正经名叫“互相伤害”,哈哈哈~100位入围选手每人提交一个有意思的病例,并就病例提出一个问题,形成一个病例库!然后100位入围选手从病例库中任意选择一个非自己提供的病例进行解读并回答问题!最后,我们将呈现病例+别人的点评+病例提供者自己的点评,同步展示!
 100位小伙伴已将自己的病例提交,并提出了问题,让我们一起先阅读下精彩病例吧!
100位小伙伴已将自己的病例提交,并提出了问题,让我们一起先阅读下精彩病例吧!
患者病史摘要
性别: 男
年龄:56岁
主述:体检发现肝占位1周
体能状态评分:1
既往史:吸烟20+年,已戒烟10年;
家族史:其父亲患直肠癌
入院查体:一般情况良好;心肺检查、腹部体查无异常;直肠指检:未及异常。
入院实验室检查:
肿瘤标志物:
CEA: 233.82 ng/ml (0-5.5)
CA19-9:370.60 U/ml (0-27)
AFP: 1.60 ng/ml
肠镜检查
肠镜检查片子及描述:
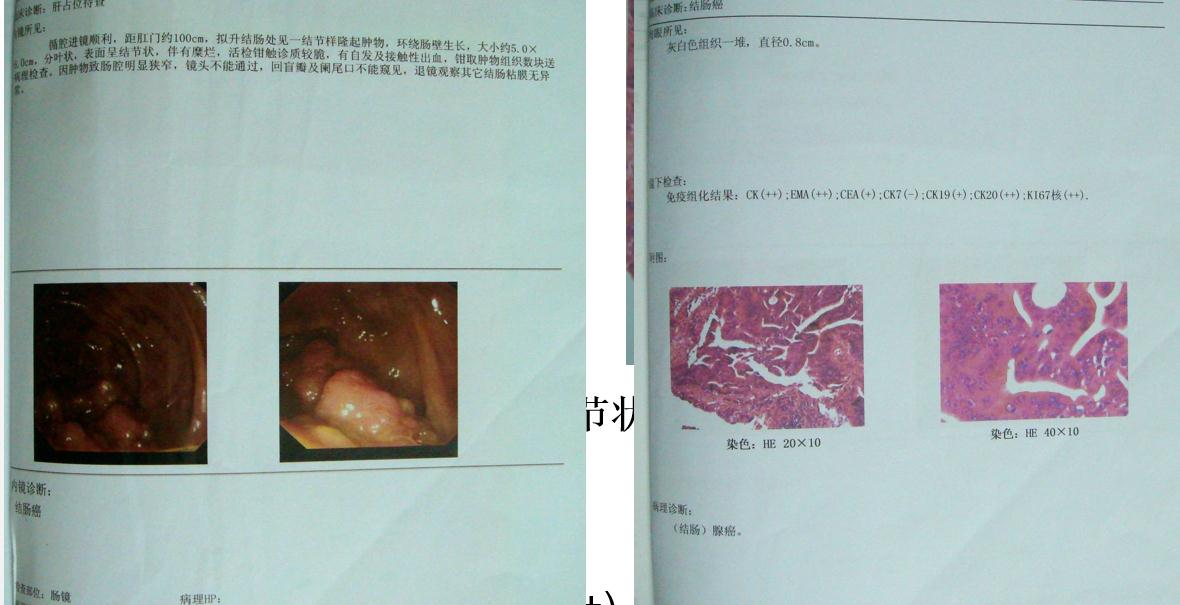
KRAS基因检测状态:code 12 MT, code 13 WT
影像学检查
入院时胸、腹、盆腔等影像学检查及CT/MRI片子
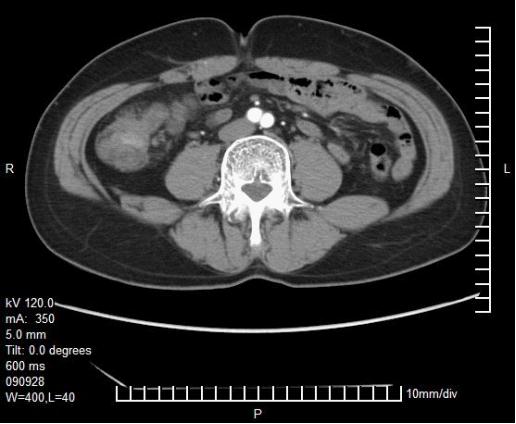
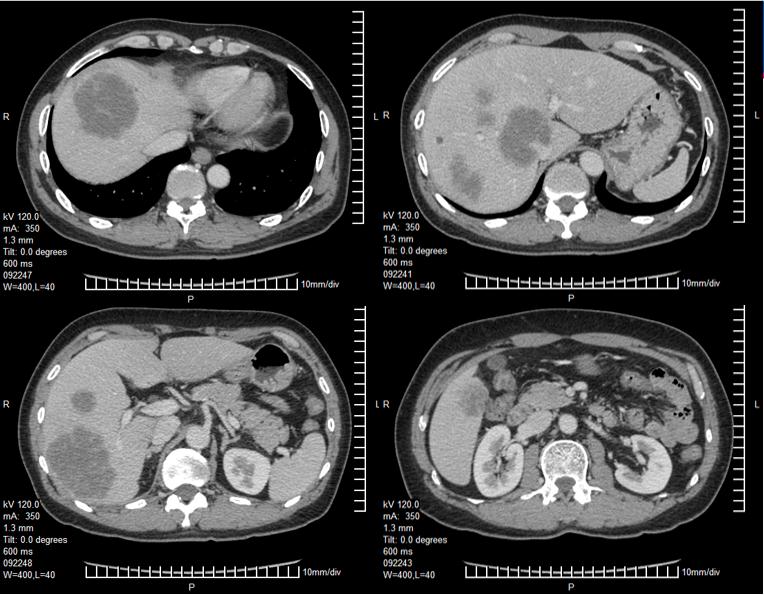
入院诊断
升结肠癌肝转移(cT3N0M1b, IVb期)
诱导化疗方案
方案组成:mFOLFOX6
是否联合靶向药物?否
开始时间: 2014年11月20日
治疗周期数:2
诱导化疗后评估
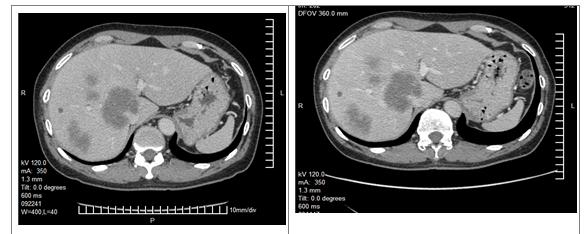
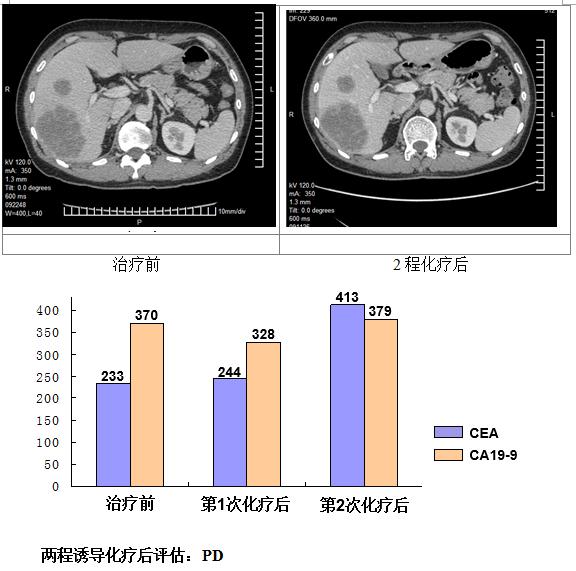
疾病进展后更改化疗方案
更改化疗方案: FOLFIRI+ bevacizumab 4次
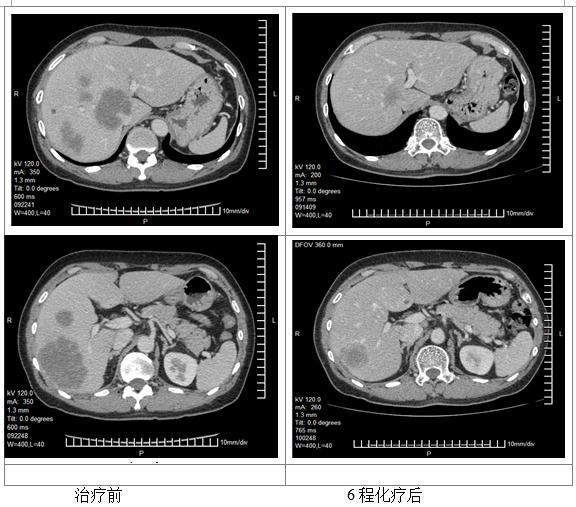
评估:PR
患者出现Ⅱ度骨髓抑制,化疗耐受性下降
手术治疗
手术名称:右半结肠切除+右半肝切除术
手术时间: 2015.5.14
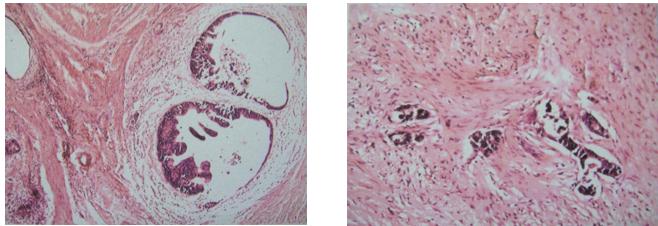
术后病理
右半结肠腺癌Ⅰ-Ⅱ级,溃疡型,直径2.5cm,浸润肠壁全层;
右半肝见腺癌浸润,伴大片组织坏死;
淋巴结未见癌转移:大网膜(0/1),肝动脉旁(0/5),胆总管下端(0/5)中间组(0/4),中央组(0/2),肠旁组(0/6),总数0/23。
CK8(++),CK20(++),AFP(-),Hepatocyte(-)
微卫星稳定:MLH1(+) MSH2(+) MSH6(+) PMS2(+)
K-ras: 结肠病灶、肝转移灶 code 12 mutant type,code 13 wild type
术后辅助化疗
化疗方案:FOLFIRI
化疗疗程:4程
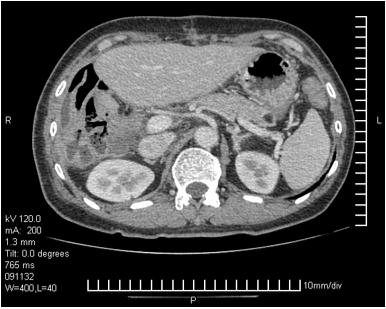
术后2月复查
复发治疗
复发时间:2016.2
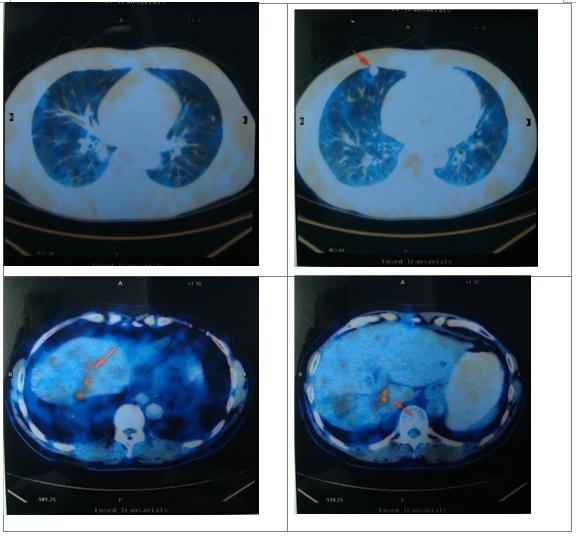
复发后治疗:FOLFIRI+Avastin 两程、FOLFOXIRI 一程、XELOX 3程
治疗耐受性差,肿瘤继续进展
治疗转归
目前患者情况 死亡
问题:
1. 该患者转化治疗选择是否恰当?
2. 该患者治疗过程中有什么地方值得改进和反思
此病例共有2位入围选手点评,分别为2-刁德昌、87-王峰 ;病例提供作者为:83-邱际亮 。详情如下:
点评医生简介:2-刁德昌
 点评内容分享:
点评内容分享:
1、诊断:IVa期?BRAF检测?HER2检测?
患者诊断只发现肝转移,应该属于IVa期。转移性肠癌在初诊时建议完善BRAF检查,甚至有条件还可以做HER2检测。BRAF突变患者提示预后极差需要积极治疗(如:三药+贝伐),或者后线使用多靶点联合治疗。HER2阳性患者提示在后线还有双重抗HER2治疗的选择。该患者检测出RAS突变,则BRAF几乎不会同时突变;而且RAS突变患者即使HER2阳性,双重抗HER2治疗亦效果不佳,所以没有做BRAF、HER2检测对该患者影响不大。
该患者原发右半,估计预后相对较差。
2、转化治疗推荐联合靶药方案:ESMO指南对于RAS突变患者转化治疗推荐两药化疗+贝伐或者三药化疗+贝伐。
AVF2107研究提示含伊立替康一线化疗加贝伐显著提高ORR。尽管NO16966研究含铂一线化疗加贝伐ORR无显著改善,但在E3200研究含铂二线化疗加贝伐ORR有显著改善。而且抗血管生成药物与抗细胞增殖药物作用机制不同,RECIST标准不能完全反映其疗效;病理学缓解率(如:间接评估病理学缓解率的CT形态学评估方法)可能更能反映抗血管生存药物的疗效,并与患者的预后密切相关。GONO/Boxer/Olivia II期转化研究提示两药/三药化疗+贝伐ORR为62%-81%,R0切除率为23%-49%,三药化疗+贝伐对比两药化疗+贝伐在ORR和R0切除率上进一步提高。TRIBE研究三药化疗+贝伐对比两药化疗+贝伐在ORR、PFS和OS上显著获益,提示三药化疗+贝伐是目前临床上最积极方案。因此ESMO指南对于RAS突变患者转化治疗方案推荐两药化疗+贝伐或者三药化疗+贝伐。除此之外,II期研究(Gruenberger, et al. JCO 2008)表明在围手术期接受XELOX+贝伐珠单抗治疗未对术后肝脏再生能力产生任何不良影响。贝伐珠单抗还可以减少化疗相关肝脏损伤。含铂化疗超过3个月会导致肝窦扩张,一种静脉闭塞性疾病的血管损伤特征,又叫做肝窦阻塞综合征(SOS)。研究表明(Ribero, et al. Cancer 2007)贝伐珠单抗可以减少含铂化疗诱导的肝窦损伤,机制可能与抗VEGF可以下调基质金属蛋白酶9(MMP-9)有关。
3、关于转化治疗患者的评估:治疗2个周期评估属于SD还是PD?如果是SD,会不会再治疗2个周期患者会出现PR?
一般化疗最佳疗效出现在3-4个月,过早评估是否能反映真实的情况?该患者治疗2个周期后影像学评估提示肿瘤大小只有略微的改变,是否符合PD?如果是SD,会不会再治疗2个周期患者会出现PR?后续的FOLFIRI+Bev会不会是治疗时间累积足够了才体现出PR?各大指南推荐转化治疗首次评估为治疗后2个月(CSCO指南推荐每6-8周),若首次评估无疗效则建议更换方案。
4、复发后治疗是否应该考虑全身治疗联合局部治疗以控制疾病进展?
患者术前FOLFIRI+贝伐治疗有效,复发后可以继续该方案治疗。患者肝、肺复发病灶较小,是否能联合局部治疗以清除病灶、延缓疾病进展,减少后续化疗负担。NCCN指南推荐消融技术可单独应用或与切除相结合,所有病变部位均需行消融或手术。对于化疗耐药或难治的肝转移为主的患者,在严格选择患者情况下,可应用动脉插管治疗,特别是钇90微球动脉栓塞疗法。
5、后线治疗
若患者能耐受,标准化疗失败后还可以进一步接受瑞格非尼治疗以延长生存。该患者为MSS型,对抗PD-L1单药免疫治疗不敏感,但可以考虑联合免疫治疗:抗PD-L1+MEK抑制剂;还可以寄希望于将来的CEA-TCB+抗PD-L1联合免疫治疗。
--------------------------------------
点评医生简介:87-王峰
 点评内容分享:
点评内容分享:
患者男性,56岁,确诊右半结肠癌伴肝脏多发转移,确诊时临床危险评分(CRS)4分(具有同时性肝转移、多个转移灶、最大病灶长径>5cm、CEA>200ng/ml)属于高危患者[1]。按照ESMO推荐的对于结肠癌肝转移患者的评估标准该患者属于技术上难切除,预后差的患者,应该选取最佳全身治疗进行转化治疗[2, 3]。患者并未出现梗阻、明显出血、穿孔或其他原发肿瘤引起的症状,因此按照NCCN指南推荐全身治疗而不建议初始切除原发灶[4]。患者年轻、一般情况可,原发灶位于右半结肠,且其KRAS基因为突变型,因此推荐选择三药联合化疗(FOLFOXIRI),如患者经济上可以承受也可考虑三药或双药(FOLFOX或FOLFIRI)联合贝伐单抗[5, 6]。关于右半结肠癌的一线治疗推荐,2017版NCCN指南明确指出不考虑使用EGFR抗体;而ESMO指南对于RAS野生型、Braf野生型患者,当以肿瘤减灭为目的时首选两药联合+EGFR抗体,次选三药联合或不联合贝伐单抗。针对一线化疗对比化疗联合西妥昔单抗的左右半分析,共有两项Ⅲ期临床研究的回顾性分析结果和一项中山大学肿瘤防治中心的回顾性研究结果,在CRYSTAL、TAILOR和我们的研究中都显示化疗联合西妥昔单抗对比单纯化疗有效率、PFS和OS均未呈现显著提高[7, 8]。另外两项头对头比较双药联合贝伐单抗或西妥昔单抗的临床研究FIRE3和80405都显示两者在有效率方面无显著的差别[9]。因此如果该患者为RAS野生型仍不建议首选EGFR抗体治疗。
2程化疗后展示的患者肝脏CT无明显改变,评价为PD的原因不明。若患者因肝脏或其他部位出现新发病灶出现了病情进展,可考虑二线采用FOLFIRI联合贝伐单抗,4程化疗后肝脏病灶明显减少、缩小,评价为PR。因贝伐单抗使用后需暂停6周以上才能进行手术,因治疗间隔太长,建议该患者在停用贝伐单抗期间进行FOLFIRI方案化疗2至3疗程。手术切除原发灶和肝转移灶,病理已确认。其后患者进行了术后辅助化疗4程,患者术前行化疗4程,仅出现Ⅱ度骨髓抑制,根据NCCN指南术后可建议其行8程FOLFIRI方案或2-3程FOLFIRI方案加6-5程FOLFIRI联合贝伐单抗方案化疗,达到共6个月的围手术期化疗。
该患者在术后约半年时间出现了右肺和肝脏新发病灶,左肺可疑病灶,可考虑再引入FOLFIRI联合贝伐单抗的治疗,若疗效评价为SD或PD,应行多学科专家团队(MDT)讨论,让肝胆外科、胸部外科、介入科和放疗科医生共同讨论是否可针对其新发病灶进行治疗。另外,该患者父亲也患有结肠癌,应仔细询问其发病年龄和家族是否有其他肿瘤患者。按照中山大学肿瘤医院Lynch综合征分子筛查流程,其MMR蛋白表达正常,若符合Bethesda标准推荐进行MSI检测,若MSI-H还应该再检测MLH1甲基化或BRAF突变,若两者皆阴性建议其进行MMR基因胚系突变检测以鉴别是否Lynch综合征。
纵观该患者的治疗全程,有以下可以改进的地方:
一线治疗以肿瘤退缩为目的争取手术根治机会应推荐有效率更高的方案;二线治疗取得有效后停药时间过长应在停用贝伐单抗准备手术的基础上再行化疗两到三程;化疗配合根治性手术达到无疾病证据(NED)状态,围手术期化疗建议能达到半年时间;患者出现疾病复发后建议更加积极地进行多学科讨论采取多学科联合的方案。
--------------------------------------
病例提供作者简介:83-邱际亮

病例提供作者自评:
随着人们生活水平、诊治技术进步,结肠癌肝转移病例所占比重在不断增加,约有1/3-1/2的患者病程中合并出现肝转移。但对其规范化、个体化治疗仍有很多探索空间,比如转化治疗和新辅助化疗方案的差异、手术介入时机、姑息手术价值、进展后治疗方案选择、是否联合靶向治疗、长期化疗与生活质量之间的取舍等等,对其研究不断深入、细化,有助于提高结肠癌肝转移患者生存率,改善生活质量。因此,2016年欧洲ESMO指南将mCRC单独列出实践指南,也从侧面反映了结肠癌肝转移规范治疗的重要性。
此病例患者首先因为发现肝占位入院,完善检查,诊断升结肠癌 肝转移,原发证升结肠肿瘤可手术切除,但肝内病灶多发(6个),尤其侵犯门静脉主干分叉处,该病例不能归于寡转移疾病。经过MDT会诊,转移灶初治时不可切除,暂无R0手术切除可能,鉴于原发升结肠病灶没有梗阻、出血等症状,一致建议选择转化化疗,降期争取手术治疗是其目的。依据ESMO分组意见,该病例属于组1患者。尽管是一线转化化疗效果欠佳,但是bevacizumab联合FOLFIRI的化疗获得了明显的PR效果,转化为可切除。这个病例显示出如果治疗目标是从不可切除转化为可切除,bevacizumab联合化疗还是有较好的肿瘤退缩效果。该患者总体生存达2年以上,整体治疗是成功的,MDT讨论决策至关重要。但术前评估、手术时机的选择、以及靶向用药等也存在一些需要进一步讨论的问题。
患者肝内发现6个病灶,位于右肝,有一个大肿瘤临近门静脉主干,K-RAS为突变型,术前的转化化疗有一个PR的良好反应,所以这个患者的治疗目标还是应该是治愈。所以,治疗选择一定是根治性的治疗。由于肿瘤靠近门静脉主干,手术中外科医生做了最大努力使得病灶达到肉眼R0切除,实属不易。但术后半年不到时间出现复发,是否与未采用磁共振评估肝转移灶有关,值得商榷。最近韩国有一项多中心回顾研究提示对于临床完全缓解的肠癌肝转移患者,普美显-磁共振漏诊率明显低于增强CT(22.0% vs. 64.8%)。因此,还是要强调肝脏转移瘤常规行磁共振检查。
贝伐单抗的疗效不受RAS基因突变的影响,但目前贝伐珠单抗转化研究的证据相对较少。OLIVIA、TRIBE等研究证实,贝伐单抗联合三药较联合mFOLFOX6/FOLFIRI,均能提高ORR、PFS期,提高R0切除率,且毒性可接受。因此ESMO指南推荐,在RAS突变型患者中,FOLFOXIRI±贝伐单抗治疗可作为转化方案。所以,该病例在一线转化治疗选择中,应该更积极、更早的选择三药化疗(FOLFOXIRI)联合贝伐单抗治疗,或许会进一步提高患者生存时间。
在贝伐单抗等耐药后,国内无更好的后续治疗选择,因此对于体力评分较好的病人,可以考虑再次使用之前使用过的化疗药物,经过与靶向药物联合后,以发挥药物的最大疗效。由于患者化疗耐受性较差,影响后续化疗,但目前比较热门的体液活检,用于指导患者个体化化疗,是值得尝试的方向;同时,随着晚期结肠直肠癌患者生存时间的不断延长,在治疗过程中需考虑药物及局部治疗的全程管理,合理布局,更好的延长患者的生存。
总之,这个病例给了我们很多提示:有可能转化的患者术前化疗应争取高反应率的治疗方案,诊治过程仍有待改善的地方,值得进一步探讨总结。
--------------------------------------
以上为【35 under 35】的观点,您怎么看?欢迎广大肿瘤医生在下方留言发表您的观点!
以上所有点评参考文献略。















 苏公网安备32059002004080号
苏公网安备32059002004080号


