2025年4月8日,美国食品药品监督管理局(FDA)批准百时美施贵宝公司的双免疗法——纳武利尤单抗(欧狄沃,俗称O药)+伊匹木单抗(逸沃,俗称Y药)用于治疗患有不可切除或转移性微卫星高度不稳定(MSI-H)或错配修复缺陷(dMMR)结直肠癌(CRC)的成人和≥12岁儿童患者。同时,FDA还将纳武利尤单抗单药针对接受过氟尿嘧啶、奥沙利铂和伊立替康治疗后进展的MSI-H/dMMR转移性CRC成人和≥12岁儿童患者的加速批准转为常规批准。

获批依据
该联合疗法的有效性评估基于CheckMate 8HW研究(NCT04008030)。这项随机、三组、开放标签的研究入组了未经免疫治疗的MSI-H/dMMR不可切除或转移性CRC患者。患者以2∶2∶1的比例随机接受以下方案之一:
1)纳武利尤单抗240 mg每3周+伊匹木单抗1 mg/kg每3周,最多4剂,然后纳武利尤单抗480 mg每4周维持(n=353)
2)纳武利尤单抗240 mg每2周,共6剂,然后480 mg每4周维持(n=354)
3)研究者选择的化疗方案:包括mFOLFOX6(氟尿嘧啶+奥沙利铂)或FOLFIRI(氟尿嘧啶+伊立替康),±贝伐珠单抗或西妥昔单抗(n=132)
主要终点为经盲态独立中心审查(BICR)评估的无进展生存期(PFS),采用RECIST v1.1标准,针对经中心实验室确认MSI-H/dMMR状态的患者群体进行预设分析:
•一线治疗:纳武利尤单抗+伊匹木单抗(双免) vs 化疗
•全线治疗:纳武利尤单抗+伊匹木单抗 vs 单药纳武利尤单抗(单免)
双免 vs 化疗的一线治疗分析(303例本地检测患者中有255例经中心确认)在2024年ASCO-GI大会上报告了结果,双免组中位PFS未达到(95% CI:38.4个月~不可评估),化疗组为5.8个月(95% CI:4.4~7.8个月),风险比0.21(P<0.0001)。由于统计策略限制,该中期分析时客观缓解率(ORR)和总生存(OS)数据尚未成熟。
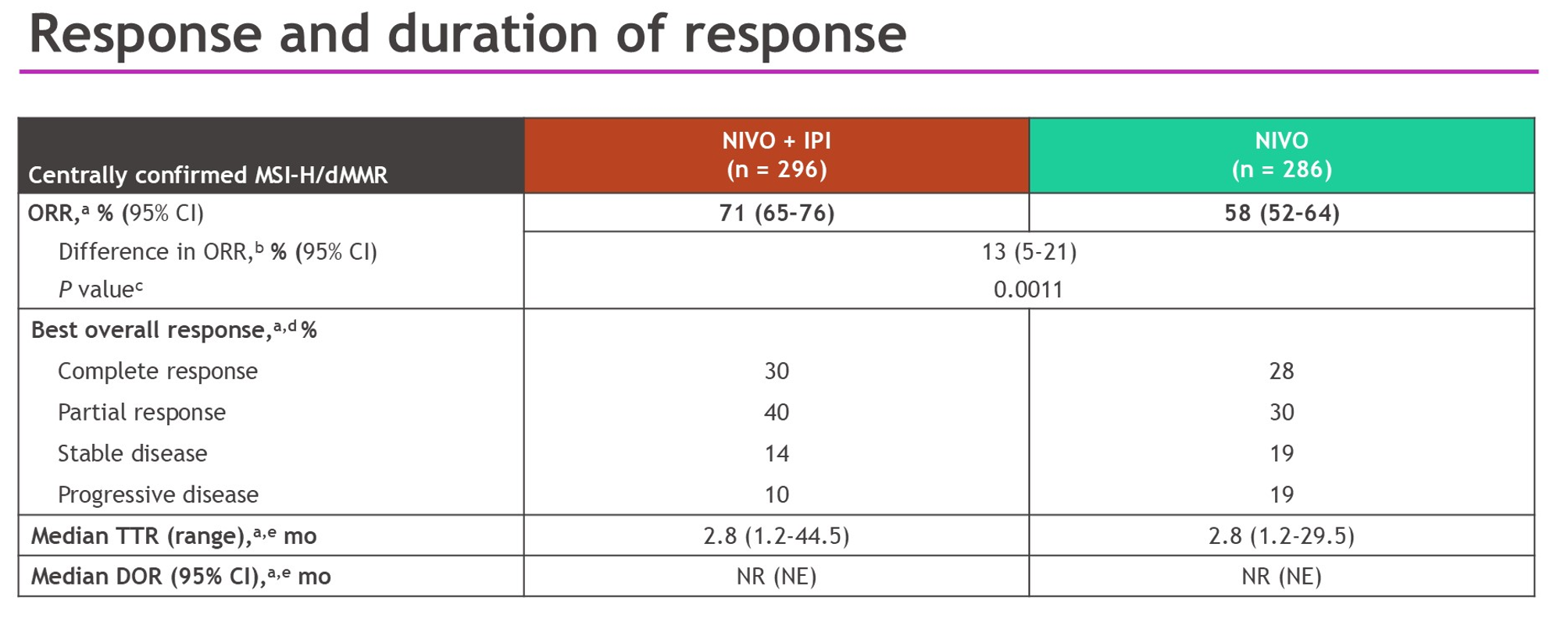
2025年ASCO-GI大会上,双免 vs 单免的全线治疗分析(707例本地检测患者中有582例经中心确认)结果公布,双免组中位PFS未达到(95% CI:53.8个月~不可评估),单免组为39.3个月(95% CI:22.1个月~不可评估),风险比0.62(P=0.0003)。双免组ORR达71%(95% CI:65%~76%),显著高于单免组的58%(95% CI:52%~63%)(P=0.0011)。双免组分别有30%和40%的患者观察到完全缓解(CR)和部分缓解(PR),单免组分别为28%和30%。两组的至中位缓解时间(TTR)均为 2.8 个月,中位缓解持续时间(DOR)均为 未达到。OS数据同样因统计策略暂未获得。ASCO-GI大会数据公布当日,研究全文同步发表于《柳叶刀》(Lancet)主刊。
 安全性方面,双免组有81%的患者报告了任何级别的治疗相关不良事件(TRAE),而单免组这一比例为71%。双免组与单免组中最常见的 TRAE 为瘙痒(26% vs 18%)、腹泻(20% vs 17%)和甲状腺功能减退(17% vs 9%)。最常观察到的 3 级或 3 级以上 TRAE 为肾上腺功能不全(2% vs < 1%)。
安全性方面,双免组有81%的患者报告了任何级别的治疗相关不良事件(TRAE),而单免组这一比例为71%。双免组与单免组中最常见的 TRAE 为瘙痒(26% vs 18%)、腹泻(20% vs 17%)和甲状腺功能减退(17% vs 9%)。最常观察到的 3 级或 3 级以上 TRAE 为肾上腺功能不全(2% vs < 1%)。
“O+ Y组合是更好地治疗 MSI-H转移性CRC 的非常重要的一步,毫无疑问,这是MSI-H 患者队列最有效的治疗方法,而不会显著增加毒性。” CheckMate 8HW的研究者Heinz-Josef Lenz说。
O+Y疗法在FDA获批的其他适应证
黑色素瘤
•2015年9月30日,基于一项国际多中心随机双盲活性对照临床研究的结果,O+Y获FDA加速批准,用于治疗BRAF V600 野生型、不可切除或转移性黑色素瘤患者。
肾癌
•2018年4月16日,基于CheckMate 214研究的结果,O+Y获批用于中或高危、先前未接受过治疗的晚期肾细胞癌患者。
肠癌
•2018年7月10日,基于CheckMate 142研究的结果,O+Y获FDA加速批准,用于治疗12 岁及以上既往接受氟尿嘧啶类、奥沙利铂和伊立替康治疗后进展的MSI-H/dMMR转移性mCRC的患者。
肝癌
•2020年3月10日,基于CheckMate 040研究的结果,O+Y获FDA加速批准,用于既往接受过索拉非尼治疗的肝细胞癌患者。
肺癌
•2020年5月15日,基于CheckMate 227研究的结果,O+Y获批用于PD-L1≥1且EGFR/ALK阴性转移性非小细胞肺癌(NSCLC)的一线治疗。
•2020年5月26日,基于CheckMate 9LA研究的结果,O+Y+2周期铂类双药获批用于EGFR/ALK阴性转移或复发性NSCLC的一线治疗。
胸膜间皮瘤
•2020年10月2日,基于CheckMate 743研究的结果,O+Y获批用于不可切除的恶性胸膜间皮瘤的一线治疗。
食管癌
•2022年5月27日,基于CheckMate 648研究的结果,O+Y获批用于晚期或转移性食管鳞癌的一线治疗。
•O+Y疗法在国家药品监督管理局(NMPA)获批的适应证
胸膜间皮瘤
•2021年6月8日,基于CheckMate 743研究的结果,O+Y获NMPA附条件批准,用于不可手术切除的、初治的非上皮样恶性胸膜间皮瘤成人患者。该适应证的完全批准将取决于后续开展临床试验证实本品在中国人群的临床获益。
肠癌
•2024年10月14日,基于CheckMate 8HW的结果,O+Y获批用于不可切除或转移性MSI-H/dMMR CRC患者的一线治疗。这是O+Y方案MSI-H/dMMR CRC一线治疗适应证的全球首次批准。值得注意的是,与NMPA批准的适应证有所不同,FDA批准的是全线适应证。
肝癌
•2025年3月25日,基于CheckMate 9DW的结果,O+Y获批用于不可切除或晚期肝细胞癌(HCC)成人患者的一线治疗,成为中国首个且目前唯一获批的肝细胞癌一线双免疫联合疗法。
值得指出的是,O+Y在NMPA肠癌和肝癌一线适应证的批准均早于FDA。
[1] FDA approves nivolumab with ipilimumab for unresectable or metastatic MSI-H or dMMR colorectal cancer. FDA. April 8, 2025. Accessed April 8, 2025. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-nivolumab-ipilimumab-unresectable-or-metastatic-msi-h-or-dmmr-colorectal-cancer[2] ANDRE T, ELEZ E, Van Cutsem E, et al. Nivolumab (NIVO) plus ipilimumab (IPI) vs chemotherapy (chemo) as first-line (1L) treatment for microsatellite instability-high/mismatch repair-deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC): First results of the CheckMate 8HW study. 2024 ASCO GI, LBA768.
[3] ANDRE T, ELEZ E, LENZ HJ, et al. First results of nivolumab (NIVO) plus ipilimumab (IPI) vs NIVO monotherapy for microsatellite instability-high/mismatch repair-deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC) from CheckMate 8HW. 2025 ASCO GI, LBA143.

排版编辑:Linda











 苏公网安备32059002004080号
苏公网安备32059002004080号


