胃癌是全球第五大常见恶性肿瘤,也是中国癌症相关死亡的第三大原因。早期胃癌(EGC)定义为局限于黏膜层或黏膜下层的浸润性癌,无论病灶大小或淋巴结转移(LNM)状态,其内镜切除术后5年生存率高达92.6%。淋巴结转移状态不仅是EGC患者独立的预后预测因子,更是决定治疗策略的核心要素——无LNM风险的病灶可行内镜下切除(EMR/ESD)以保留器官功能,而合并LNM者则需接受外科手术及淋巴结清扫。然而,传统临床病理指标预测LNM的特异性与敏感性不足,导致治疗决策面临巨大挑战。近年来,基于机器学习、影像组学和分子标志物的风险预测模型不断涌现,但其方法学质量与临床适用性尚不明确。本研究通过系统评价与meta分析,首次全面评估了现有EGC淋巴结转移风险预测模型的偏倚风险与预测性能,为精准医疗实践提供循证依据。相关成果已于2025年发表于BMC Gastroenterology杂志。
研究背景
胃癌的诊疗已进入精准医学时代,EGC的检出率逐年提升。内镜切除相比传统胃切除手术具有创伤小、恢复快、生活质量高等优势,但其前提是对LNM风险的精准评估。当前,临床医生主要依赖日本胃癌协会指南推荐的扩大适应证标准(如直径≤2cm、无溃疡分化型黏膜内癌等)进行决策,但这些标准的阴性预测价值仅70%—85%,仍有15%—30%的患者术后病理提示LNM,需追加手术。此外,亚洲与欧美人群在Lauren分型分布、遗传易感性及家族史比例(亚洲8%—12% vs 欧美5%—7%)等方面存在显著差异,现有标准的外推性受限。
在此背景下,基于Logistic回归、随机森林、深度学习等算法构建的预测模型大量涌现,整合临床病理特征、影像学参数、血清标志物甚至分子特征(如lncRNA、miRNA)以提升预测精度。然而,这些模型在数据来源、变量筛选、验证策略及报告规范等方面差异巨大,其方法学质量从未接受系统性评估。PROBAST(预测模型偏倚风险评估工具)指南的发布为标准化评价提供了框架,但国内研究者对该工具的依从性较低。本研究旨在填补这一证据空白,明确现有模型的优势与缺陷,为未来研究指明方向。
研究方法
1.文献检索与筛选策略
严格遵循PRISMA声明与CHARMS清单,系统检索PubMed、Embase、Cochrane Library三大数据库,检索时限截至2024年5月1日,检索词包括"early gastric cancer"、"lymph node metastasis"、"prediction model"等,限定中英文文献。补充检索参考文献列表及相关综述。采用PICOTS框架明确纳入标准:P(人群)为病理确诊的EGC患者;I(干预)为已发表且包含≥2个预测因子的LNM风险预测模型;O(结局)为预测性能指标(C统计量、准确性等);S(研究设计)为观察性研究。排除动物实验、会议摘要、单变量模型及数据不完整的研究。
2. 文献筛选与数据提取
由两位研究者(DM与WZS)独立进行文献筛选与数据提取,分歧通过第三位研究者(X)仲裁。使用基于CHARMS清单改编的标准化表格提取以下信息:(1)研究基本信息(作者、发表年份、国家、中心数量);(2)参与者特征(样本量、癌症类型、数据收集周期);(3)模型构建方法(变量筛选算法、建模方法、验证类型);(4)预测性能指标(C统计量、准确性、敏感性、特异性、校准方法);(5)最终纳入的预测因子。通过交叉核对作者单位、招募时间及试验注册号避免队列重叠。
3. 质量评估与偏倚风险评价
采用PROBAST工具独立评估每篇文献的偏倚风险与适用性,涵盖参与者、预测因子、结局和分析四个领域共20个信号问题。任一领域被判定为"高风险"则整体研究为高风险。同时采用GRADE系统评估证据质量,从研究设计、偏倚风险、不一致性、间接性、精确度及发表偏倚六个维度进行评价,分为高、中、低、极低四级。
4. 统计分析与meta整合
使用R 4.2.2与Stata 17.0软件进行统计分析。采用随机效应模型合并C统计量与准确性,以I²指数评估异质性(低<25%、中25%—50%、高>50%)。通过Egger回归检验评估发表偏倚,P<0.05为存在显著偏倚。对建模方法(Logistic回归vs非Logistic回归)、验证类型(内部验证vs外部验证)、研究中心(单中心vs多中心)进行亚组分析。通过逐项剔除研究进行敏感性分析,评估结果稳健性。所有检验均为双侧,α=0.05。
研究结果
1. 文献纳入特征
初检共获得2,461篇文献,经过去重、筛选及全文评估,最终纳入50篇文献。研究发表年份为2015—2024年,其中42篇来自中国,7篇来自韩国,1篇来自日本,反映出研究人群的地域集中性。49项研究为回顾性设计,仅1项为回顾-前瞻性混合设计。多中心研究20项,单中心研究30项。样本量跨度极大(183-12,679例),涵盖多种EGC亚型,包括3项印戒细胞癌专病研究及肠型、近端EGC等亚组分析。所有研究均报道了模型训练集性能,其中33项研究提供了验证集数据。
2. 模型构建方法学特征
绝大多数研究(46/50)采用传统Logistic回归建模,仅4项研究应用机器学习算法(包括支持向量机、随机森林、XGBoost、神经网络等)。变量筛选方法多样,Lasso回归、逐步回归及单因素分析最为常见。模型包含的预测因子数量为2—12个,其中肿瘤大小是出现频率最高的核心预测因子(44/50),其次为组织分化程度(38/50)、浸润深度(35/50)、淋巴管浸润(32/50)及溃疡形成(28/50)。新兴预测因子包括血小板/淋巴细胞比值(PLR)、长链非编码RNA(lncRNA)特征谱、影像组学参数等。仅27项研究报告了模型校准度,主要通过校准曲线或Hosmer-Lemeshow检验评估。
3. 偏倚风险评估结果
PROBAST评价显示,所有50项研究均被判定为高偏倚风险。在参与者领域,9项研究(18%)因使用区域性登记数据或单中心回顾性数据,无法代表目标人群而被判高风险。预测因子领域所有研究均为低风险,反映变量定义与测量具有一致性。结局领域亦无高风险研究,LNM的定义均基于术后病理金标准。分析领域风险最高:11项研究未完整报告模型性能(如仅报告AUC而未报告校准度),4项研究未提供多变量回归系数,导致模型可重复性存疑。适用性评估显示,48项研究为低适用性担忧,但2项研究因预测因子设置问题被评为高适用性风险。
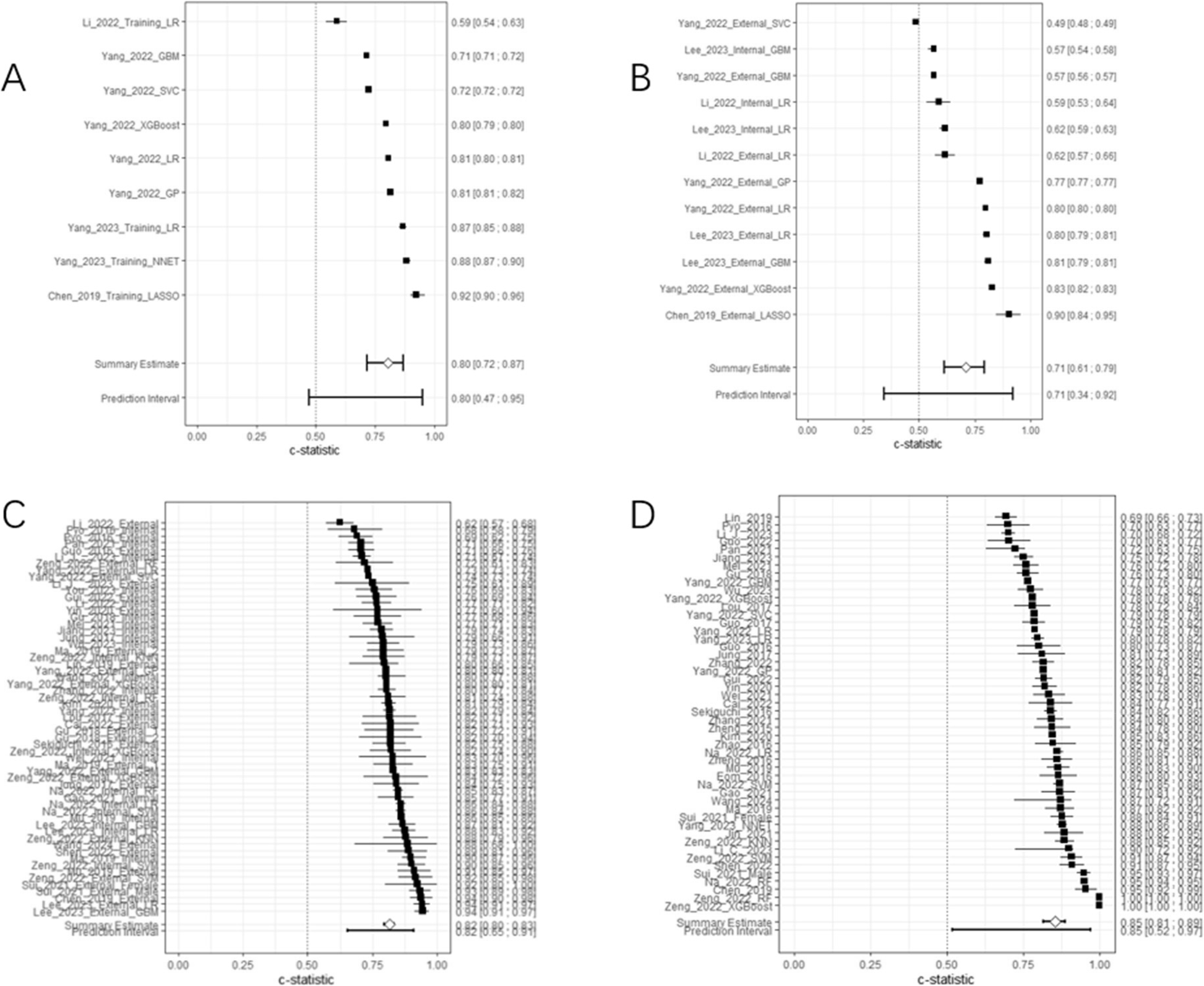
4. 预测性能meta分析训练集性能:
38项研究(49个模型)的合并C统计量为0.85(95%CI 0.81-0.89),存在显著异质性(I²=99.9%)。亚组分析显示,Logistic回归模型合并C统计量为0.82(95%CI 0.80-0.84),而非Logistic回归模型达0.93(95%CI 0.78-0.98),但后者可信区间极宽,提示结果不稳定。多中心研究合并C统计量(0.81)低于单中心研究(0.88),反映外部真实性更高的研究性能反而偏低。
验证集性能:33项研究(59个模型)的合并C统计量为0.82(95%CI 0.80-0.83),异质性仍较高(I²=97.4%)。内部验证与外部验证的C统计量分别为0.81与0.82,差异无统计学意义。值得注意的是,模型在验证集的性能普遍低于训练集,准确性从训练集的0.80(95%CI 0.72-0.87)下降至验证集的0.71(95%CI 0.61-0.79),提示存在明显的乐观偏倚。
表1 预测早期胃癌患者淋巴结转移的模型C统计量
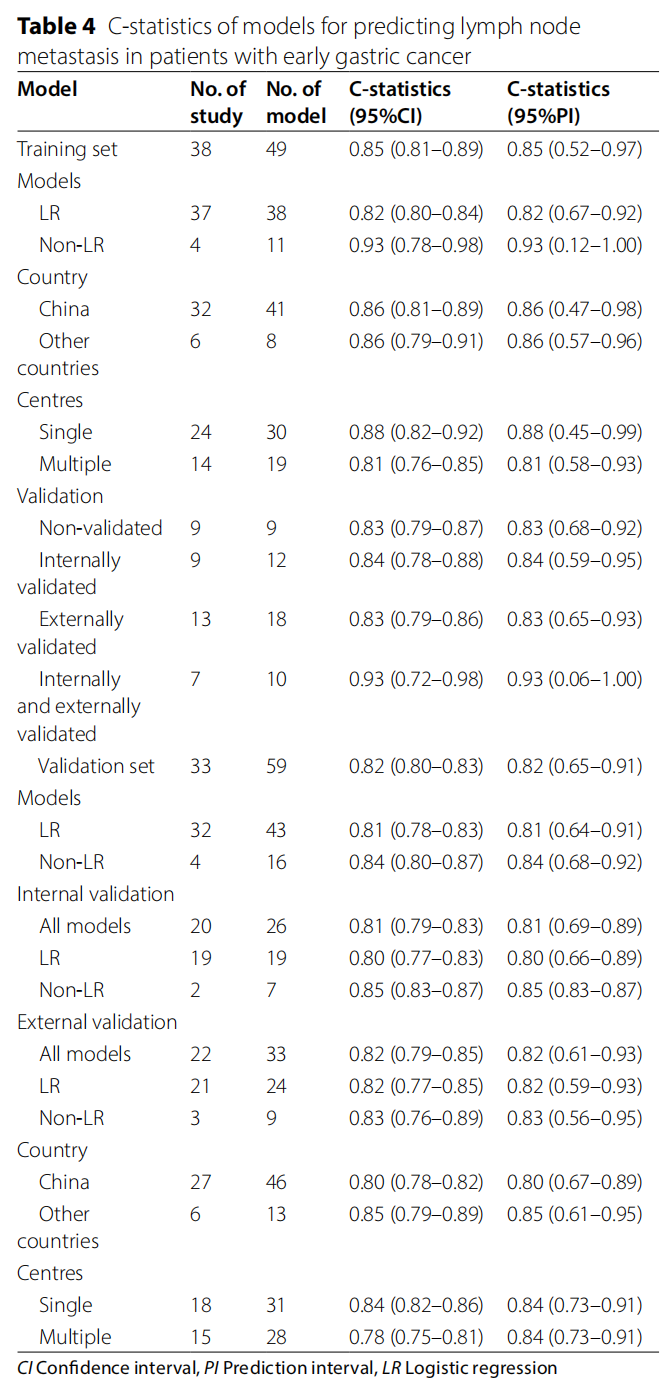
表2 预测早期胃癌患者淋巴结转移的模型准确性

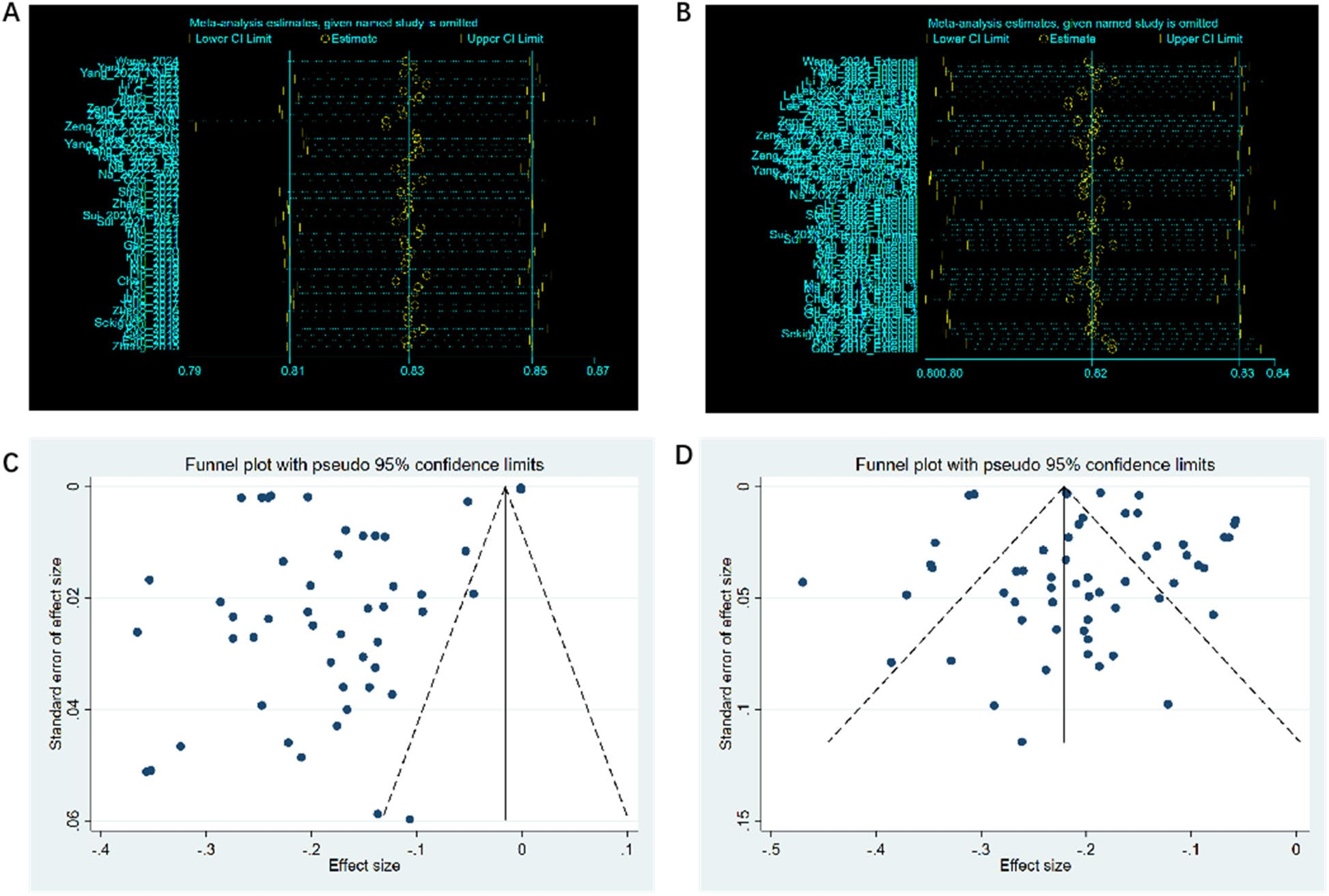
5. 发表偏倚与敏感性分析
Egger检验显示训练集模型存在显著发表偏倚(P=0.002),倾向于发表性能更好的模型;而验证集偏倚较小(P=0.320)。敏感性分析显示,逐项剔除任一项研究未显著改变合并效应量,表明meta分析结果具有稳健性。
6. 新型预测因子的探索价值
部分研究探索了超越传统病理指标的预测因子。Dong等通过TCGA数据库构建10-lncRNA特征模型,在验证集中AUC达0.852,优于传统临床模型。Zeng等融合临床、影像组学与深度学习特征的多模态模型外部验证AUC为0.916。Ma等鉴定的miR-153-3p等4-miRNA标志物在独立队列中显示出良好判别力。这些研究为液体活检与人工智能辅助决策提供了方向,但检测标准化与成本效益仍需验证。
结论
本研究通过系统评价与meta分析证实,现有早期胃癌淋巴结转移风险预测模型虽具备中等预测效能(验证集C统计量0.82),但所有研究均存在高偏倚风险,严重制约了临床转化价值。核心问题包括:单中心回顾性数据导致的代表性不足、模型验证与报告不规范、过度拟合现象明显。传统Logistic回归模型稳定性优于复杂机器学习算法,但两者均需严格的内部-外部验证策略。未来研究应优先遵循PROBAST与TRIPOD报告规范,开展大规模、多中心、前瞻性队列研究,整合多模态数据(影像、病理、分子标志物),并特别关注亚洲与欧美人群的种族差异。临床医生在应用现有模型时应保持审慎态度,将其作为决策辅助而非唯一依据。
Duan M, Li M, He L, et al. Risk prediction models for lymph node metastasis in early gastric cancer patients: a systematic review and meta-analysis. BMC Gastroenterol. 2025;25(1):776. Published 2025 Oct 31. doi:10.1186/s12876-025-04342-8
审批编号:CN-173226 有效期:2026/12/1
声明:材料由阿斯利康支持,仅供医疗卫生专业人士参考
排版编辑:肿瘤资讯-Sally











 苏公网安备32059002004080号
苏公网安备32059002004080号


