2023年欧洲肺癌大会(ELCC)已于2023年3月29日~4月1日在丹麦哥本哈根以线上线下相结合的形式举行。晚期非小细胞肺癌(NSCLC)靶向治疗研究共入选4个Oral(O)+5个Mini Oral(MO),主要涉及的靶点有EGFR经典突变、EGFR 20ins、KRAS、ROS1以及NTRK 。

EGFR篇
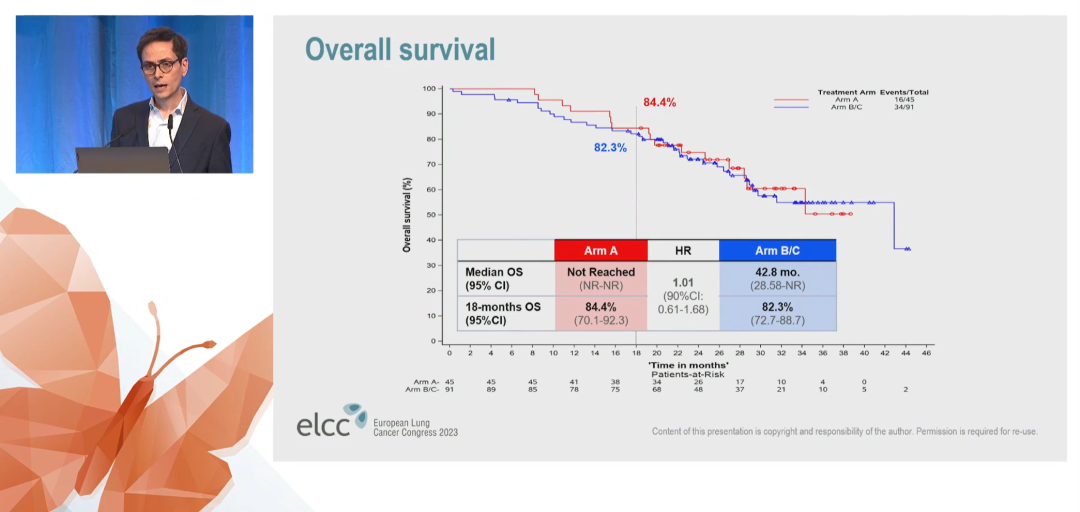
APPLE是II期三臂临床试验,分析奥希替尼 vs吉非替尼序贯奥希替尼一线治疗EGFR突变的NSCLC的疗效。本次大会将报道奥希替尼一线治疗(A组) vs 序贯治疗(B/C组)的探索性分析结果,在这项分析中,B组和C组被合并。
A组:一线使用奥希替尼直至按照RECIST 1.1标准评估出现PD
B组:一线使用吉非替尼至ctDNA发现EGFR T790M突变和/或按照RECIST 1.1标准评估出现PD,序贯奥希替尼治疗
C组:一线使用吉非替尼至按照RECIST 1.1标准评估出现PD,序贯奥希替尼治疗

指标 | A组 | B/C组 |
18个月PFS率 | 51.1% | 61% |
中位OS | NR | 42.8个月 |
18个月的OS率 | 84.4% | 82.3% |
中位颅内PFS(BPFS) | 34.3 | 22.3 |
18个月时的脑部PFS(BPFS)率 | 82.2% | 63.5% |
结论:
在晚期EGFR突变NSCLC中,相较于吉非替尼序贯奥希替尼治疗,一线使用奥希替尼治疗显著降低颅内病灶进展风险降低,两种治疗方案的OS相近。
大多数转移性EGFR突变NSCLC患者经过一线奥希替尼治疗后,仍会有一定的病灶残留,这可能会导致后续获得性耐药的出现。使用局部巩固治疗(LCT)消除残留疾病可能会延迟奥希替尼耐药的出现。但是奥希替尼联合局部放疗的安全性尚未被充分明确。本次ELCC大会报告了一项奥希替尼±LCT的随机II期研究的安全性数据。
单纯奥希替尼组最常见的3级AEs是低钠血症(4.8%)、转氨酶升高(4.8%)和肺炎(3.4%)。奥希替尼+LCT组最常见的3级AEs的是低钠血症(6.8%)、腹泻(3.4%)、脓胸(3.4%)和肺炎(1.7%)。
结论:
和单纯奥希替尼组相比,转移性EGFR突变NSCLC患者使用奥希替尼联合LCT,并未增加严重不良反应的发生率。
BOOSTER研究探索了携带继发性T790M突变的患者,在标准奥希替尼治疗基础上进一步联合贝伐单抗,二线治疗的疗效及安全性。既往数据显示,两组的中位PFS无差异,吸烟状况与治疗结果之间的相互作用已被确定,本研究探索了血浆样本ct-DNA的临床应用。
共计155例患者接受随机,其中基线时有136例(87%)患者、第9周时有110例(71%)患者、疾病进展时有65例(42%)患者有血浆NGS分析。
在71%(97/ 136)患者在基线时检测到EGFR T790M突变,但与患者PFS无关。第9周时,91%的患者无法检测到T790M突变,而在疾病进展时,34%的患者仍然存在T790M突变。
吸烟状态是预测 PFS的因素,交互性P=0.046,吸烟状态与TP53突变状态无关,63%的患者基线外周血可检测到TP53突变,基线携带TP53突变及21L858R突变是患者较差OS的独立预后因素。
结论:
吸烟人群更能够从奥希替尼联合贝伐珠单抗的治疗模式中获益,尤其是PFS,并没有发现其是由TP53或EGFR T790M 突变驱动的。基线P53及EGFR第21L858R突变与较差的预后有关。
Amivantamab(ami)是一种靶向EGFR和MET的双特异性抗体,基于CHRYSALIS研究,已于2021年获得FDA批注用于治疗用于治疗既往铂类化疗后进展的携带EGFR ex20ins突变的晚期NSCLC患者,本次ELCC大会将报道该研究的长期结果。
截至2022年9月,中位随访时间为19.2个月,共纳入了114例患者,48例(42%)患者存活。研究者评估的总缓解率(ORR)为37%(95% CI,28-46),中位缓解持续时间为12.5个月(95% CI,6.9-19.3),中位PFS为6.9个月(95% CI,5.6-8.8),中位OS为23个月(95% CI,18.5-29.5)。
在各亚组中均观察到了活性,包括老年患者(≥65岁和≥75岁患者的ORR分别为32%和33%)、多线经治患者(既往≥2线治疗的ORR为53%,既往免疫治疗为42%,既往EGFR TKI治疗为52%)、对既往铂类化疗敏感或耐药的患者(ORR分别为36%和31%)。
未检测到新的安全性信号,皮疹(所有等级,89%)和输注相关反应(67%)仍然是最常见的毒性反应。
接受Amivantamab治疗≥12个疗程的有48例(42%)患者,接受Amivantamab治疗中位2.6年的患者有15例(13%)。
结论:
Amivantamab在含铂化疗失败后晚期EGFR 20ins NSCLC患者展现出持续疗效,包括老年患者、既往接受过多种治疗的患者或铂类治疗敏感/难治的患者。Amivantamab对部分患者有长期疗效,其机制将进一步探讨。
KRAS G12C篇
单臂I/II期CodeBreak 100研究相信大家都非常熟悉,基于该研究结果,sotorasib于2021年5月获FDA批准成为首个针对KRAS突变的靶向药物。
本次ELCC大会报告的CodeBreak200研究是首个针对KRAS G12C靶点的经治的NSCLC患者接受受索托雷塞 vs 化疗头对头III期临床研究,去年ESMO大会上报道了CodeBreaK 200研究初步结果,在经治的KRAS G12C突变NSCLC患者中,索托雷塞展现出比多西他赛更好的ORR和PFS数据,但OS无显著差异。本次ELCC会议中将公布该研究的患者报告结局(PRO)。
结果显示,与接受索托雷塞治疗的患者相比,接受多西他赛治疗的患者受到不良反应的影响更明显(优势比[OR] 5.71),症状更加明显(疼痛:OR=2.94;肌肉痛:OR=4.40;关节痛:OR=4.17;喉咙痛:OR=4.26)。此外,接受多西他赛治疗患者的症状对日常活动的负面影响更大(疼痛:OR=3.18,肌肉疼痛:OR=3.90,关节疼痛:OR=10.68)。
索托雷塞治疗后患者生活质量(QOL)保持稳定,多西他赛治疗后5天,QQL开始下降,VAS评分相较于基线的变化:-8.4 vs 1.5;长期结果显示,多西他赛组VAS评分继续恶化,两组分别为-5.8和2.2。
结论:
EAP-436研究是一项全球真实世界研究,旨在真实世界中收集携带KRAS G12C突变且接受索托雷塞治疗的晚期NSCLC患者数据。在这一研究中,患者在真实世界中的中位PFS数据为6.7个月,本研究旨在报道该研究的中位OS数据。
经过中位13.6个月随访后,中位OS为9.5个月。PS评分0~1分及2分的患者,中位OS分别为10.3个月和7.9个月;既往接受一线、两线及≥两线的患者,中位OS分别为10.5个月、11.3个月和7.2个月;从不吸烟、当前吸烟及既往吸烟的患者,中位OS分别为18.0个月、5.8个月和10.5个月;有中枢神经系统转移和无中枢神经系统转移的患者,中位OS分别为9.5个月和10.3个月。结论:这是第一项索托雷塞在真实世界中的用药数据,OS获益与临床试验中观察到的数据一致。患者基线是否有脑转移对OS影响很小。
结论:

Adagrasib是第二款针对KRAS G12C抑制剂,基于 2 期 KRYSTAL-1 试验结果,2022年12月美国FDA加速批准其上市,是继索托雷塞之后FDA批准上市的第2款KRAS G12C抑制剂。
该研究共纳入116例患者,中位治疗线数为两线,盲法独立中央审查(BICR)的ORR为42.9%,DCR为79.5%,中位PFS为6.5个月,中位OS为12.6个月。
97%的患者发生了任何级别的治疗相关不良事件(TRAEs),最常见(>40%)的为腹泻(63%)、恶心(62%)、呕吐(47%)和疲劳(41%);43%的患者发生了3-4级TRAEs,最常见(≥5%)的为血清脂肪酶升高(6%)和贫血(5%);发生2例5级TRAEs;8例(7%)导致停药的TRAEs。在MAFC可评估的患者(n=35)中,BICR的ORR为60%(21/35)。
结论:
在携带KRAS G12C突变的非小细胞肺癌患者中,MRTX849展现出了较好的抗肿瘤活性,需要进一步分析Adagrasib的临床缓解是否与ctDNA中的MAFC相关。目前与多西他赛后线进行比较的III期临床研究正在进行中。
ROS1和NTRK篇
葆元医药的taletrectinib是一款在研的新一代ROS1和 NTRK高选择性、强效TKI,可穿越血脑屏障。本次更新了TRUST-I研究的1.5年随访数据。
TRUST-I研究是一项多中⼼、开放标签、单臂研究,有两个队列:ROS1 TKI初治组和克唑替尼经治组,TKI初治患者(n= 67)的中位随访时间为18.0个⽉,克唑替尼预处理患者(n=42)的中位随访时间为16.9个⽉。
结果显示,两组的cORR分别为92.5%和52.6%,未达到mDoR和mPFS。颅内ORR为91.6%,G2032R患者的ORR为80.0%。在I期研究的汇总分析中,初次TKI治疗和CRZ预处理的患者的ORR分别为89.5%和50.0%;mPFS为33.2个月和9.8个月。
在178例接受600 mg QD治疗的患者中,TEAE为92.7%;大多数(64.0%)为1-2级。最常见的TEAE是AST升高(60.7%)、ALT升高(55.6%)和腹泻(55.6%)。神经相关TEAE(头晕,18.5%;味觉障碍,12.4%)和因TEAE而中断治疗(3.4%)发生率较低。
结论:
随着随访的延长,taletrectinib展现出持续的临床获益,包括高反应率、延长PFS、强大的颅内活性、抗G2032R活性以及低神经不良事件发生率的耐受安全性。

拉罗替尼是一款强效透颅脑效果较好的口服TRK抑制剂,2018年11月26日,FDA已批准其上市,2022年4月份国内上市,
共计26例患者入组,12例患者存在中枢神经系统转移,23例患者疗效可进行评估。独立评审委员会评估的ORR为83%,包括2例CR,17例PR及4例SD,中位响应持续时间未达到,12个月的响应持续率为72%,中位PFS未达到,中位OS为40.7个月,治疗相关不良反应多数为1~2级,14例患者有ct-DNA数据,其中6例患者在治疗前检测到NTRK融合。
结论
拉罗曲替尼在携带NTRK基因融合的晚期肺癌患者中,包括那些未接受治疗的NSCLC或既往接受EGFR抑制剂治疗的患者,表现出持久的反应、延长的生存获益和良好的安全性。ctDNA下一代测序是检测NTRK基因融合或耐药突变的一种方法。
排版编辑:肿瘤资讯-晴天











 苏公网安备32059002004080号
苏公网安备32059002004080号


