近年来,黑色素瘤领域研究突飞猛进,为了促进黑色素瘤领域疾病认知和学术提升,值此春暖花开之际,诺华肿瘤医学部启动黑色素瘤文献月评项目。项目精选黑色素瘤领域最新发表研究成果,并邀请临床专家结合中国实践进行深入点评,本期为黑色素瘤文献月评第一期,本期发表的研究聚焦辅助治疗生物标志物分析、中枢转移流行病学、BRAF突变一线治疗等内容,特别邀请了北京大学肿瘤医院肾癌黑色素瘤内科毛丽丽教授为我们带来深入解读。
点评嘉宾

北京大学临床肿瘤学院
北京肿瘤医院 肾癌黑色素瘤内科
工作经历:2012年于悉尼westmead医院肿瘤中心及澳大利亚黑色素瘤研究中心(MIA)访问学习。主要诊治病种:肾癌靶向治疗,黑色素瘤化疗及靶向治疗。在以恶性黑色素瘤为主的皮肤肿瘤、肾细胞癌、尿路上皮癌为主的泌尿系肿瘤诊治方面具有丰富的经验,一直致力于化疗、靶向治疗、免疫治疗的相关工作及研究。参与《黑色素瘤》、《Brain metastasis from primary tumor》等专业著作的编译,在国内外医学杂志上发表多篇文章。
擅长疾病:恶性黑色素瘤、肾细胞癌、尿路上皮癌
1. 达拉非尼+曲美替尼对比安慰剂辅助治疗III期术后BRAF突变黑色素瘤3期随机试验(COMBI-AD ): 生物标志物探索性分析
Adjuvant dabrafenib plus trametinib versus placebo in patients with resected, BRAF(V600)-mutant, stage III melanoma (COMBI-AD): exploratory biomarker analyses from a randomised, phase 3 trial.
Lancet Oncol. [IF: 35.386]
背景:在COMBI-AD 3期临床试验中,达拉非尼联合曲美替尼相比安慰剂辅助治疗III期术后BRAFV600突变黑色素瘤患者,可以降低复发风险。本文采用预定的生物标志物探索性分析,旨在评价潜在预后或预测因子并研究靶向辅助治疗的耐药机制。
方法:COMBI-AD是一项随机、双盲、空白对照的3期临床试验,患者口服达拉非尼150 mg每日两次联合曲美替尼2 mg每日一次对比两种匹配安慰剂。入组标准:年龄不少于18岁、IIIA期(淋巴结转移>1 mm)完全切除或IIIB期或IIIC期皮肤黑色素瘤(基于AJCC第七版评价标准)、BRAFV600E 或BRAFV600K突变阳性患者。患者采用交互式语音应答系统按照1:1进行随机分组,按照突变型和疾病分期进行分层。患者、医生和分析数据的研究者之间在治疗分配过程中不互通。主要终点为无复发生存,即从随机分组到复发或者因任何原因死亡的时间。生物标记物评估为试验的预定探索终点。我们利用DNA二代测序评估了肿瘤的内在基因组特征,利用纳米链RNA分析评估了肿瘤微环境的特征,这可能提供了预后和预测信息。该试验在ClinicalTrials.gov上注册(NCT01682083),试验正在进行中,已停止招募患者。
结果:从2013年1月31日到2014年12月11日,共有870名患者参与了试验。截止2018年4月30日,达拉非尼联合曲美替尼组的中位随访时间为44个月(IQR 38-49);安慰剂组为42个月(21-49)。368例患者评估了肿瘤的内在基因组特征(DNA测序组),507例患者评估了肿瘤的微环境特征(纳米链RNA标记物组)。基线MAPK通路基因组改变不影响治疗效果或临床结果。在两个治疗组中,IFNγ信号较中位数的高表达是延长无复发生存的预后指标。在对照组中,肿瘤突变负荷是无复发生存的独立预后指标(高TMB; 风险比[HR] 0.56, 95% CI 0.37-0.85, p=0.0056),但在达拉非尼联合曲美替尼组并非独立预后指标(0.83, 95% CI 0.53-1.32, p=0.44)。肿瘤突变负荷较低约2%的患者似乎从靶向治疗中获得了实际长期无复发生存获益(HR [与安慰剂相比] 0.49, 95% CI 0.35-0.68, p<0.0001)。然而,高肿瘤突变负荷的患者使用靶向治疗的效果似乎不那么明显(HR [与安慰剂相比] 0.75, 95% CI 0.44-1.26, p=0.27),特别是如果患者的IFNγ信号低于中位数的情况(HR 0.88 [95% CI 0.40-1.93], p=0.74)。
结论:肿瘤突变负荷本身或联合IFNγ基因表达信号或其他适应性免疫反应的标记可能与识别从靶向治疗中可能获得临床获益的III期黑色素瘤患者相关。未来有必要通过临床试验进一步验证。
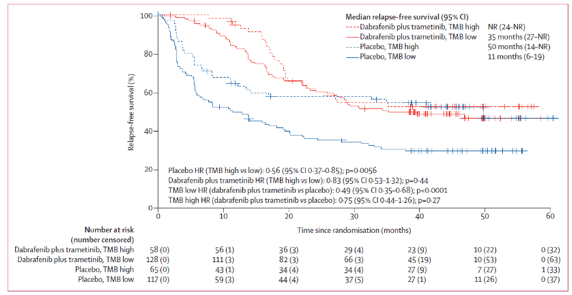
图1. TMB的预后影响
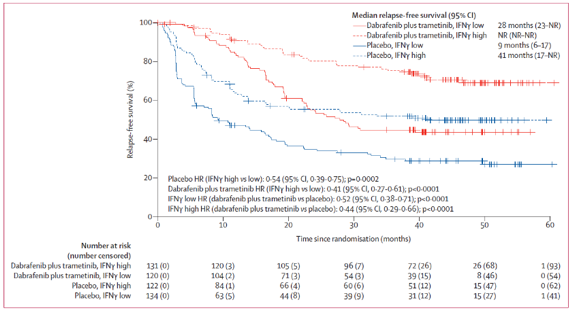
图 2. IFNγ基因信号的预后影响
Combi-AD研究是奠定达拉非尼+曲美替尼在BRAF突变黑色素瘤术后患者辅助治疗基础的一项研究,在此研究的基础上还进行了生物标志物的检测和分析,根据患者基线和复发时提供的DNA及RNA标本,共计507例患者接受了NanoString 生物标志物的检测,368例患者接受了DNA测序的检测。
DNA测序中,367例存在BRAF V600E/K突变,7%的患者存在BRAF扩增(拷贝数>7),19%的患者至少存在一种MAPK通路基因的突变,患者的中位肿瘤突变负荷(TMB)是7.3。亚组分析显示,在对照组中,TMB越高,无复发生存期越长(HR 0·56,p=0.0056)。低TMB患者接受达拉非尼+曲美替尼治疗无复发生存期更长(HR0.49,p<0.0001)。由于中国黑色素瘤患者普遍肿瘤突变负荷较低,或许D+T靶向辅助治疗的获益会更大。肿瘤的免疫特征检测包括T细胞炎性及IFNγ相关的基因。结果显示无论是试验组还是对照组,IFNγ基因高表达(>中位数)的患者无复发生存期更长。
这一研究结果为我们展示了BRAF突变患者的基因表达和变异情况,提示TMB和IFNγ通路基因表达可能对患者的治疗和预后存在影响,但这一结果还需要更多的数据支持,距离临床应用可能还存在一段距离。
2. 基于AJCC第八版的III期黑色素瘤患者CNS转移累计发生率和预测因素
Cumulative Incidence and Predictors of CNS Metastasis for Patients With American Joint Committee on Cancer 8th Edition Stage III Melanoma.
J Clin Oncol. [IF: 28.245 ]
目的:提高对CNS转移的发生率、危险因素和时间的认识,为黑色素瘤患者的管理策略提供依据。
患者和方法:临床数据源于美国和澳大利亚两大黑色素瘤中心数据库,共1918例符合AJCC第八版的III期黑色素瘤患者,患者诊断时间为1998-2014年,符合在4个月内基线诊断无影像学CNS转移。CNS转移的累积发生率根据竞争性死亡风险因素计算得到,并以III期诊断、诊断后1年、2年和5年作为时间截点。
结果:中位随访70.2个月,711例患者(37.1%)出现远处复发。CNS是第一个远处转移部位占3.9%,CNS和颅外(EC)占1.8%,EC占31.4%。总的来说,16.7%的患者在随访中确诊为CNS转移。CNS转移的累积发生率1年为3.6% (95% CI, 2.9%-4.6%),2年为9.6% (95% CI, 8.3%-11.0%),5年为15.8% (95% CI, 14.1%-17.6%)。患者的性别、年龄、AJCC分期、原发肿瘤部位和原发肿瘤有丝分裂率对CNS转移风险有显著影响。高原发肿瘤有丝分裂率与诊断时及随后所有时间点的CNS转移风险增加显著相关。
结论:在两大中心、地理位置不同的黑色素瘤III期患者中,CNS转移率相似。结果强调了原发肿瘤有丝分裂率的重要性。此外,它们还为制定循证管理策略和评估当代辅助治疗对CNS转移风险的影响提供了框架性意见。
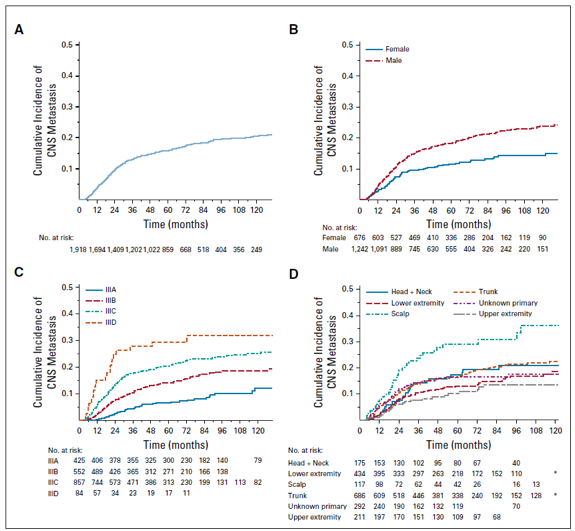
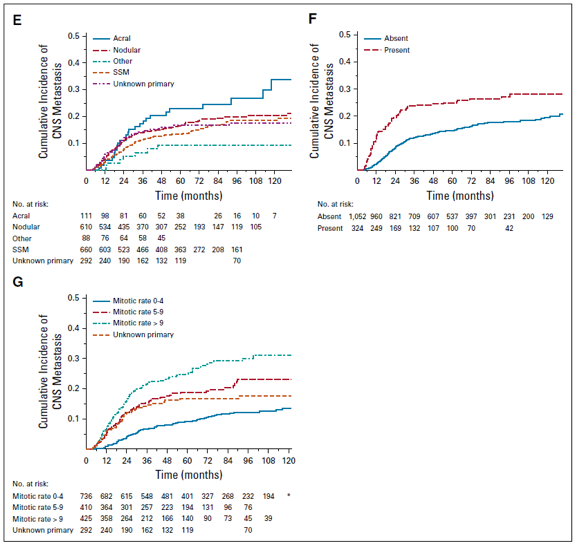
图3. CNS转移单变量累计发生率和基于分层的结果(性别、AJCC第八版患者分期、原发肿瘤位置、黑色素瘤亚型、淋巴结外侵犯、有丝分裂数)
3. BRAFV600突变转移性黑色素瘤患者接受达拉非尼单药治疗长期获益:2期和3期临床试验分析
Long-term outcomes in patients with BRAF V600-mutant metastatic melanoma receiving dabrafenib monotherapy: Analysis from phase 2 and 3 clinical trials.
Eur J Cancer. [IF: 6.680]
背景:前期对BREAK-2和BREAK-3的分析表明,在一些BRAFV600突变的转移性黑素瘤(MM)患者中,达拉非尼可达到≥3年的持久获益;然而,需要更长随访来充分确定达拉非尼对这些患者的长期影响。
方法:BREAK-2是一项单臂2期研究,评估达拉非尼对未经治疗或既往治疗的BRAFV600E/K突变MM的治疗效果。BREAK-3是一项随机(3:1)3期研究,评估了达拉非尼对比达卡巴嗪对未经治疗不可切除或转移性BRAFV600E突变MM的治疗效果。本文进行了五年数据分析。
结果:所有BREAK-2入组患者(N = 92 [V600E, N = 76;V600K, n = 16])在数据截止时中断治疗。中位随访时间为13.0个月。在BRAFV600E患者中,5年无进展生存率(PFS)和总生存率(OS)分别为11%和20%。22%的患者接受了后续免疫治疗。在BREAK-3中,达拉非尼组(n = 187)和达卡巴嗪组(n = 63)的中位随访时间分别为17.0和12.0个月。37例(59%)达卡巴嗪组患者在疾病进展后按方案转入达拉非尼组治疗。达拉非尼组的5年PFS率为12%;5年截点时,所有服用达卡巴嗪的病人均进展或失访。与达卡巴嗪相比,达拉非尼改善了 PFS,且显著改善与乳酸脱氢酶基线水平无关。达拉非尼和达卡巴嗪的5年OS率分别为24%和22%。随后的治疗包括anti-CTLA-4 (达拉非尼 [24%] 和达卡巴嗪 [24%])和/或anti-PD-1(8%和2%)治疗。无新的安全性问题。
结论和相关性:这些数据代表了对达拉非尼单药治疗的延长随访,证明在部分患者中可实现≥5年的长期获益。
4. 局部进展和寡转移黑色素瘤的BRAF-靶向新辅助治疗
Neoadjuvant BRAF-targeted therapy in regionally advanced and oligometastatic melanoma.
Pigment Cell Melanoma Res. [IF: 4.172]
目前对局部和寡转移黑色素瘤的治疗通常是手术治疗;然而,由于肿瘤的位置/大小和/或手术的预计发病率,一些患者无法进行切除。虽然目前还没有针对黑色素瘤新辅助治疗的指南,但BRAF-靶向新辅助治疗可能使手术变得更加可行。我们对23例BRAF V600突变的III/IV期黑色素瘤患者进行了回顾性分析,这些患者在术前接受了BRAF-靶向治疗,但未接受任何辅助治疗。本文评估了手术标本、术前影像和临床结果。
结果:23例患者中有10例(44%)获得了病理完全缓解(pCR),而术前影像学检查的结果与病理缓解无相关性。中位随访43个月后,仅有1例(10%)pCR患者复发,而未获得pCR的13例(62%)患者中有8例复发。与肿瘤残留患者相比,pCR患者的RFS和OS率有显著提高。BRAF-靶向新辅助治疗与III-IV期黑色素瘤患者的pCR率较高有相关性,而pCR率提高可能与RFS和OS提高相关。
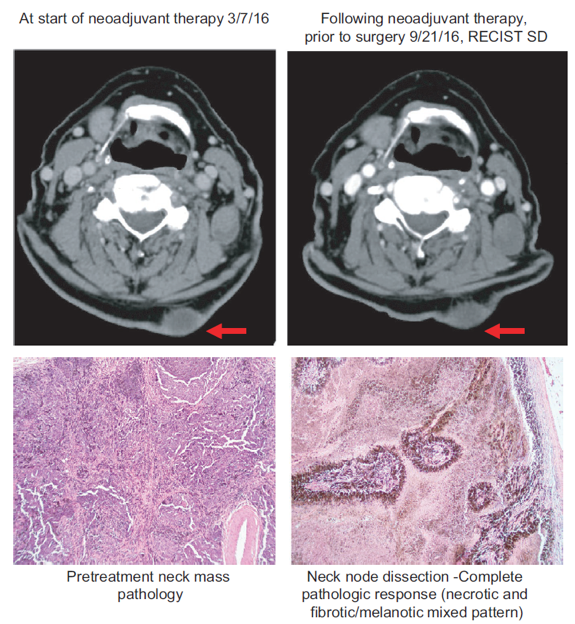
图4. 患者接受6个月达拉非尼+曲美替尼新辅助治疗影响及病理对比图。CT显示治疗结束时SD,术后病理显示为pCR
这是一项针对BRAF突变的III/IV期患者采用BRAF抑制剂的新辅助治疗的回顾性研究。共入组23例患者,8例患者接受单药(维莫非尼或达拉非尼)治疗,2例患者接受V+C,12例D+T,1例E+B,结果显示,有10例(44%)获得了病理完全缓解(pCR)。中位随访43个月后,仅有1例(10%)pCR患者复发,而未获得pCR的患者中有8例复发。pCR是预测 RFS和OS的重要指标。这一研究结果与既往报告结果类似,在2019年ASCO的口头报告中,就有一项新辅助治疗的汇总分析,其中有两个研究探索了D+T新辅助的结果,pCR率为49-58%。目前全球的新辅助治疗研究正在如火如荼地进行中,BRAF突变患者作为一类特殊的人群,容易出现复发转移,因此我们也需要更多的研究数据来协助指导这部分患者的治疗。
5. BRAF突变转移性黑色素瘤最佳治疗方案的确定
Identifying the optimum first-line therapy in BRAF-mutant metastatic melanoma
Expert Rev Anticancer Ther. [IF: 2.571]
简介:分子靶向药物和免疫检查点抑制剂的出现对BRAF突变转移性黑色素瘤的治疗和预后产生了积极的变革。然而,两种治疗方案均有利弊,如何合理地应用在前线和后线治疗在临床中引起了考量。
研究范围:我们对所有BRAF突变转移性黑色素瘤患者的批准治疗方法进行了讨论,并根据关键试验数据对其有效性和安全性进行评估。由于前瞻性随机数据尚未公布,本文回顾性对比BRAF/MEK抑制剂与免疫检查点抑制剂两方案的全部优点并优化其实施。靶向治疗和免疫治疗同时或序贯的方案在临床前和早期临床的结果也进行了讨论。
专家意见:BRAF/MEK抑制剂能够为BRAF突变转移性黑色素瘤的治疗带来快速和深度缓解,因此应纳入这类疾病,尤其是强侵袭性和较大肿瘤病例的一线治疗用药。而免疫检查点抑制剂单药或双药方案可为患者带来较长持续缓解,可考虑在状况较好的BRAF突变黑色素瘤患者中作为一线治疗,或作为靶向治疗后线方案,或应用在高危患者的免疫/靶向联合方案中。相关正在开展的疗法比较或联合方案的研究结果有望为我们带来更为有效的循证医学证据。
表1. 依据预后特征分层的专家建议及已批准用于BRAF突变转移性黑色素瘤的一线治疗方案
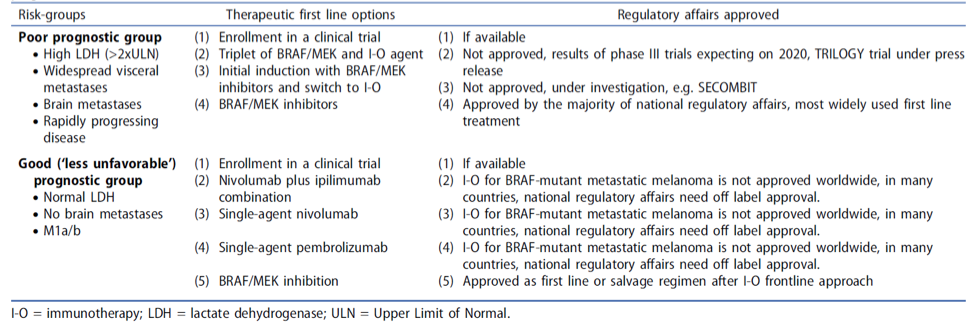
最后这篇文献是一篇综述,探讨了我们最关心的话题:BRAF突变患者的一线治疗究竟是选择靶向治疗还是免疫治疗。本文从回顾性分析的角度,对比了BRAF/MEK抑制剂与免疫检查点抑制剂治疗的特点,也提出了一些联合治疗或序贯治疗的建议。专家意见:BRAF/MEK抑制剂可以快速缩小肿瘤,应作为BRAF突变转移性黑色素瘤,尤其是侵袭性强和较大肿瘤病例的一线治疗方案。免疫检查点抑制剂单药或双药方案可获得较长持续缓解,可考虑在状况较好的BRAF突变黑色素瘤患者中作为一线治疗,或作为靶向治疗后线方案,或应用在高危患者的免疫/靶向联合方案中。目前还有一些关于靶向免疫联合或序贯的临床研究(DREAMseq,SECOMBIT)在进行当中,我们也期待后续的研究结果。
此外本篇文献的数据主要来自于欧美人群的研究结果,中国黑色素瘤患者的临床特征及基因分型均不同于欧美人群,BRAF突变的发生率相对偏低,免疫治疗的疗效也偏低,因此建议医生和患者首先尽早进行基因检测,另外要结合患者的临床特点、基因结果,根据我国的黑色素瘤指南来考虑治疗方案的选择,切忌盲目地套用国外的研究数据。
排版编辑:Vicky
1. Lancet Oncol. 2020 Jan 30. pii: S1470-2045 (20) 30062-0.
2. J Clin Oncol. 2020 Jan 28:JCO1901508.
3. Eur J Cancer. 2020 Jan; 125: 114-120.
4. Pigment Cell Melanoma Res. 2020 Jan; 33(1):86-95.
5. Expert Rev Anticancer Ther. 2020 Jan; 20(1):53-62.















 苏公网安备32059002004080号
苏公网安备32059002004080号


