套细胞淋巴瘤(MCL)作为一种罕见的B细胞非霍奇金淋巴瘤,以病情进展迅速、预后较差为典型特征,曾被认为是难以治愈的血液系统恶性肿瘤。自1992年MCL被确立为独立淋巴瘤亚型以来,其治疗格局历经多轮革新——从传统化疗到免疫化疗,再到近年来的靶向治疗,每一次治疗技术的突破都推动着患者生存的改善。然而,不同年龄、体能状态患者的治疗反应差异显著,年轻患者与老年患者的预后差距持续存在,且既往生存趋势研究多依赖人群登记数据,缺乏对治疗方案细节和临床特征的系统分析。近日,Haematologica杂志发表的一项重磅荟萃分析,整合了1996~2020年间六项随机Ⅲ期临床试验数据,全面揭示了近25年来晚期MCL患者的生存演变规律,明确了关键治疗进展对预后的驱动作用,为临床治疗策略优化提供了高级别循证依据。

在1996年之前,以CHOP为代表的传统化疗是MCL的主要治疗手段,但疗效有限,年轻患者的5年总生存(OS)率仅约50%,老年患者更是不足40%。
随着医学研究的深入,一系列关键治疗技术相继问世并应用于临床:2000年后,利妥昔单抗的加入形成免疫化疗方案(如R-CHOP),显著提升了治疗缓解率;自体干细胞移植(ASCT)的应用为年轻患者提供了巩固治疗的新选择;高剂量阿糖胞苷的纳入进一步增强了化疗强度;近年来,布鲁顿酪氨酸激酶(BTK)抑制剂(如伊布替尼)的出现,为靶向治疗开辟了新路径。
这些治疗革新是否持续改善了MCL患者的长期生存?不同年龄群体的获益差异如何?哪些治疗方案是生存改善的核心驱动力?这些问题亟需通过长期、大样本的临床数据进行验证。
研究设计与数据来源
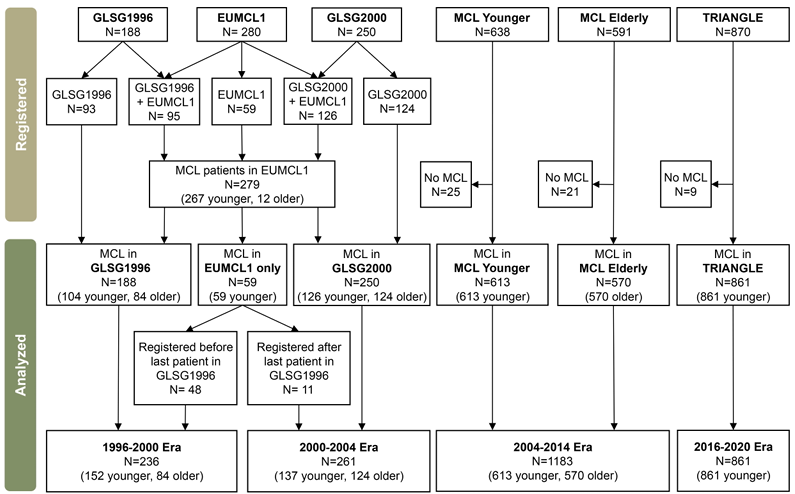
本研究为荟萃分析,纳入了1996~2020年间开展的六项国际多中心随机Ⅲ期临床试验:GLSG1996、GLSG2000、European MCL trial 1、MCL Younger、MCL Elderly、TRIANGLE。这些试验均针对初治晚期(Ⅲ/Ⅳ期)MCL患者,采用相似的纳入排除标准,治疗方案覆盖了从传统化疗到靶向治疗的完整演变过程,数据质量高且具有连续性。
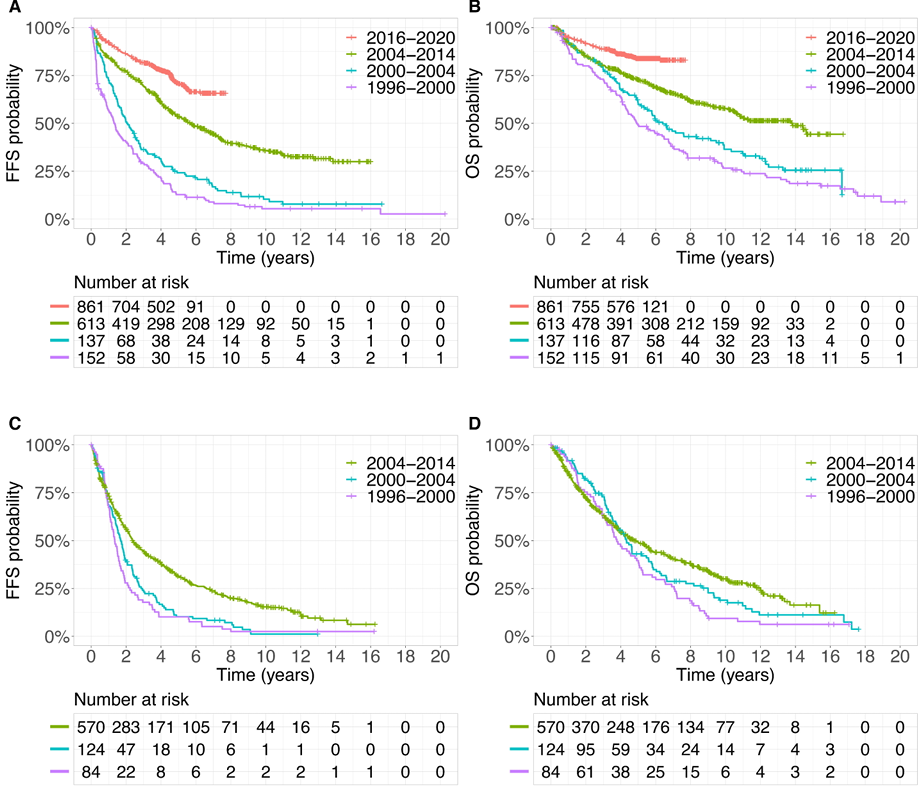
研究将患者按入组时期分为四个时代:1996~2000年、2000~2004年、2004~2014年、2016~2020年;按年龄和是否适合移植分为年轻患者(≤65岁且适合高剂量治疗)和老年患者(>65岁或不适合高剂量治疗)两组,分别分析生存趋势。
根据试验设计,将治疗方案按时代演变分为四类:1996~2000年以CHOP/MCP(米托蒽醌+苯丁酸氮芥+泼尼松)化疗为主;2000~2004年引入利妥昔单抗,形成R-CHOP等免疫化疗方案;2004~2014年在年轻患者中推广ASCT巩固治疗和高剂量阿糖胞苷方案,老年患者采用R-CHOP/R-FC(利妥昔单抗+氟达拉滨+环磷酰胺)联合维持治疗;2016~2020年引入伊布替尼等BTK抑制剂,形成靶向联合免疫化疗方案。
患者基线特征
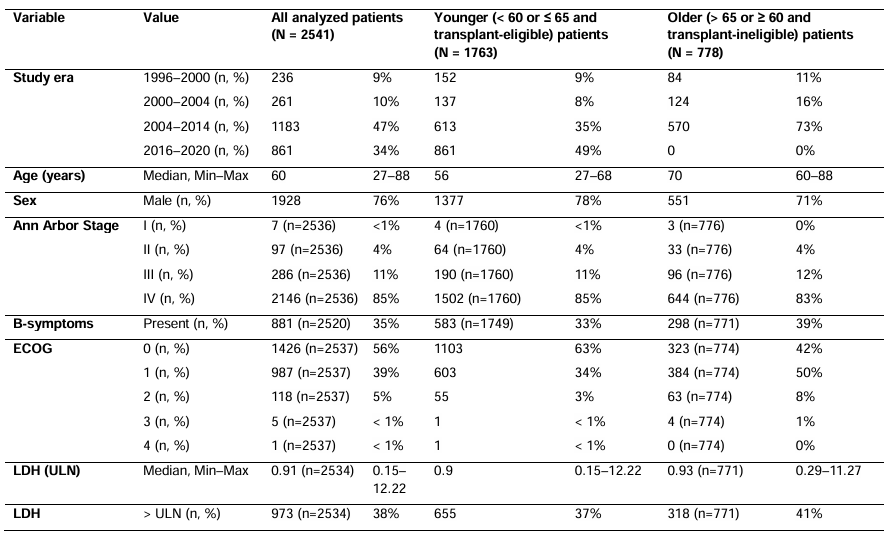
共纳入2541例确诊MCL患者,其中年轻患者1763例(中位年龄56岁),老年患者778例(中位年龄70岁);男性占76%,85%为Ⅳ期疾病,45%为低危MIPI评分。随着时代演进,年轻患者的ECOG体能状态逐渐改善,Ki-67指数(增殖活性标志物)呈升高趋势;老年患者的高危MIPI评分比例增加,LDH水平(疾病负荷标志物)有所上升。中位随访时间最长达15.5年(1996~2000年时代),最短为4.6年(2016~2020年时代)。
表1. 所有被分析患者的基线特征
年轻患者生存显著改善
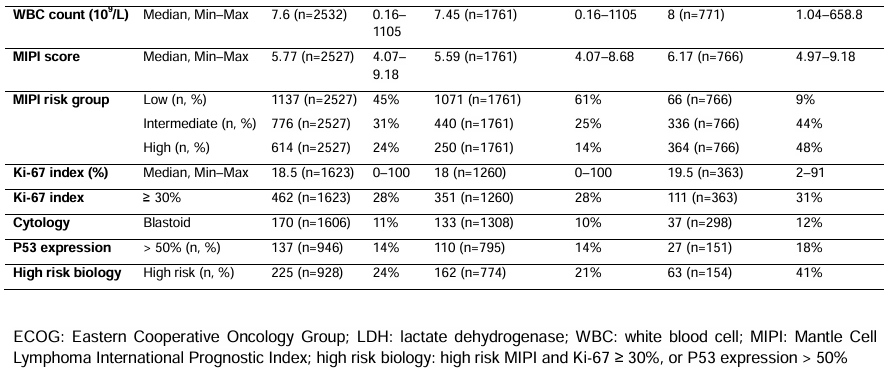
无失败生存期(FFS):1996~2000年中位FFS仅1.3年,2000~2004年延长至2.1年,2004~2014年大幅提升至5.7年,2016~2020年未达到中位FFS;5年FFS率从13%攀升至71%,校正MIPI评分后,2004~2014年相对1996~2000年的风险比(HR)为0.44(P<0.0001),2016~2020年HR进一步降至0.51(P<0.0001)。
总生存期(OS):1996~2000年中位OS为4.9年,2004~2014年延长至13.8年,2016~2020年未达到中位OS;5年OS率从49%提升至84%,2004~2014年和2016~2020年的HR分别为0.56和0.52(均P<0.0001)。动态趋势分析显示,2000~2005年间年轻患者的治疗失败风险和死亡风险呈快速下降趋势,之后持续改善。
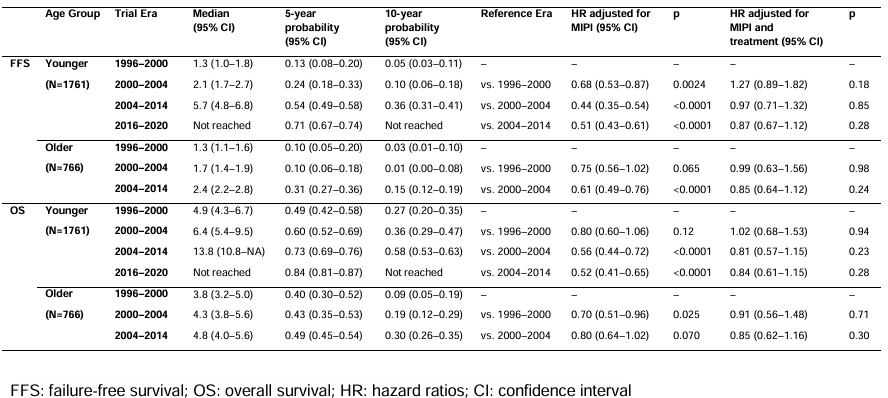
表2. 年轻和老年患者FFS和OS的风险比
老年患者生存适度提升
FFS:1996~2000年中位FFS为1.3年,2004~2014年延长至2.4年;5年FFS率从10%提升至31%,2004~2014年相对2000~2004年的HR为0.61(P<0.0001)。
OS:1996~2000年中位OS为3.8年,2004~2014年延长至4.8年;5年OS率从40%提升至49%,2000~2004年相对1996~2000年的HR为0.70(P=0.025),但2004~2014年相对2000~2004年的HR为0.80(P=0.070),无统计学差异。动态趋势显示,老年患者的FFS改善主要集中在2000~2005年,之后趋于稳定。
治疗方案是生存改善的核心驱动因素
校正MIPI评分和治疗方案后,不同时代的生存差异基本消失,证实治疗进展是生存改善的主要原因:
年轻患者中,与1996~2000年的CHOP + 干扰素/ASCT方案相比,2016~2020年的伊布替尼联合R-CHOP/R-DHAP+ASCT方案使FFS风险降低86%(HR=0.14,P<0.0001),OS风险降低81%(HR=0.19,P<0.0001);利妥昔单抗、ASCT、高剂量阿糖胞苷和伊布替尼的依次引入,逐步推动生存提升。
老年患者中,R-CHOP联合利妥昔单抗维持治疗相比传统CHOP + 干扰素方案,FFS和OS显著改善(HR分别为0.42和0.54,均P<0.0001),但与年轻患者相比,缺乏ASCT和高剂量化疗等强化手段,生存提升幅度有限。
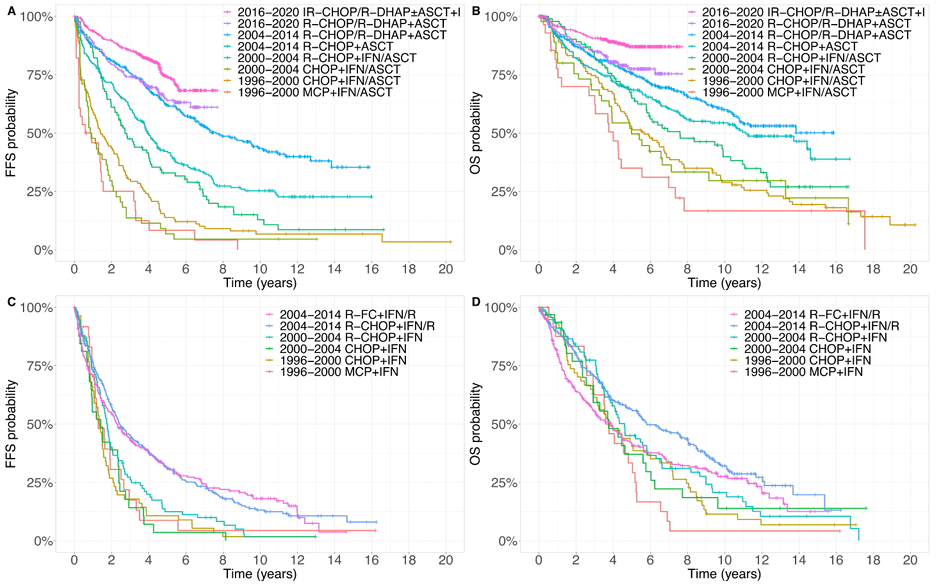 图3.按试验时代和治疗列出的Kaplan-Meier曲线,(A)年轻患者的FFS,(B)年轻患者的OS,(C)老年患者的FFS,和(D)老年患者的OS
图3.按试验时代和治疗列出的Kaplan-Meier曲线,(A)年轻患者的FFS,(B)年轻患者的OS,(C)老年患者的FFS,和(D)老年患者的OS
亚组分析结果
MIPI评分亚组:低、中、高危年轻患者均从治疗进展中获益,其中中高危患者的生存改善更为显著。
生物学特征亚组:Ki-67≥30%(高增殖活性)、胚系样细胞学、P53高表达等高危生物学特征的年轻患者,生存仍有明显改善,但预后仍差于低危生物学特征患者。
治疗反应亚组:对诱导治疗有效的年轻患者,ASCT巩固治疗和利妥昔单抗维持治疗可进一步延长生存;老年患者中,R-CHOP诱导后接受利妥昔单抗维持的患者,FFS和OS均显著优于干扰素维持患者。
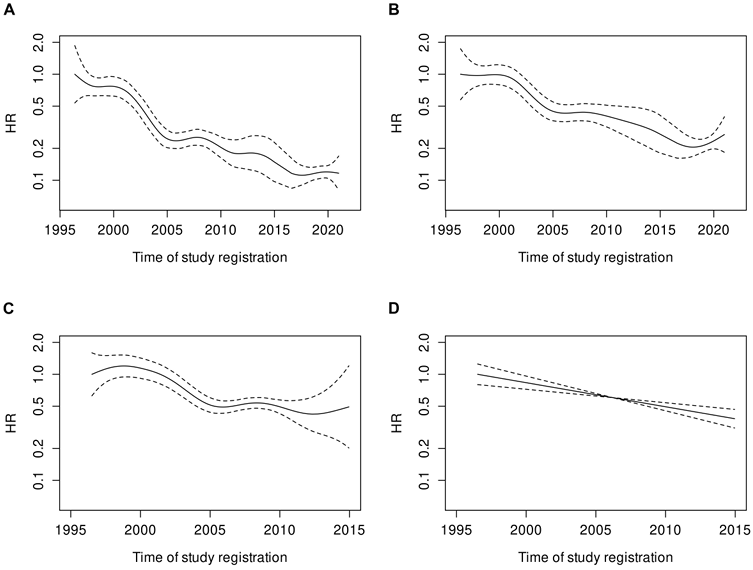
图4. MIPI调整的风险比和95%置信区间随试验入组时间的动态趋势(A)年轻患者的FFS、(B)年轻患者的OS、(C)老年患者的FFS和(D)老年患者的OS
总结
本项涵盖2541例患者、跨度25年的荟萃分析,清晰展现了晚期MCL患者生存的演变轨迹,证实了治疗革新对预后的决定性作用,为临床实践提供了重要指导。
研究的核心发现表明,年轻晚期MCL患者的生存获得了革命性改善——5年OS率从49%提升至84%,中位OS从4.9年延长至未达到,这一进步主要得益于四大关键治疗技术的依次应用:利妥昔单抗的加入使免疫化疗取代传统化疗,ASCT巩固治疗降低复发风险,高剂量阿糖胞苷增强肿瘤杀伤效果,伊布替尼等靶向药物进一步优化疗效。尤其是2016~2020年靶向联合免疫化疗方案的应用,使年轻患者的长期无治疗生存成为可能,彻底改变了MCL的治疗格局。
相比之下,老年患者的生存改善较为温和,5年OS率从40%提升至49%,中位OS仅从3.8年延长至4.8年,这与老年患者难以耐受高强度化疗和ASCT、治疗方案相对保守密切相关。尽管利妥昔单抗和温和免疫化疗方案已显著改善其预后,但仍存在巨大的未满足医疗需求,亟需开发更安全、高效的靶向治疗组合。
总之,近25年来,MCL的治疗取得了里程碑式进展,年轻患者的预后已得到根本性改善,而老年患者的治疗仍需突破。随着靶向治疗和免疫治疗技术的持续革新,有望进一步缩小不同年龄群体的预后差距,让更多MCL患者获得长期生存甚至治愈的机会。临床医生应根据患者的年龄、体能状态和生物学特征,制定个体化治疗方案,最大限度发挥治疗获益。
Linmiao Jiang, et al; Marked survival gains in patients ≤ 65 years with advanced-stage mantle cell lymphoma: a pooled analysis of six randomized phase III trials, 1996-2020;https://haematologica.org/article/view/12967.
排版编辑:Mathilda











 苏公网安备32059002004080号
苏公网安备32059002004080号


