2026年美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)于美国旧金山召开。来自西班牙Vall d'Hebron肿瘤研究所的Elena Elez教授以“靶向BRAF突变的新策略”为题,系统梳理了BRAF突变在消化道肿瘤中的治疗进展。从25年前BRAF突变的首次发现,到如今肠癌一线治疗方案的确立,BRAF突变结直肠癌(CRC)患者的生存预后正在被改写。Elez教授的报告不仅呈现了关键临床研究的核心数据,更从转化研究视角阐释了耐药机制与新型药物的研发方向,为这一预后不良的分子亚型勾勒出更为清晰的治疗和发展路径。

BRAF突变在消化道肿瘤中的分布与分类特征
BRAF突变的发现迄今已有25年历史,这一突变广泛存在于多种实体瘤和血液系统恶性肿瘤中。在消化道肿瘤领域,结直肠癌(CRC)中BRAF突变的发生率为8%~12%,其中绝大多数为V600E突变。除了结直肠癌外,小肠癌、胆管癌以及胃食管肿瘤和神经内分泌肿瘤中也可检测到BRAF突变,但发生率相对较低。
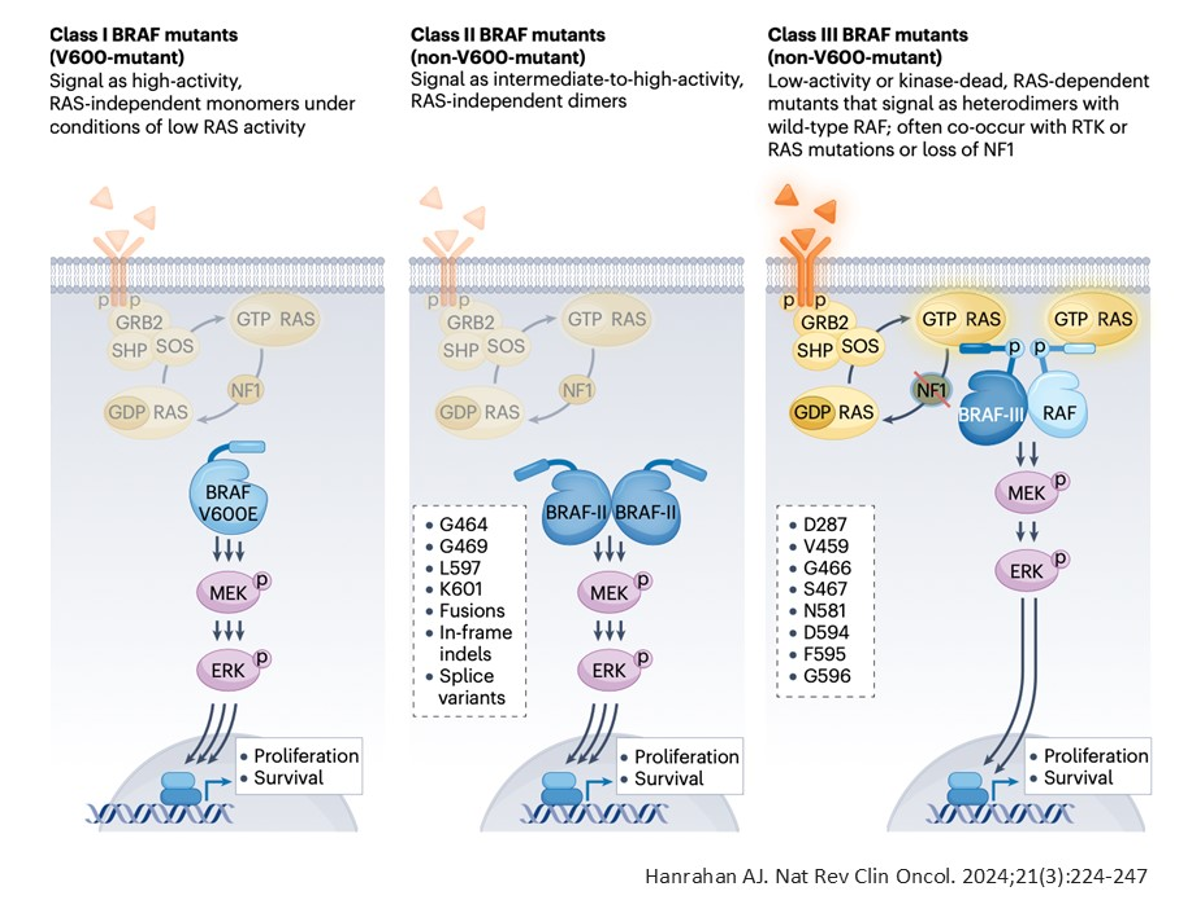
从功能角度而言,BRAF突变可依据其对BRAF二聚化的影响进行分类。Ⅰ类和Ⅱ类突变不依赖RAS激活,可直接激活MAPK信号通路;而Ⅲ类突变则依赖于RAS的激活状态。这一分类对于治疗策略的制定具有重要意义——以结直肠癌为例,若患者携带Ⅲ类BRAF突变且RAS为野生型,则可能从抗EGFR治疗中获益。
组织学背景决定BRAF抑制剂单药疗效差异
BRAF抑制剂在不同肿瘤类型中的疗效呈现明显差异。以早期的BRAF抑制剂维莫非尼为例,其在转移性黑色素瘤中的客观缓解率(ORR)超过50%,而在转移性结直肠癌(mCRC)中为5%。其他多种BRAF抑制剂单药治疗也观察到类似的结果,这提示肿瘤的组织学背景与BRAF突变状态共同影响着治疗反应。
VE-BASKET试验是首个基于分子特征(BRAF V600E突变)而非组织学类型纳入患者的临床研究,涵盖了多个不同肿瘤类型的队列。值得注意的是,仅结直肠癌队列需要通过修订方案、引入额外治疗靶点的药物(如靶向EGFR的西妥昔单抗)才能观察到治疗应答。后续的转化研究揭示了其中的机制:BRAF V600E抑制会诱发EGFR的快速反馈激活,使肿瘤细胞在BRAF阻断的情况下仍能持续增殖。此外,研究还发现,ERK抑制在结肠癌细胞中仅为短暂性的,而在黑色素瘤中则可持续维持——这是由于结肠癌中存在CRAF激活或BRAF-CRAF异源二聚体的反式激活机制。这些发现为理解结直肠癌对BRAF抑制剂单药治疗原发耐药的机制提供了重要依据。
非结直肠肿瘤中BRAF靶向治疗的关键数据
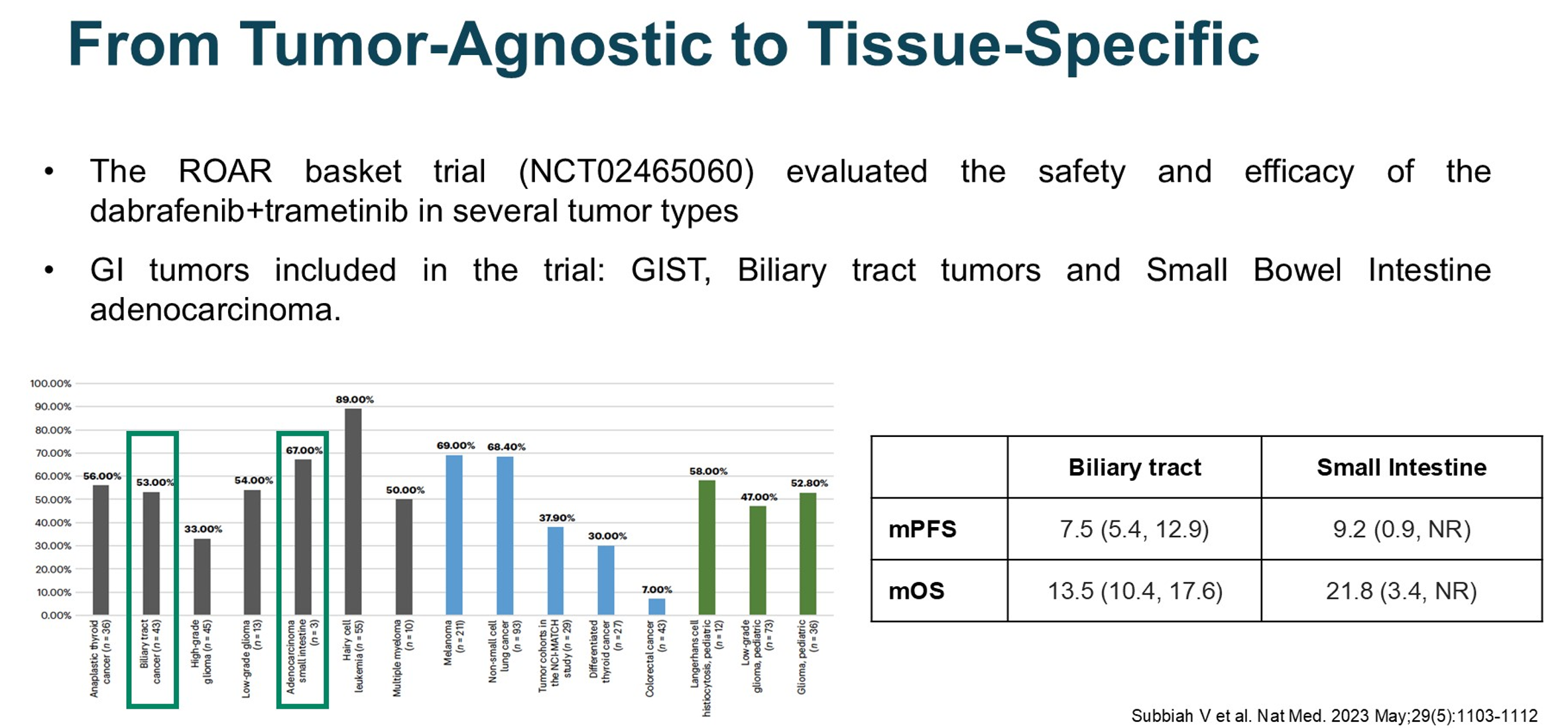
ROAR Basket试验是非结直肠癌实体瘤BRAF靶向治疗的标志性研究,纳入了包括胆道肿瘤、胃肠间质瘤和小肠腺癌在内的多个消化道肿瘤队列。研究结果显示,达拉非尼联合曲美替尼在不同肿瘤类型中展现出差异化的疗效:结直肠癌患者的ORR为7%,而胆道肿瘤和小肠腺癌患者的ORR分别达到53%和67%。中位无进展生存期(mPFS)和总生存期(mOS)数据令人鼓舞(胆道肿瘤:mPFS 7.5个月,mOS 13.5个月;小肠腺癌:mPFS 9.2个月,mOS 21.8个月)。基于上述结果,达拉非尼联合曲美替尼方案随后获批用于治疗携带BRAF V600E突变的实体瘤患者。在安全性方面,该方案的主要治疗相关不良反应(TRAEs)为发热和乏力,头痛也较为常见,多见于治疗初期。
BRAF V600E突变mCRC
临床/病理特征与预后
转移性结直肠癌中的突变以BRAF V600E为主,占比达8%~12%。这一突变更常见于高龄女性患者和右半结肠肿瘤,且20%~25%的病例同时伴有微卫星高度不稳定(MSI-H)状态,这对于治疗方案及治疗顺序的制定具有重要指导意义。
BRAF V600E突变的核心特征在于其预示着不良预后,同时该突变是抗EGFR治疗反应的负性预测因子,是抗BRAF治疗反应的阳性预测因子。
从分子层面而言,BRAF V600E突变结直肠癌是一个异质性群体。转录组学分析显示,这类肿瘤可大致分为CMS1(占比68%)、CMS2(占比5%)、CMS3(占比10%)和CMS4(占比17%)等亚型,并可进一步细分为BM1和BM2亚型,分别以MAPK通路激活或细胞周期增殖为主要特征。这种分子异质性为未来开发新型治疗策略提供了理论基础。

BEACON研究确立BRAF V600E突变mCRC二线及后线治疗标准
鉴于黑色素瘤中BRAF抑制剂联合MEK抑制剂的成功经验并不适用于结直肠癌,基于前述转化研究的发现,BRAF抑制剂与EGFR抑制剂的联合方案成为合理选择。
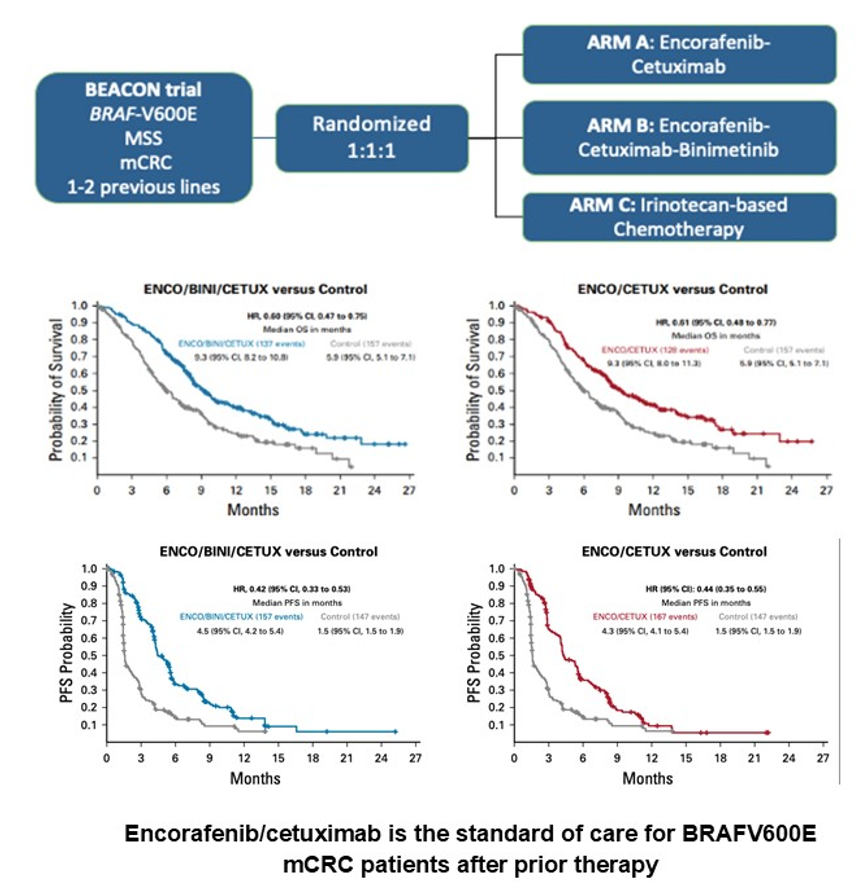
BEACON研究是一项随机对照Ⅲ期临床试验,比较了恩考芬尼联合西妥昔单抗(双药方案)、恩考芬尼联合西妥昔单抗和Binimetinib(三药方案)与当时的标准治疗方案在既往接受过1~2线治疗失败的BRAF V600E突变mCRC患者中的疗效和安全性。研究达到了主要终点,证实双药和三药方案均优于标准治疗,但双药与三药方案之间未见显著差异。基于此,恩考芬尼联合西妥昔单抗的双药方案获批用于既往接受过系统治疗的BRAF V600E突变mCRC患者。
BREAKWATER研究开启BRAF V600E突变mCRC一线治疗新时代
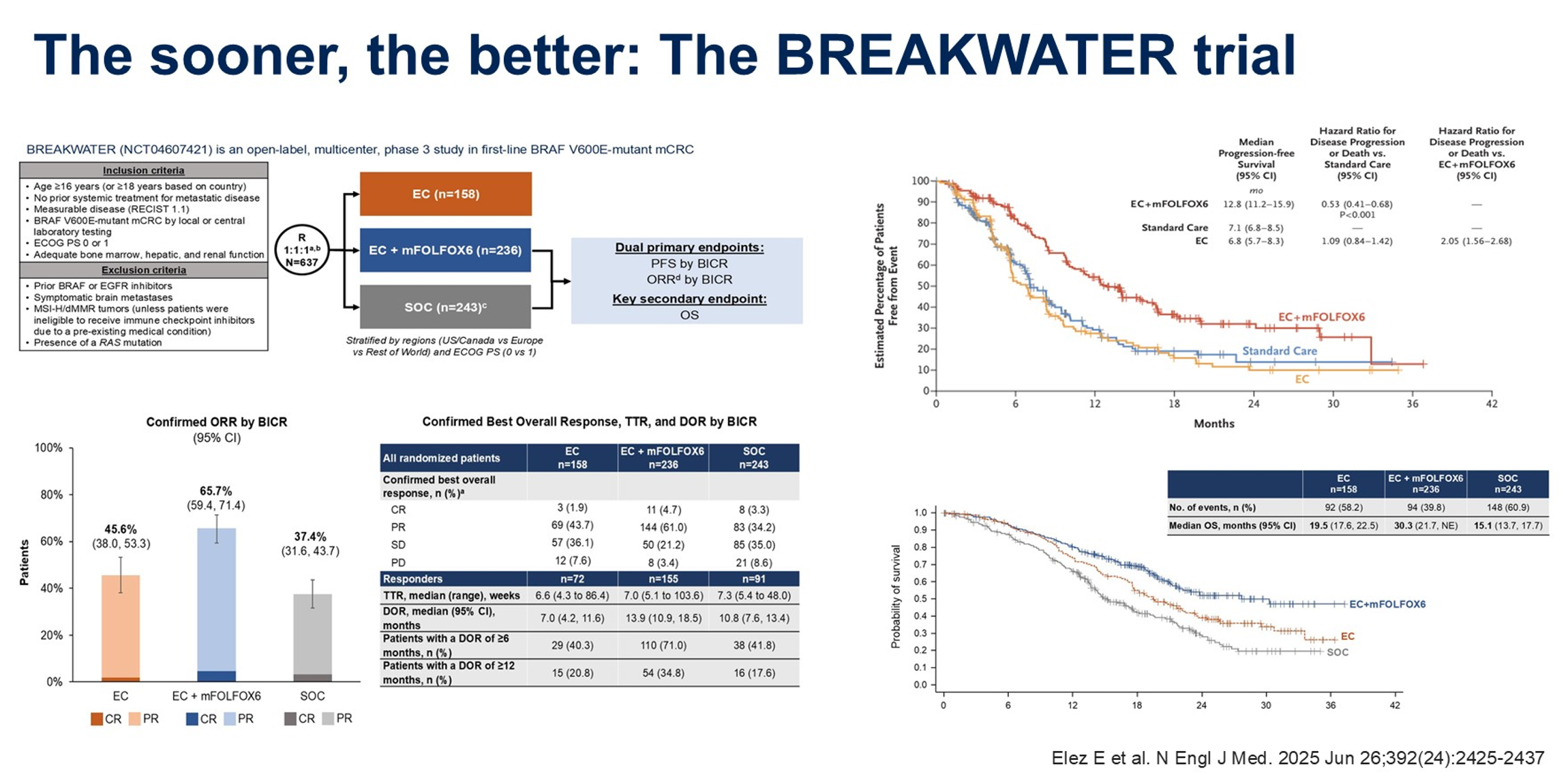
如何进一步优化疗效?策略之一是尽早启动驱动基因阻断,BREAKWATER研究正是基于这一理念设计的关键III期临床试验,旨在探索两个关键问题:化疗的加入能否进一步增强疗效,以及一线使用恩考芬尼联合西妥昔单抗能否为患者带来额外获益。研究比较了恩考芬尼联合西妥昔单抗(EC)、EC联合mFOLFOX6与标准治疗(FOLFOXIRI或FOLFOX联合贝伐珠单抗)的疗效和安全性,主要终点为BICR评估的PFS和ORR。
研究结果显示,EC联合mFOLFOX6组的mOS达到30.3个月,约为标准治疗组(15.1个月)的2倍,这一数据前所未有。PFS方面,EC联合mFOLFOX6组为12.8个月,而标准治疗组为7.1个月。ORR同样显示出EC联合mFOLFOX6方案的优势。值得注意的是,EC组因ANCHOR CRC试验最终结果的公布而提前终止入组,因此其疗效数据不能与EC联合mFOLFOX6直接比较,但EC组的mOS仍达到19.5个月,对于不能耐受化疗的患者而言可作为备选方案。在安全性方面,EC联合mFOLFOX6组患者接受的奥沙利铂剂量强度和持续时间与标准治疗组相当。基于这些结果,FOLFOX联合恩考芬尼和西妥昔单抗已被纳入NCCN指南和ESMO指南,作为BRAF V600E突变mCRC一线治疗的优选方案。
此外,BREAKWATER研究队列3探索了FOLFIRI联合恩考芬尼和西妥昔单抗的疗效和安全性。研究结果令人鼓舞(经BICR评估,确认的ORR为64.4%;mOS尚未达到;OS的HR为0.49),这对于不能耐受奥沙利铂的患者具有重要参考价值。
BREAKWATER研究的生物标志物分析显示,福尔马林固定石蜡包埋组织与液体活检之间BRAF V600E检测结果具有高度一致性。更重要的是,接受EC联合mFOLFOX6治疗的患者获得性耐药突变(如KRAS、NRAS、MAP2K1突变)的发生率更低。这可能与化疗的作用相关——由于BRAF V600E突变肿瘤是一个分子异质性群体,化疗可能有助于清除对靶向治疗不敏感的亚克隆。
恩考芬尼+西妥昔单抗(EC)联合免疫治疗探索
BRAF V600E突变mCRC从转录组学角度可分为不同亚型,其中大多数属于CMS1或CMS4亚型,这些肿瘤具有更多的免疫细胞浸润(尽管其免疫特征有所不同)。有研究发现,PD-1抑制剂联合BRAF和MEK抑制剂可在治疗仅15天后增加肿瘤内细胞毒性T细胞的浸润。
Morris教授领衔开展的一项Ib/II期研究评估了恩考芬尼、西妥昔单抗联合纳武利尤单抗的疗效,在微卫星稳定型(MSS)BRAF V600E突变mCRC患者中观察到50%的ORR和96%的疾病控制率(DCR),这一结果令人瞩目。
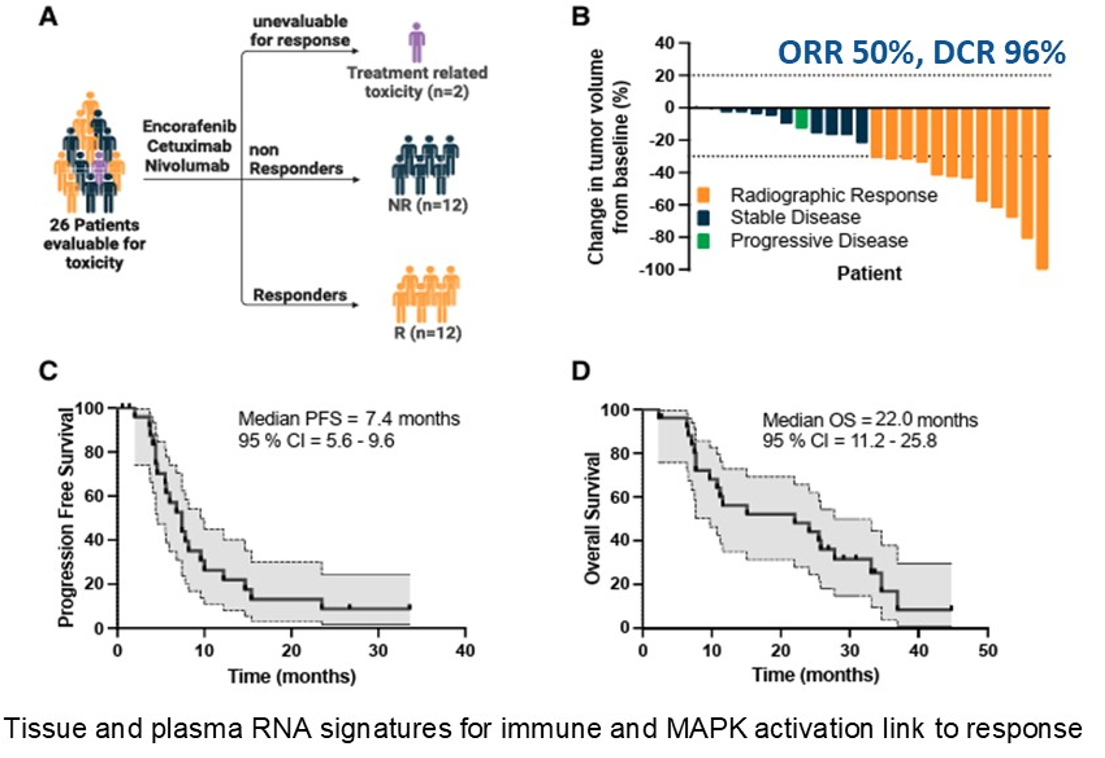
针对MSI-H/dMMR肠癌患者,目前正在开展的一项研究旨在评估恩考芬尼、西妥昔单抗联合帕博利珠单抗或帕博利珠单抗单药治疗的疗效,该研究已完成入组,结果有待公布。
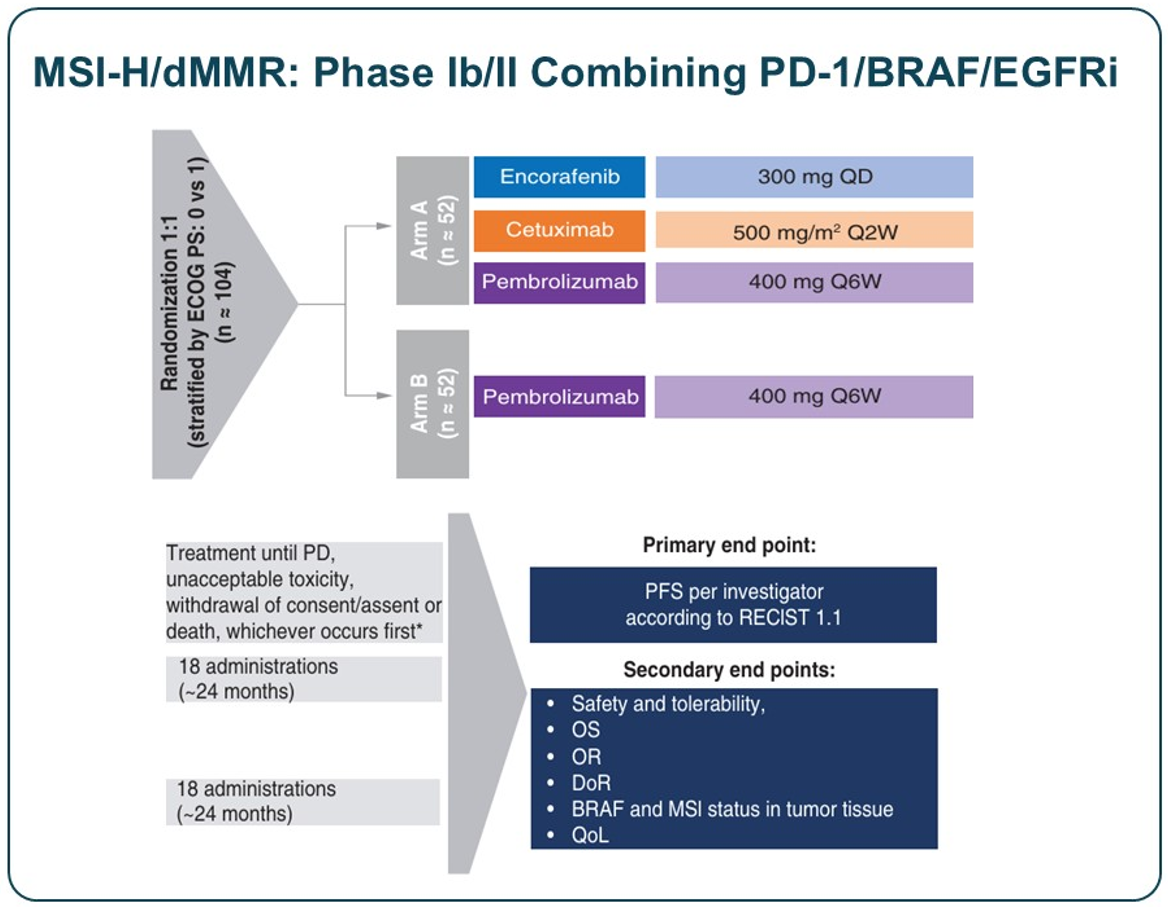
新型药物研发方向:paradox breaker与BRAF降解剂
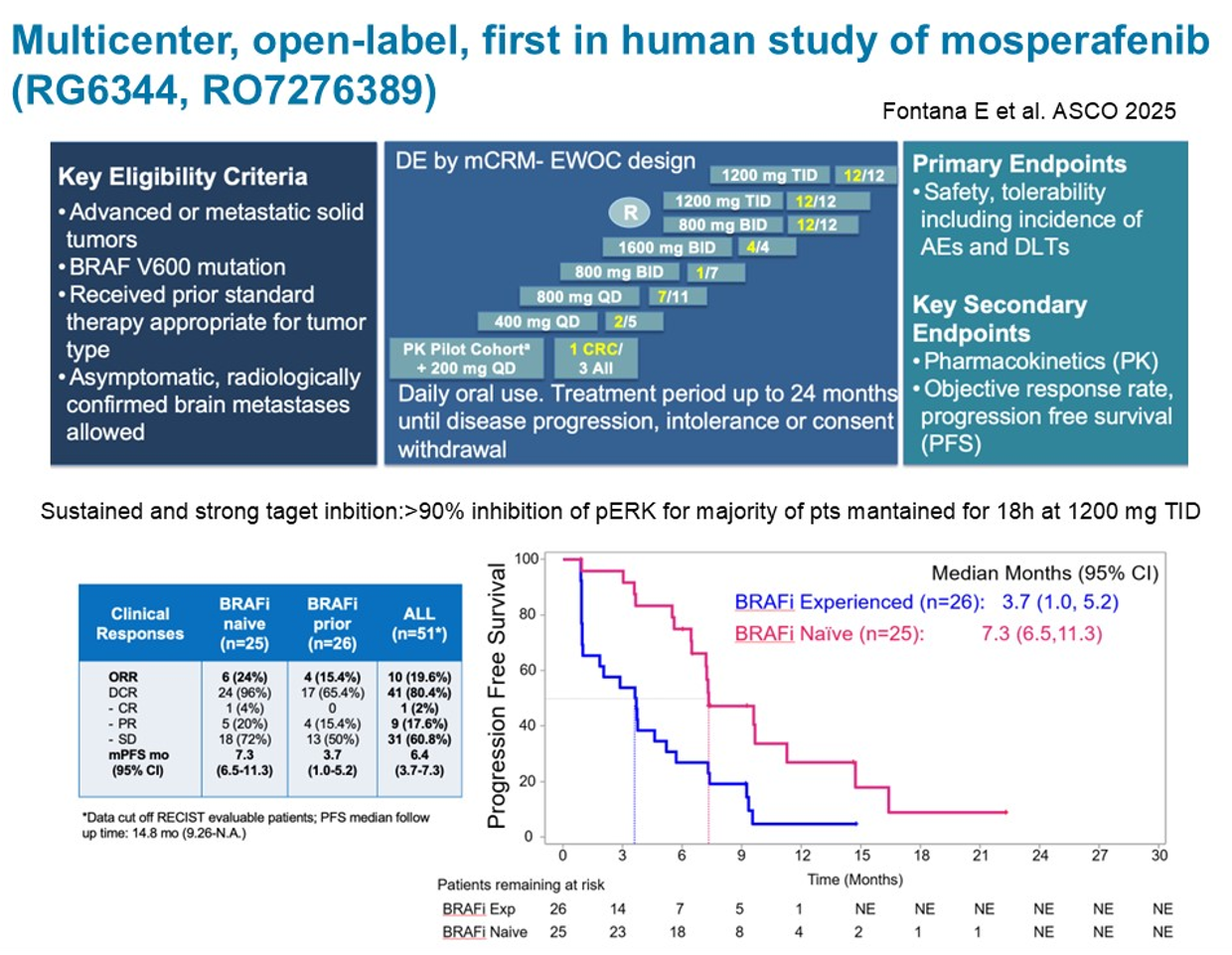
在新型药物研发领域,paradox breaker是一个值得关注的方向。第一代BRAF抑制剂的问题之一在于其会诱导悖论性BRAF二聚化,导致MAPK通路持续激活和肿瘤细胞增殖。paradox breaker通过阻止BRAF二聚化来规避这一问题。2025 ASCO年会上报告了mosperafenib(RG6344)的I期研究结果:在51例可评估患者中,ORR为19.6%,DCR达80.4%。值得注意的是,该药不仅在BRAF抑制剂初治患者中有效(ORR 24%,mPFS 7.3个月),在既往接受过BRAF抑制剂治疗的患者中同样展现出抗肿瘤活性(ORR 15.4%,mPFS 3.7个月)。药效学评估显示,在1200mg TID剂量下,大多数患者的磷酸化ERK抑制率可持续维持在90%以上达18小时。
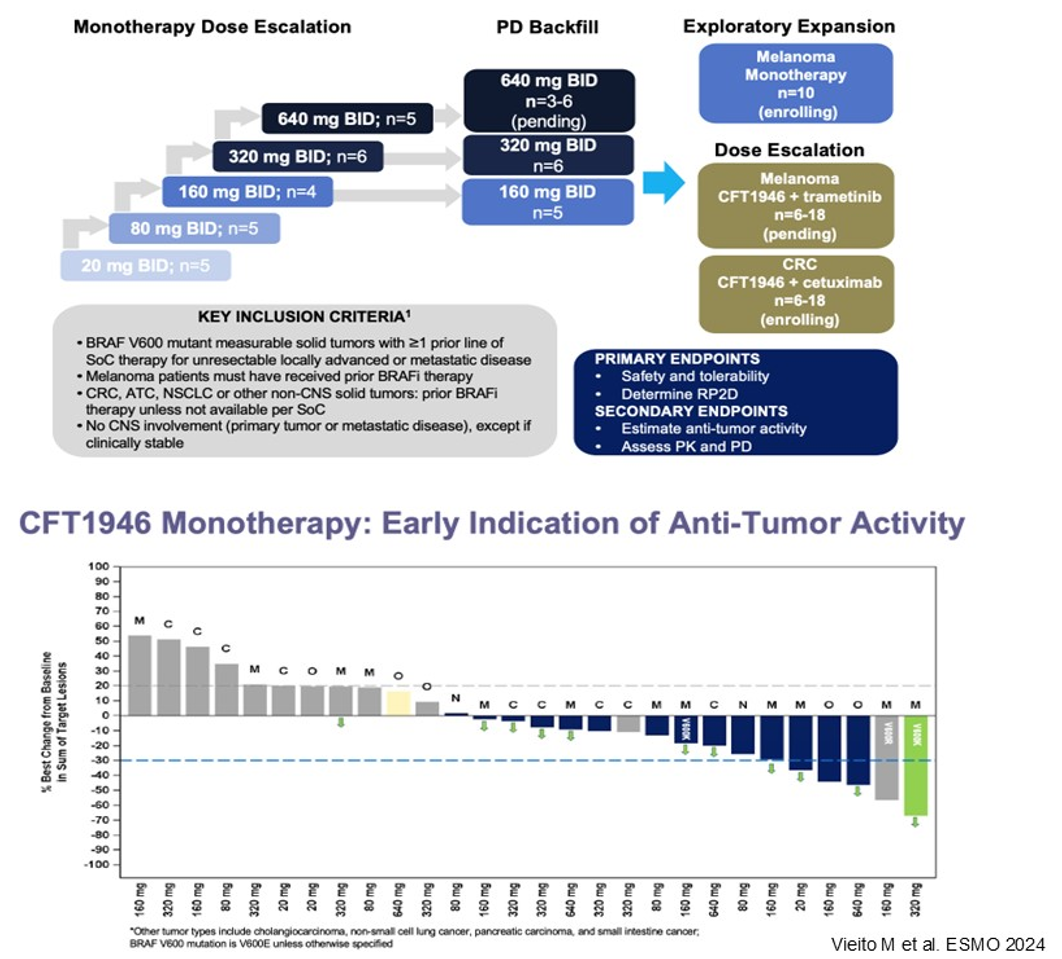
另一个研发方向是BRAF降解剂,其作用机制是直接降解BRAF蛋白,从根本上避免BRAF二聚化的问题。肿瘤活检免疫组化结果显示,经BRAF降解剂治疗15天后肿瘤组织中已检测不到BRAF蛋白。2024 ESMO年会报告了BRAF降解剂CFT1946的初步研究结果,研究纳入了多个瘤种的患者,瀑布图显示在结直肠癌患者中也观察到了抗肿瘤活性。
Elez教授在总结中指出,BRAF突变药物的研发历程充分展示了转化研究与临床研究之间的桥接如何加速了从药物和生物标志物发现到改善患者预后的转化进程。
排版编辑:肿瘤资讯-Marie











 苏公网安备32059002004080号
苏公网安备32059002004080号


