乳腺癌胃肠道转移并不常见,其中直肠受累尤为罕见。本文报告一例55岁女性双侧乳腺癌患者,在初次确诊7年后发生直肠转移。患者于2017年诊断为左乳浸润性导管癌和右乳导管原位癌。尽管接受了包括改良根治术、化疗、放疗和内分泌治疗在内的综合治疗,患者仍出现骨、淋巴结和胸膜等多处转移。2024年,患者出现新发肠道症状,结肠镜检查显示直肠壁增厚伴狭窄。活检证实为转移性乳腺癌,免疫组化示GATA3(+)、CDX2(-),且与原发肿瘤相比激素受体表达缺失。本病例提示,对于有肠道症状的乳腺癌患者,即便在初治多年后,仍需考虑胃肠道转移的可能。本文还就乳腺癌直肠转移的诊断、治疗及预后相关文献进行复习。
前言
乳腺癌是女性最常见的恶性肿瘤,其常见转移部位包括骨、肺、肝和脑。乳腺癌胃肠道转移相对罕见,发生率低于1%,其中胃是最常见的受累部位。直肠转移尤为罕见,文献报道极为有限。虽然浸润性小叶癌因其弥漫性生长模式和E-钙黏蛋白缺失,被认为具有较高的胃肠道转移倾向,但乳腺癌中更常见的亚型——浸润性导管癌同样可发生胃肠道转移。本病例提示临床医生需保持警惕,即使是浸润性导管癌患者,当出现酷似原发性结直肠肿瘤的非特异性胃肠道症状时,也应考虑直肠转移的可能。
病例介绍
基本信息
患者,女,55岁,有乳腺癌家族史(其母于2007年确诊)。2017年3月因发现左乳肿块就诊。乳腺X线摄影和超声等影像学检查显示双乳可疑病变。活检证实左乳浸润性导管癌和右乳导管原位癌。
初始治疗与病理
患者于2017年5月接受左乳改良根治术及右乳切除术联合前哨淋巴结活检。病理示左乳浸润性导管癌(非特殊类型,2级,大小3.5 cm × 2.5 cm × 2.3 cm),伴广泛淋巴结转移(腋窝淋巴结9/14阳性,前哨淋巴结2/6阳性)。
免疫组化示雌激素受体阳性(90%),Ki-67低表达(11%),HER2阴性。右乳示低级别导管原位癌,切缘阴性。
术后治疗包括剂量密集型化疗(EC方案序贯紫杉醇)、胸壁放疗及内分泌治疗(阿那曲唑联合戈舍瑞林)。通过该治疗方案,患者病情初期得到控制。
疾病进展
2019年5月,发现骨转移(表1)。尽管继续内分泌治疗,病情仍出现进展,2021年观察到胸壁和淋巴结转移。复发病灶活检示雌激素受体表达降低(30%),HER2维持阴性。治疗方案更换为依西美坦联合帕博利珠单抗及戈舍瑞林。
表1患者临床病程(2017-2024 年)
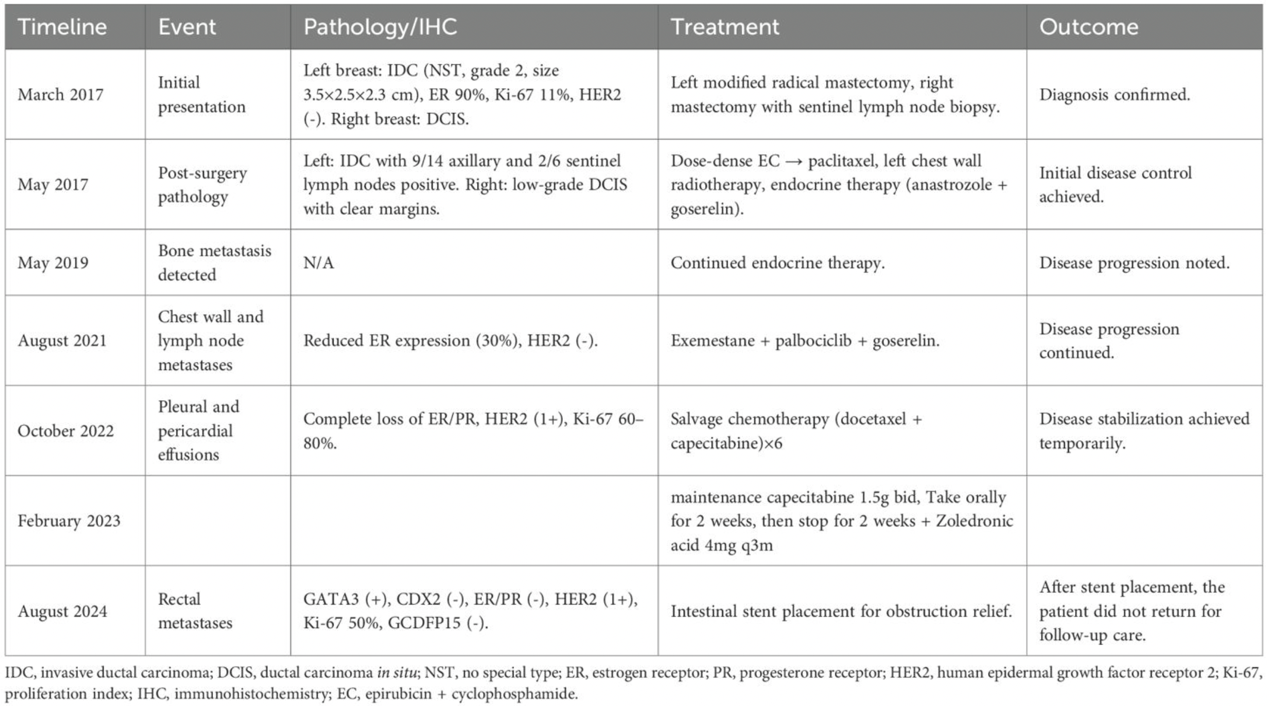
2022年至2023年间病情进一步进展,出现胸腔积液和心包积液。细胞学检查证实为转移性乳腺癌,激素受体表达完全缺失,Ki-67显著升高(60%~80%)。
鉴于疾病进展为雌激素受体阴性,于2022年10月停用内分泌治疗。患者随后接受多西他赛联合卡培他滨挽救性化疗(6个周期),并自2023年2月起接受卡培他滨维持治疗。
直肠转移
2024年8月,即初次确诊7年后,患者出现排便习惯改变及腹胀。
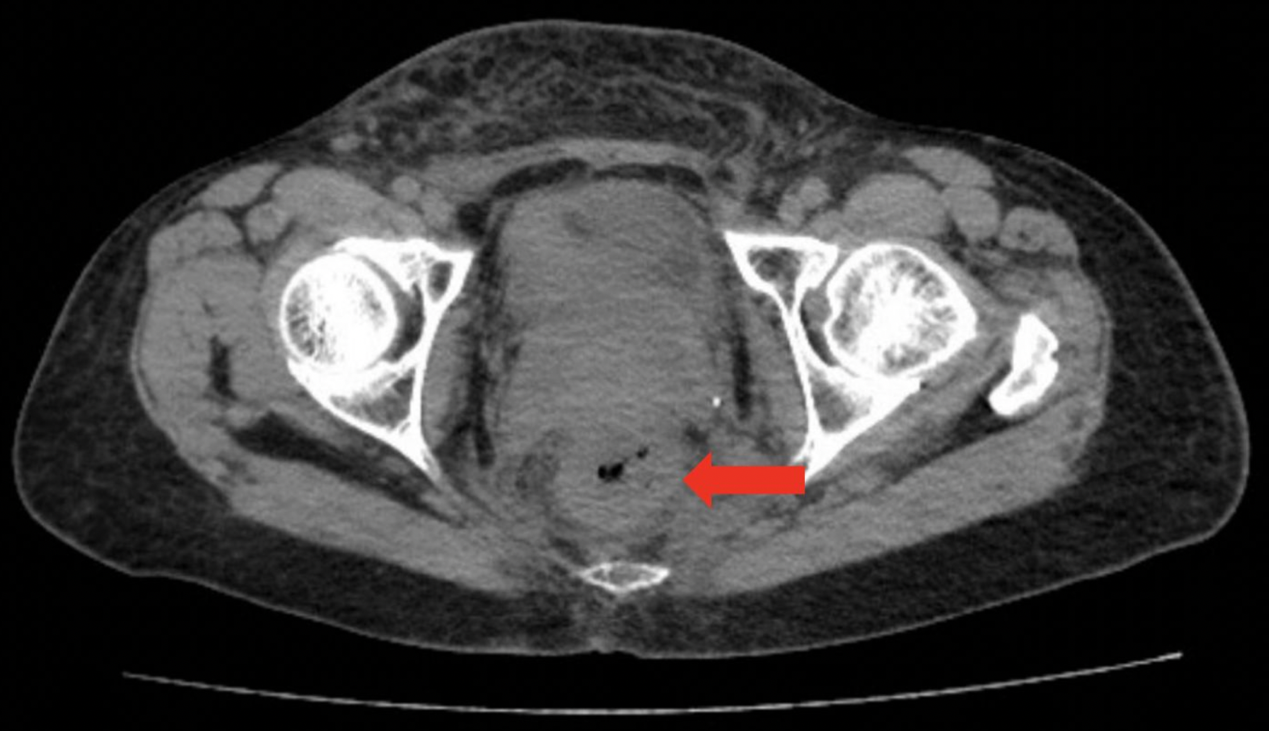
CT检查显示直肠壁增厚(图1),结肠镜检查发现距肛缘12 cm处黏膜改变伴狭窄(图2)。
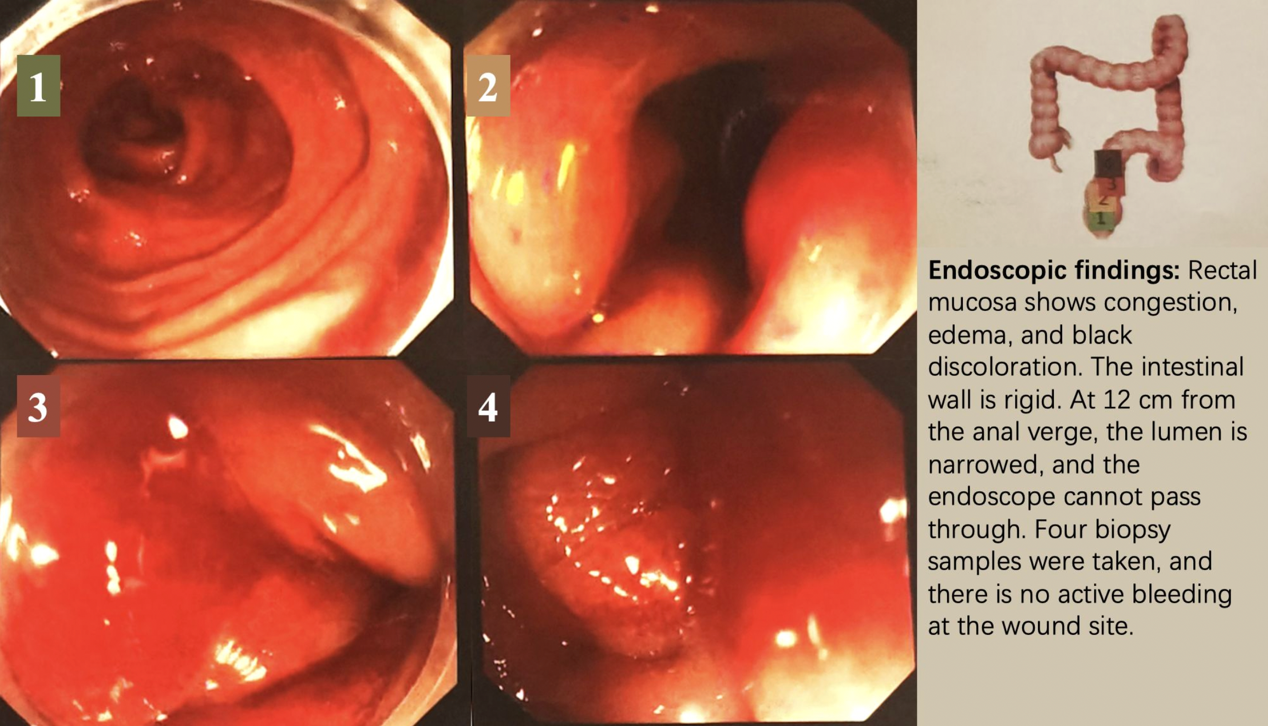
活检证实为转移性乳腺癌,免疫组化示:P53(突变型表达),CK(+),INSM1(-),Ki-67(50%);Rb(+),CD56(-),Syn(-),CgA(-),GATA3(+),CDX2(-),ER(-),PR(-),HER2(1+),GCDFP15(-),SSTR2(-)。上述结果证实直肠病灶为原发性乳腺癌转移。
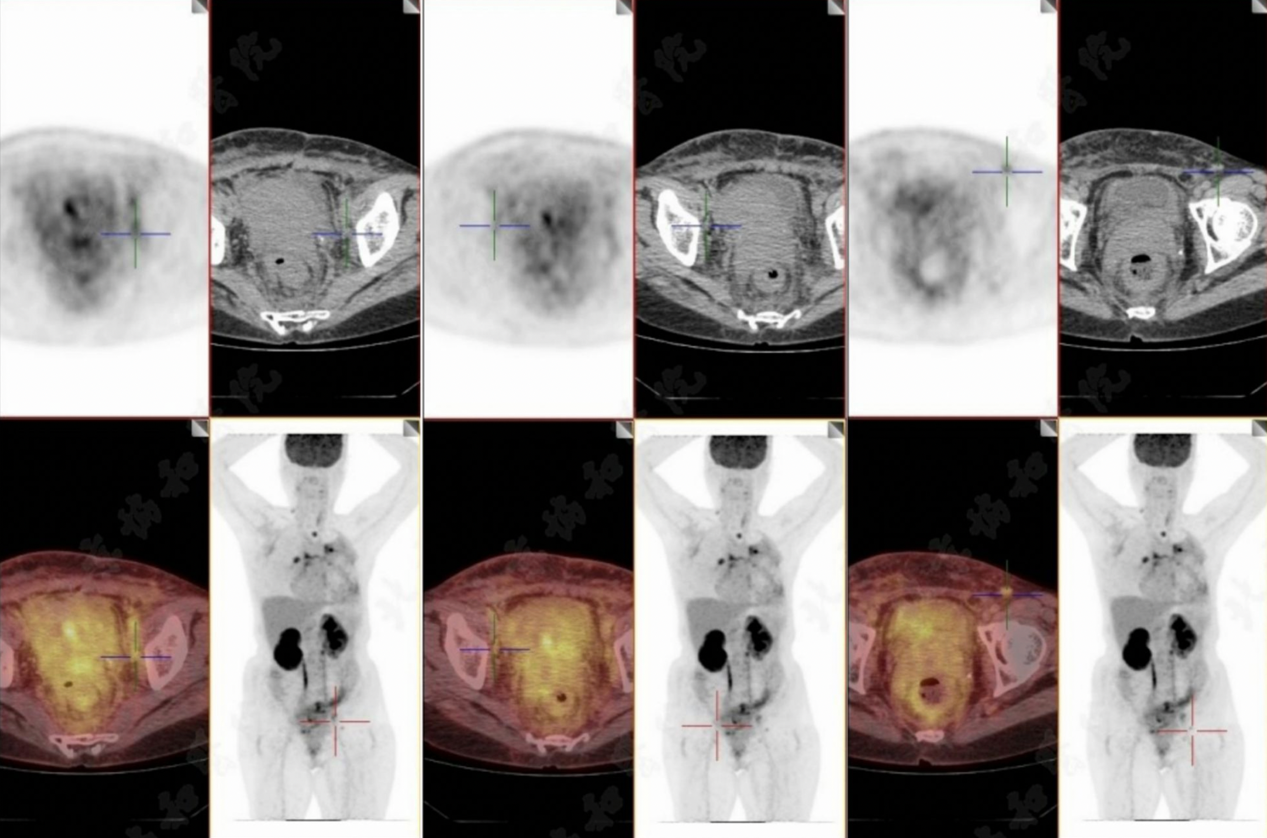
目前患者存在广泛全身转移,累及骨、淋巴结、胸膜、心包和直肠(图3)。已置入肠道支架以缓解梗阻。
2024年10月,患者心包积液加重,引流后呼吸困难略有改善,但全身状况仍较差。我院门诊建议加强姑息支持治疗。若患者全身状况改善,后续治疗方案可考虑厄洛替尼、化疗或抗体药物偶联物。患者家属已要求出院寻求姑息治疗。
病例讨论
流行病学与转移模式
乳腺癌全身转移主要累及骨、肺、肝和脑,胃肠道转移仍属罕见。近期一项综合综述显示,仅在不足5%的乳腺癌患者中检测到肠道转移。Maekawa等报道,在980例转移性乳腺癌患者队列中,仅0.5%出现胃肠道转移,直肠受累尤为罕见。其他队列研究和病例系列也报道了类似的极低发病率。上述数据表明,胃肠道转移(特别是直肠受累)极为罕见,加之临床表现缺乏特异性,极易导致漏诊。
诊断挑战与病理确认
乳腺癌胃肠道转移的临床症状——如肠梗阻、排便习惯改变或非特异性腹部不适——常与原发性胃肠道肿瘤重叠。鉴于这些诊断挑战,仅靠组织病理学可能不足以确诊。免疫组化分析对于准确诊断至关重要。在多个报道的病例中,GATA3和GCDFP-15等标志物阳性,结合CDX2或CK20等肠道标志物阴性,在确认乳腺癌来源方面发挥了关键作用。此外,由于转移性乳腺癌常发生克隆演化,将转移灶的免疫组化谱与原发肿瘤进行比对对于制定后续治疗方案至关重要。这提示临床医生需保持高度警惕,并进行全面的免疫组化评估,特别是GATA3等确认乳腺癌转移的关键标志物。值得注意的是,胃肠道转移的出现通常提示晚期全身性疾病,预后较差。
转移模式:部位、潜伏期与亚型
一项针对下消化道转移(包括结肠、直肠和小肠)的综述指出,尽管罕见,但此类病例的报道正日益增多。虽然浸润性小叶癌传统上因其弥漫性生长和E-钙黏蛋白缺失而与较高的胃肠道转移倾向相关,但本病例表明浸润性导管癌同样可转移至消化道。这一发现提示临床医生在浸润性导管癌病例中也应警惕胃肠道/直肠转移的可能。从乳腺癌初诊到出现胃肠道转移的潜伏期可长达数年,部分病例报告记录了5~10年的间隔期。
预后与治疗结果
乳腺癌胃肠道转移通常提示晚期全身性疾病,预后不良。检出胃肠道转移后的中位生存期通常有限,部分系列报道约为一年。鉴于该疾病的全身性特征,系统治疗仍是治疗基石。内镜或手术干预(如支架置入)通常用于姑息目的,特别是在发生梗阻、出血或严重症状的情况下。尽管大多数数据源自回顾性病例系列和报告,但这些发现强调了根据受体状态、患者体能状态、症状及既往治疗制定个体化治疗方案的重要性。
耐药机制与治疗考量
在激素受体阳性转移性乳腺癌中,对内分泌治疗的获得性耐药常由ESR1突变驱动。ESR1突变被认为是转移性疾病(尤其是激素受体阳性/HER2阴性乳腺癌)的主要耐药机制。CDK4/6抑制剂的引入显著改善了该亚型的标准治疗;然而,耐药性终将产生。关于CDK4/6抑制剂耐药的研究已确定多种分子改变,包括细胞周期调节因子失调(如RB1缺失、Cyclin E–CDK2轴激活)、替代性有丝分裂通路再激活(如PI3K/AKT/mTOR)以及可能的表观遗传重编程。这些改变促使肿瘤克隆向不依赖雌激素、更具侵袭性的方向演变。
在本例患者中,从雌激素受体阳性浸润性导管癌演变为雌激素受体阴性转移性疾病的过程,可能筛选出了具有更强侵袭能力、生存优势以及定植于直肠等罕见部位能力的亚克隆。虽然目前缺乏将这些分子改变与直肠亲和性直接关联的证据,但受体缺失、细胞周期失调和治疗耐药的综合作用为观察到的转移模式提供了合理的生物学解释。一旦激素受体表达缺失,内分泌治疗即告无效,系统化疗成为主要治疗选择。此外,随着对耐药机制理解的深入,靶向通路下游分子(如PI3K/mTOR抑制剂)的新型治疗策略可能为未来病例提供新的治疗途径。在转移灶导致消化道梗阻的情况下,局部姑息干预(如支架置入)对于缓解症状和维持生活质量至关重要。涉及肿瘤内科、消化内科和外科的多学科协作模式对于管理此类复杂的转移性疾病不可或缺。
本病例提示,在乳腺癌患者出现胃肠道症状时,即使在初诊多年后,也需将直肠转移纳入鉴别诊断。全面病理评估和免疫组化分析对于确诊转移性乳腺癌至关重要。鉴于肿瘤进展过程中潜在的分子机制,在整个治疗过程中重新评估肿瘤生物学特征对于指导后续治疗策略具有重要意义。
Xiaohong Lyu,Feng Mao.Rectal metastasis in a patient with long-term breast cancer: a rare case report with literature review. Front Oncol. 2026 Jan 21:16:1597103. doi: 10.3389/fonc.2026.1597103. eCollection 2026.
排版编辑:肿瘤资讯-slb











 苏公网安备32059002004080号
苏公网安备32059002004080号


