近年来,CAR-T/NK细胞疗法凭借精准靶向、强效杀伤的优势,在癌症治疗领域掀起革命。其中,CAR-T疗法已在血液系统恶性肿瘤治疗中取得突破性成果,但在实体瘤治疗中仍面临肿瘤异质性、免疫抑制微环境等难题。同时,传统CAR-T疗法常伴随细胞因子释放综合征(CRS)、免疫效应细胞相关神经毒性综合征(ICANS)等严重不良反应,限制了其广泛应用。
在此背景下,寻找更理想的肿瘤靶点成为突破关键。CD70(分化簇70,又称肿瘤坏死因子配体超家族成员7,TNFSF7)作为一种Ⅱ型跨膜蛋白,在生理状态下仅少量表达于活化的淋巴细胞与终末分化的树突状细胞,参与免疫调控;而在病理状态下,CD70在多种血液肿瘤和实体瘤表面高度表达,且正常组织中表达极少,这使其成为CAR-T/NK疗法的理想靶点。
近期,发表于Translational Oncology杂志的一篇综述文章,聚焦CD70靶向CAR-T/NK 细胞疗法,系统梳理了该疗法的作用机制、研究进展及未来方向。来自华中科技大学同济医学院附属同济医院血液科的研究团队,通过整合大量临床前研究与临床试验数据,证实CD70作为肿瘤治疗靶点的巨大潜力,为多种难治性癌症的治疗开辟了新路径。

CAR-T与CAR-NK疗法的机制差异与互补优势
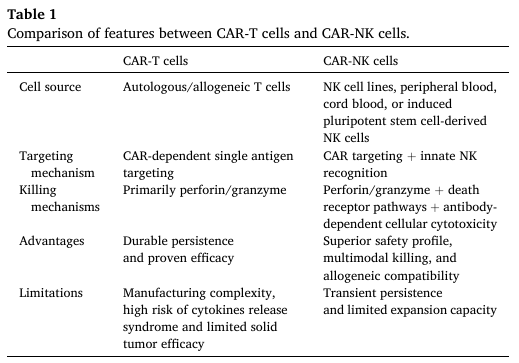
CAR-T细胞通过基因工程改造患者或供者的T细胞,使其表达能特异性识别肿瘤抗原的嵌合抗原受体(CAR),无需主要组织相容性复合体(MHC)介导即可精准杀伤肿瘤细胞。而CAR-NK细胞则以NK细胞为基础,结合了CAR的靶向性与NK细胞的天然细胞毒性,具有多途径杀伤肿瘤的特点——除通过CAR识别抗原外,还可通过释放穿孔素/颗粒酶、激活死亡受体通路、介导抗体依赖性细胞毒性(ADCC)等方式清除肿瘤细胞。
两种疗法各有优势:CAR-T细胞在血液瘤中具有持久的抗肿瘤活性,临床疗效已获广泛验证;CAR-NK细胞则安全性更高,不易引发CRS与ICANS,且可采用异基因来源(如NK细胞系、脐带血、诱导多能干细胞),无需依赖患者自体细胞,制备周期更短,适用人群更广。该综述通过对比分析指出,CD70靶向CAR-T/NK疗法可结合二者优势,针对不同癌症类型制定个性化治疗方案。
表1. CAR-T细胞和CAR-NK细胞的特征比较
血液系统恶性肿瘤:从临床前探索到临床试验突破
急性髓系白血病(AML)
AML是一种髓系造血干细胞恶性克隆疾病,CD70在AML原始细胞表面异质性表达,但在正常造血干细胞中几乎不表达。临床前研究显示,CD70靶向CAR-T细胞可在体外有效杀伤CD70阳性AML细胞系及原代细胞,并在异基因移植模型中降低肿瘤负荷、延长小鼠生存期。为解决CD70表达异质性问题,研究人员采用表观遗传调控剂(如阿扎胞苷、地西他滨),通过抑制DNA甲基转移酶降低CD70启动子甲基化水平,显著提升AML细胞表面CD70表达量,增强CAR-T细胞的杀伤效果。此外,CD70/CLL-1双靶点CAR-T细胞(CLL-1.BiCAR)可有效避免抗原阴性逃逸,在AML模型中较单靶点CAR-T 细胞延长小鼠中位生存期约40%,目前该疗法已进入Ⅰ/Ⅱ期临床试验(NCT04662294)。
非霍奇金淋巴瘤(NHL)
CD70在58%的NHL患者肿瘤细胞中表达,包括外周T细胞淋巴瘤(PTCL)、弥漫大B细胞淋巴瘤(DLBCL)、套细胞淋巴瘤(MCL)等亚型。针对B细胞淋巴瘤,CD70靶向CAR-T细胞在低效应靶比下对CD19/CD70双阳性Raji细胞的杀伤效果优于CD19 CAR-T细胞,且对CD19阴性Raji细胞仍保持细胞毒性,为CD19耐药的B-NHL患者提供了新选择。在原发性中枢神经系统DLBCL(PCNS-DLBCL)治疗中,一例早期临床研究显示,患者在序贯输注CD19 CAR-T与CD70 CAR-T细胞后1个月实现完全放射学缓解,10个月后仍可检测到两种CAR-T细胞,无病生存期超过17个月。
针对T细胞淋巴瘤,异基因CD70 CAR-T细胞CTX130在Ⅰ期临床试验(NCT04502446)中表现优异。该试验纳入39例复发/难治性T细胞淋巴瘤患者,中位随访7.4个月,67%的患者出现1-2级 CRS,仅10%出现1-2级神经毒性,客观缓解率(ORR)达46.2%,其中接受3级及以上剂量治疗的患者ORR高达51.6%,完全缓解(CR)率为19.4%,证实了CTX130的安全性与有效性。
多发性骨髓瘤(MM)
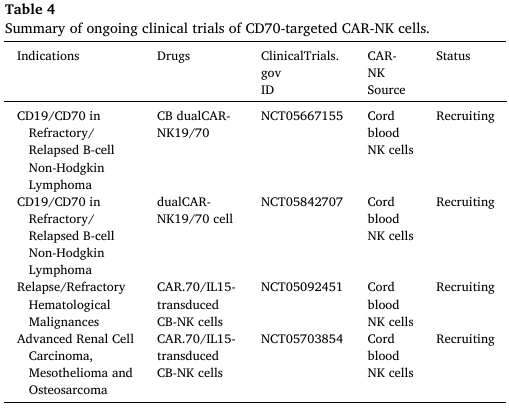
MM是一种浆细胞恶性肿瘤,目前获批的CAR-T疗法均靶向BCMA,但约41.9%的MM患者肿瘤细胞表面表达CD70,且高危MM患者中CD70表达显著上调。临床前研究表明,CD70靶向CAR-NK细胞在体外对MM细胞的杀伤效果优于未修饰NK细胞,即使在BCMA基因敲除的MM细胞模型中仍能有效清除肿瘤细胞。在异基因移植模型中,CD70 CAR-NK细胞较未修饰NK细胞展现出更强的肿瘤控制能力。目前,CD70靶向CAR-NK疗法治疗复发/难治性MM的Ⅰ/Ⅱ期临床试验(NCT05092451)正在开展,旨在评估其安全性与初步疗效。
实体瘤:打破治疗壁垒,多策略提升疗效
实体瘤因肿瘤异质性高、免疫抑制微环境复杂、CAR-T/NK细胞浸润困难等问题,一直是细胞疗法的难点。而CD70在多种实体瘤表面的高表达,为解决这一难题提供了突破口。
肾细胞癌(RCC)
透明细胞肾细胞癌(ccRCC)是RCC最常见的病理类型,CD70在原发及转移性ccRCC中均高度表达。临床前研究显示,基于纳米抗体的CD70靶向CAR-T细胞在与ccRCC细胞共培养时,可分泌更高水平的IL-2、IFN-γ、TNF-α等细胞因子,并在异基因移植模型中实现肿瘤完全清除。异基因CD70 CAR-T细胞CTX130在Ⅰ期临床试验(COBALT-RCC)中,16例不可切除或转移性ccRCC患者接受治疗后,12例实现疾病稳定,1例达到完全缓解,中位无进展生存期为2.6个月,中位总生存期达20.5个月,其中1例患者完全缓解持续3年。
另一款CD70靶向CAR-T细胞ALLO-316通过基因编辑敲除T细胞受体α亚基恒定区(TRAC),显著降低移植物抗宿主病(GVHD)风险。在Ⅰ期临床试验(NCT04696731)中,18例晚期/转移性ccRCC患者接受治疗,ORR为12%,疾病控制率(DCR)达71%,其中CD70阳性患者ORR提升至22%,DCR为100%,证实了其在CD70阳性ccRCC治疗中的潜力。
胶质瘤
胶质瘤尤其是胶质母细胞瘤(GBM)恶性程度高、预后差,CD70在原发及复发性胶质瘤表面高表达(复发GBM中CD70阳性率达69%),且正常神经胶质细胞与神经干细胞中不表达CD70。临床前研究显示,人源与鼠源CD70 CAR-T细胞均可特异性识别CD70阳性胶质瘤细胞,在异种移植模型与同基因模型中均能有效抑制肿瘤生长、改善预后,且无明显毒性。研究人员还探索了溶瘤病毒(OVs)与CD70 CAR-T细胞的联合治疗:溶瘤单纯疱疹病毒1型(oHSV-1)感染GBM细胞后释放的IFN-γ,可增强CD70 CAR-T细胞的杀伤活性,并调节肿瘤微环境,促进免疫细胞浸润,为GBM治疗提供了新策略。
其他实体瘤
在头颈部鳞状细胞癌(HNSCC)中,69%的患者肿瘤细胞表达CD70,且与肿瘤分化程度密切相关。CD70靶向CAR-T细胞在体外可有效杀伤HNSCC细胞系,而放疗可增强CD70阳性HNSCC细胞对CAR-NK细胞的敏感性,二者联合治疗有望进一步提升疗效。在非小细胞肺癌(NSCLC)中,CD70在16.3%的患者肿瘤细胞中表达,且在EGFR突变、酪氨酸激酶抑制剂(TKIs)耐药的NSCLC患者中CD70表达显著升高。临床前研究证实,CD70靶向CAR-T/NK细胞可有效杀伤TKIs耐药NSCLC细胞,目前该疗法的Ⅰ期临床试验(NCT05518253)正在开展。此外,在结直肠癌(CRC)、胰腺癌(PDAC)、骨肉瘤等实体瘤中,CD70靶向CAR-NK细胞(尤其是IL-15修饰的CD70.CAR.IL-15 NK细胞)可通过清除CD70阳性肿瘤细胞及癌症相关成纤维细胞(CAFs),延缓肿瘤生长,展现出广泛的应用前景。
挑战与创新:突破瓶颈,推动疗法优化
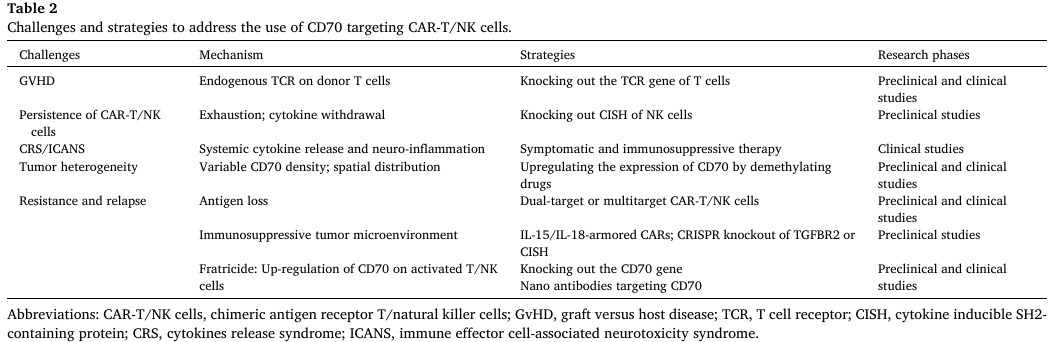
尽管CD70靶向CAR-T/NK疗法取得显著进展,仍面临诸多挑战。该综述指出,当前主要问题包括:CAR-T/NK细胞的自相残杀(活化的T/NK细胞会上调CD70表达,被同类CAR细胞识别并杀伤)、GVHD风险(异基因CAR-T细胞可能攻击宿主正常组织)、细胞持久性不足(实体瘤微环境导致CAR细胞耗竭)、肿瘤异质性与抗原逃逸(CD70表达不均或丢失导致治疗失败),以及CRS/ICANS等不良反应。
针对这些问题,研究人员已开发多种创新策略:通过CRISPR/Cas9技术敲除T/NK细胞中的CD70基因,或采用纳米抗体构建低亲和力CAR,可有效避免自相残杀;敲除TRAC基因可降低异基因CAR-T细胞的GVHD风险;编辑细胞因子诱导SH2蛋白(CISH)基因、表达膜结合IL-15/IL-15Ra融合蛋白,可增强CAR-NK细胞的体外扩增能力与体内持久性;设计CD70/CD19、CD70/B7-H3等双靶点或多靶点CAR,可应对抗原逃逸;联合表观遗传调控剂(如阿扎胞苷)提升CD70表达,或联合溶瘤病毒、PARP抑制剂调节肿瘤微环境,可进一步增强疗效。
表2. 使用靶向CD70的CAR-T/NK细胞的挑战和策略
结论与展望
该综述通过系统分析CD70靶向CAR-T/NK疗法的机制、研究进展与挑战,指出CD70作为肿瘤治疗靶点的独特优势——在多种癌症中高表达且正常组织中低表达,为血液瘤与实体瘤的精准治疗提供了可能。目前,多款CD70靶向CAR-T/NK疗法已进入临床试验阶段,在复发/难治性血液瘤与晚期实体瘤中展现出良好的安全性与有效性,尤其在CD19耐药B-NHL、T细胞淋巴瘤、ccRCC等难治性肿瘤中,有望填补治疗空白。
表3. 正在进行的CD70靶向CAR-T细胞临床试验总结
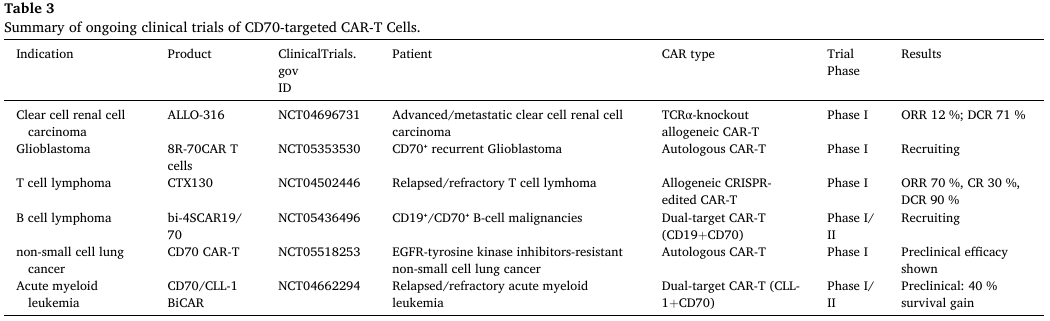
表4. 正在进行的CD70靶向CAR-NK细胞临床试验总结
未来,随着基因编辑技术的进步、双靶点/多靶点CAR设计的优化、联合治疗策略的完善,以及生物标志物指导下的患者分层,CD70靶向CAR-T/NK疗法将进一步提升疗效、降低毒性,推动癌症治疗从“广谱治疗”向“精准治疗”转变。研究团队表示,期待通过更多高质量临床试验,验证该疗法在不同癌症类型中的长期疗效与安全性,最终使CD70靶向CAR-T/NK疗法成为癌症治疗的标准方案之一,为更多患者带来生存希望。
Yan S, Zhu X, **ao Y. CD70-targeted CAR-T/NK therapy: Rationale, advances, and future directions[J]. Translational Oncology, 2025, 62: 102555.
排版编辑:Mathilda











 苏公网安备32059002004080号
苏公网安备32059002004080号


