本病例报告详细阐述了一例胸腺神经内分泌肿瘤伴有多发转移的患者长达5年的多线治疗与管理过程。该患者以骨转移为首发表现,在漫长的治疗周期中,患者先后接受了长效奥曲肽、靶向药物(索凡替尼、依维莫司)、化疗(替莫唑胺、FOLFOX)以及局部减瘤手术等多种治疗手段。本报告旨在分享当患者合并多种基础疾病并出现药物不良反应时,如何进行个体化的治疗决策,努力延长患者生存期并维持其生活质量。
患者基本情况
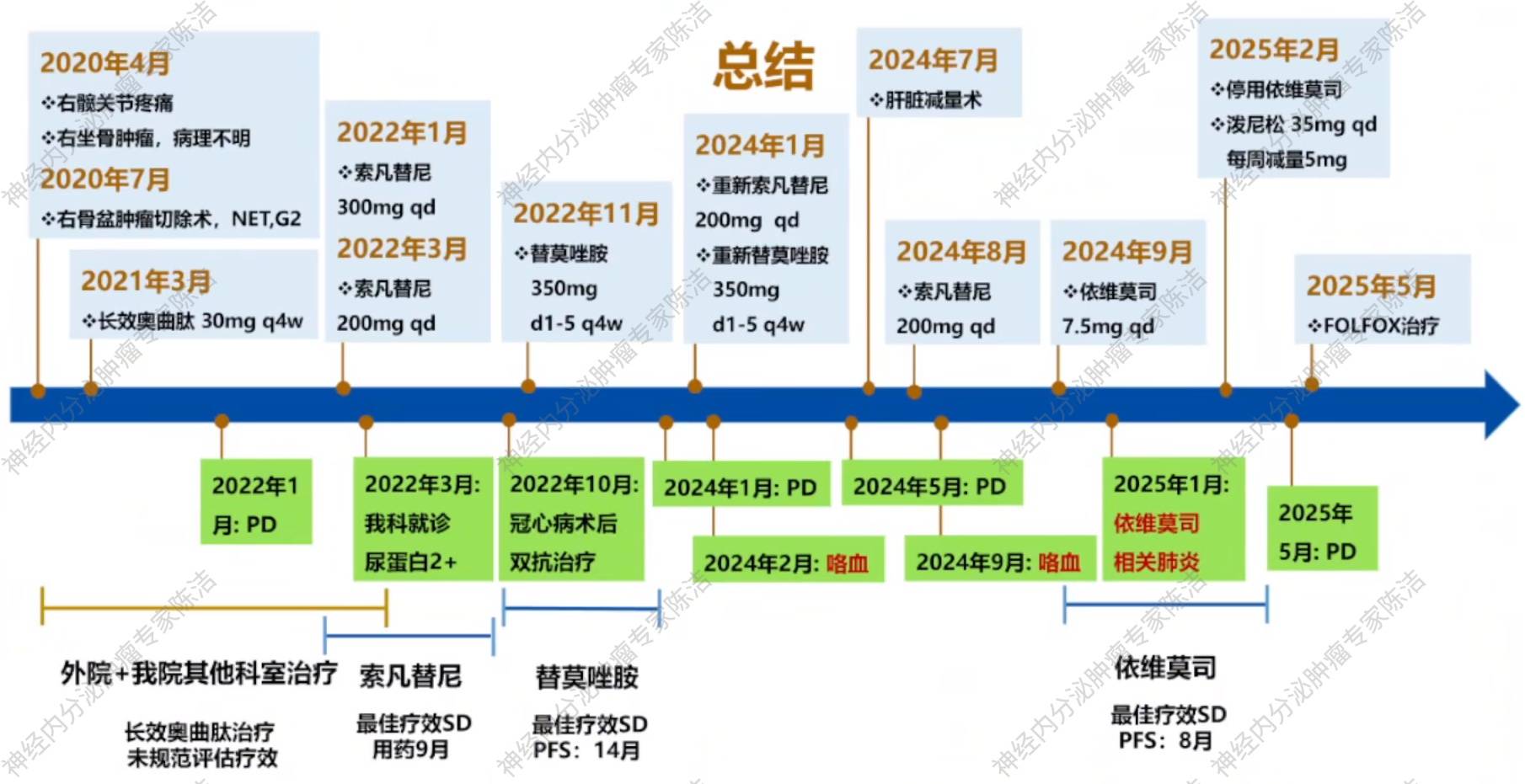
患者为一名61岁男性,2020年4月因“右髋关节扭伤后持续疼痛4个月”在外院就诊,MRI检查提示右侧坐骨恶性肿瘤。予右坐骨病灶穿刺活检,病理提示肿瘤未见核分裂象,肿瘤细胞弥漫表达上皮标记,建议首先排除转移癌。CT检查提示右侧坐骨及T9横突溶骨性破坏,考虑转移癌。
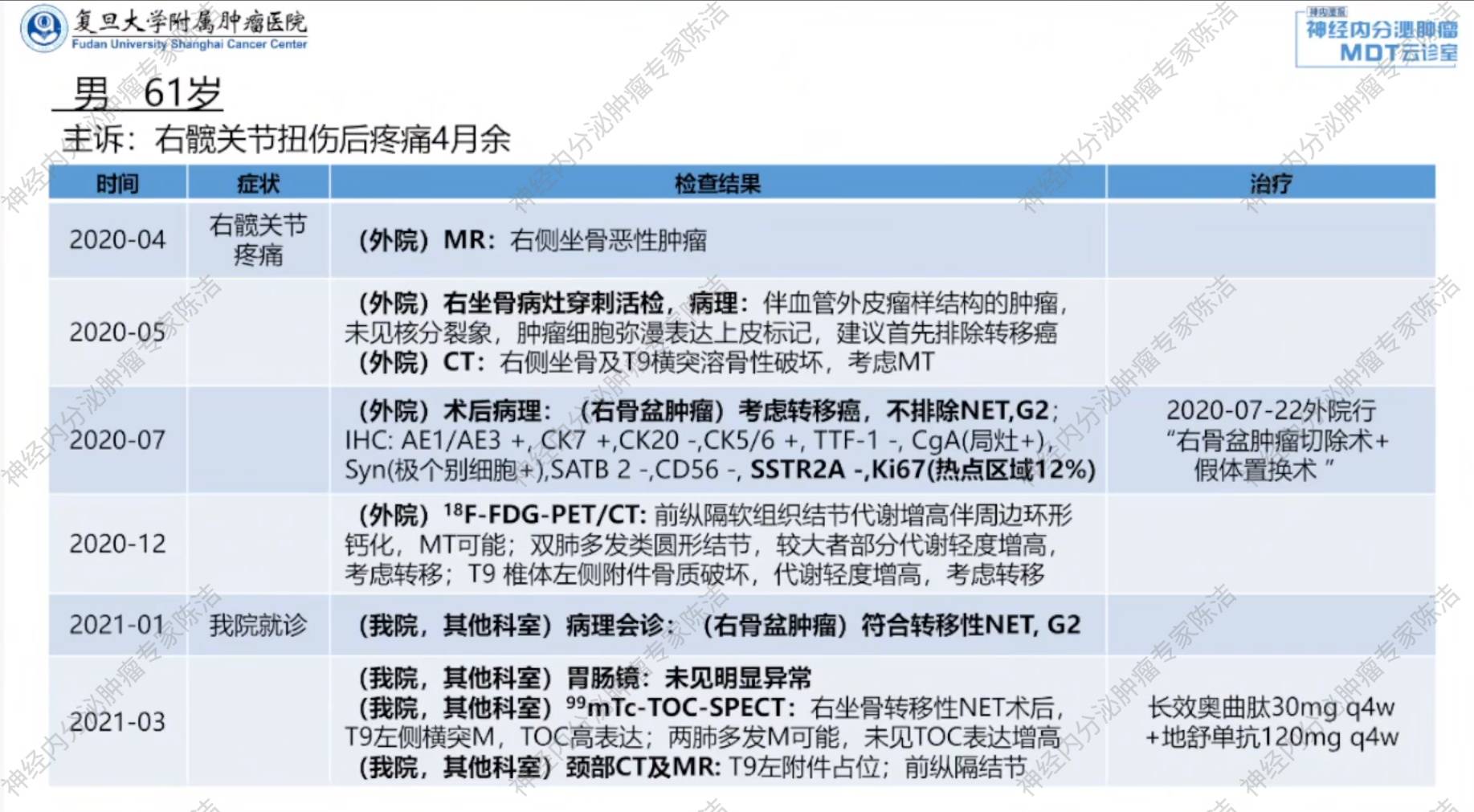
2020年7月,患者在外院行“右骨盆肿瘤切除术+假体置换术”。术后病理考虑为转移癌,形态上考虑转移性神经内分泌瘤(G2)可能。免疫组化提示AE1/AE3+,CgA(局灶+),SYN(极个别细胞+),SSTR2A(-),Ki67(12%+)。

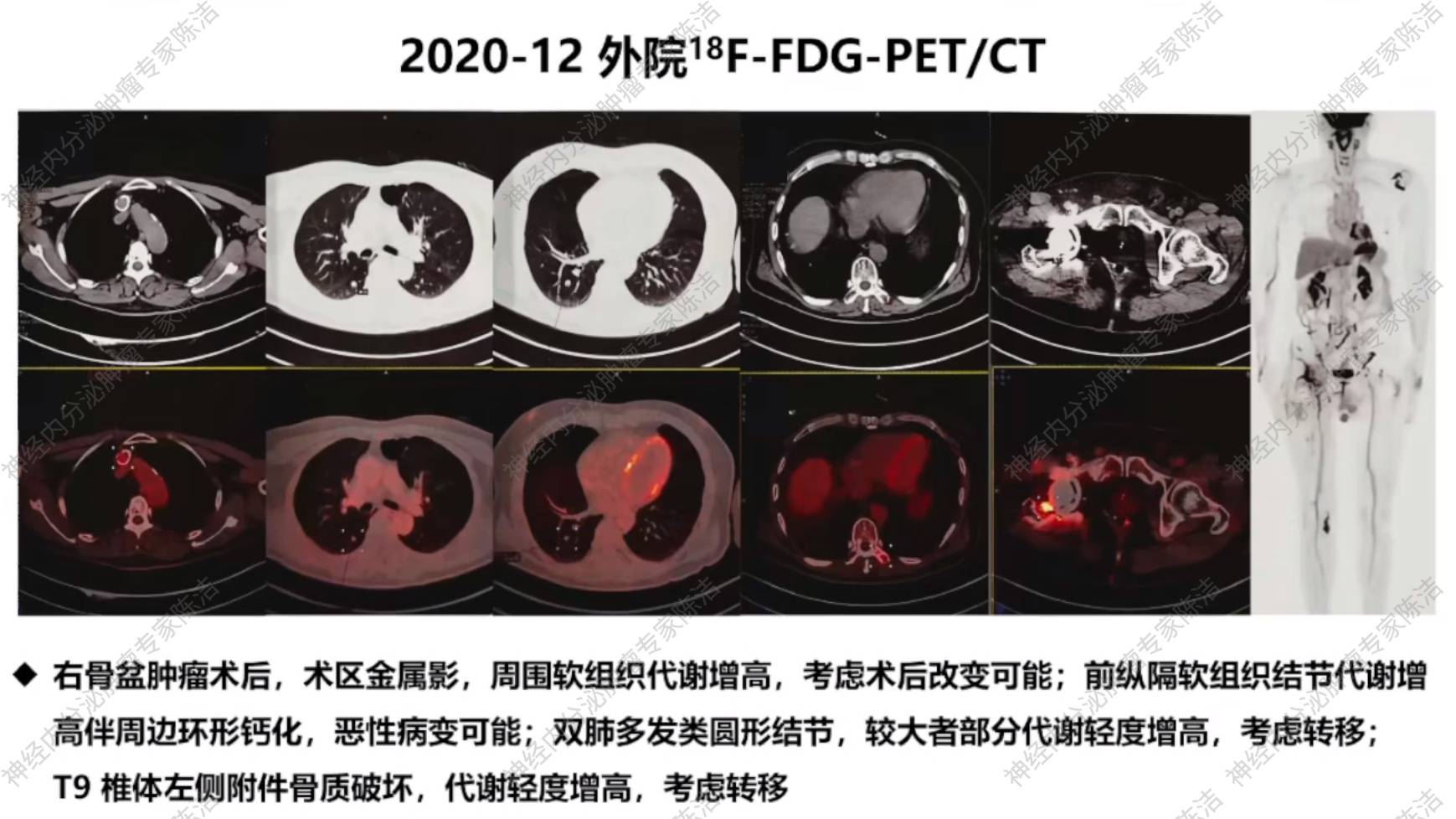
患者于2020年12月在外院行18F-FDG-PET/CT检查,结果显示:前纵隔软组织结节代谢增高伴周边环形钙化,考虑恶性病变;双肺多发圆形结节及T9椎体左侧附件骨质破坏,均伴有代谢轻度增高,考虑为转移灶。
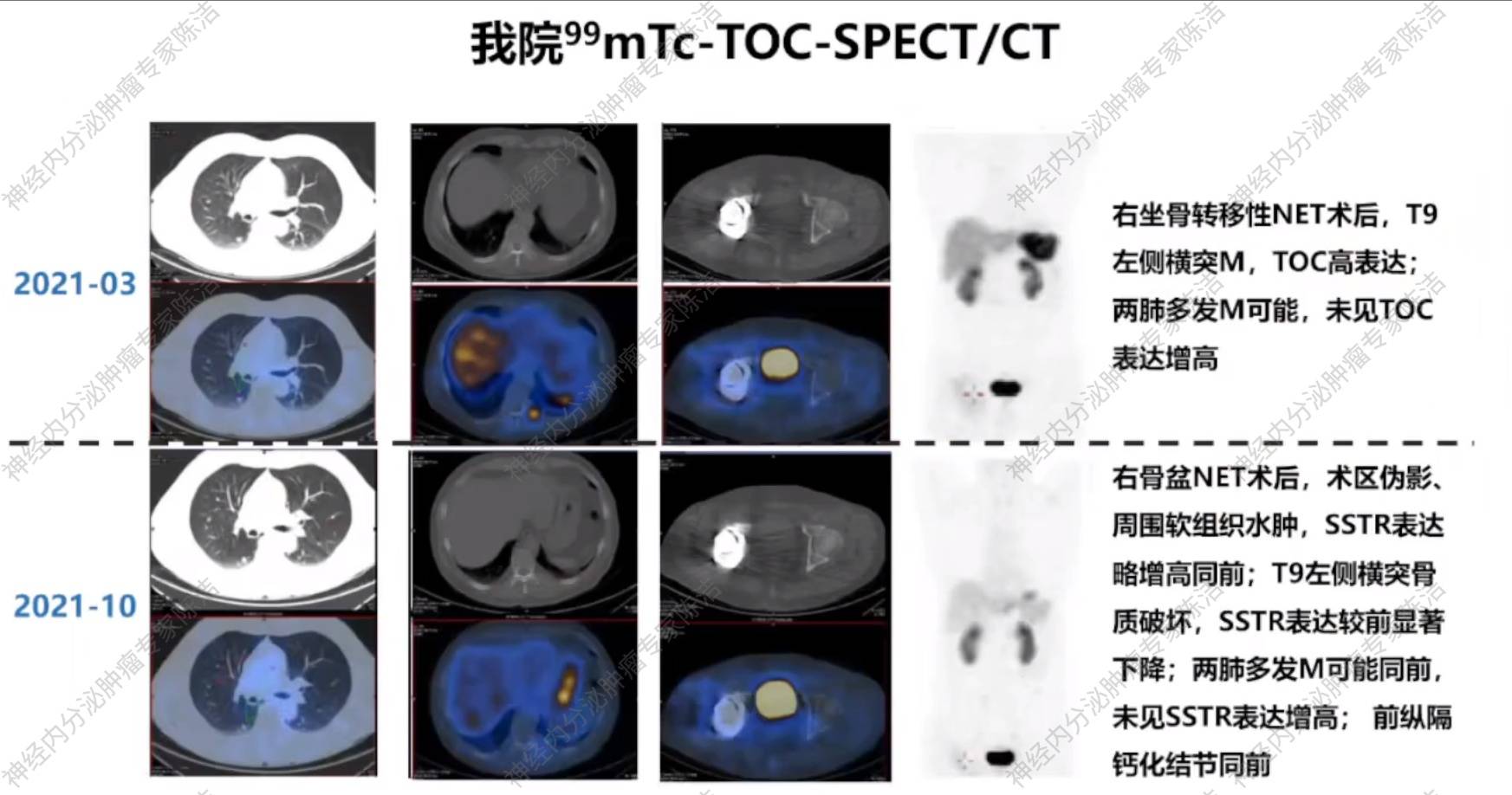
2021年1月,我院病理会诊提示右骨盆肿瘤符合转移性NET G2。为评估生长抑素受体(SSTR)表达情况,患者于2021年3月接受99mTc-TOC SPECT扫描,结果显示T9左侧横突病灶为TOC高表达,而双肺转移灶未见TOC表达增高。
治疗方案
长效奥曲肽为基础的联合治疗
患者初始予以长效奥曲肽(30mg q4w)+地舒单抗(120mg q4w)治疗。
2021年10月再次行99mTc-TOC SPECT扫描,结果提示T9左侧横突骨质破坏SSTR表达较前显著下降;其余病灶较前未见明显变化。遂继续使用该方案进行治疗。

2022年1月,颈椎+骨盆增强MRI及胸部增强CT检查提示T9病灶及双肺病灶增大,疾病进展(PD)。
索凡替尼靶向治疗
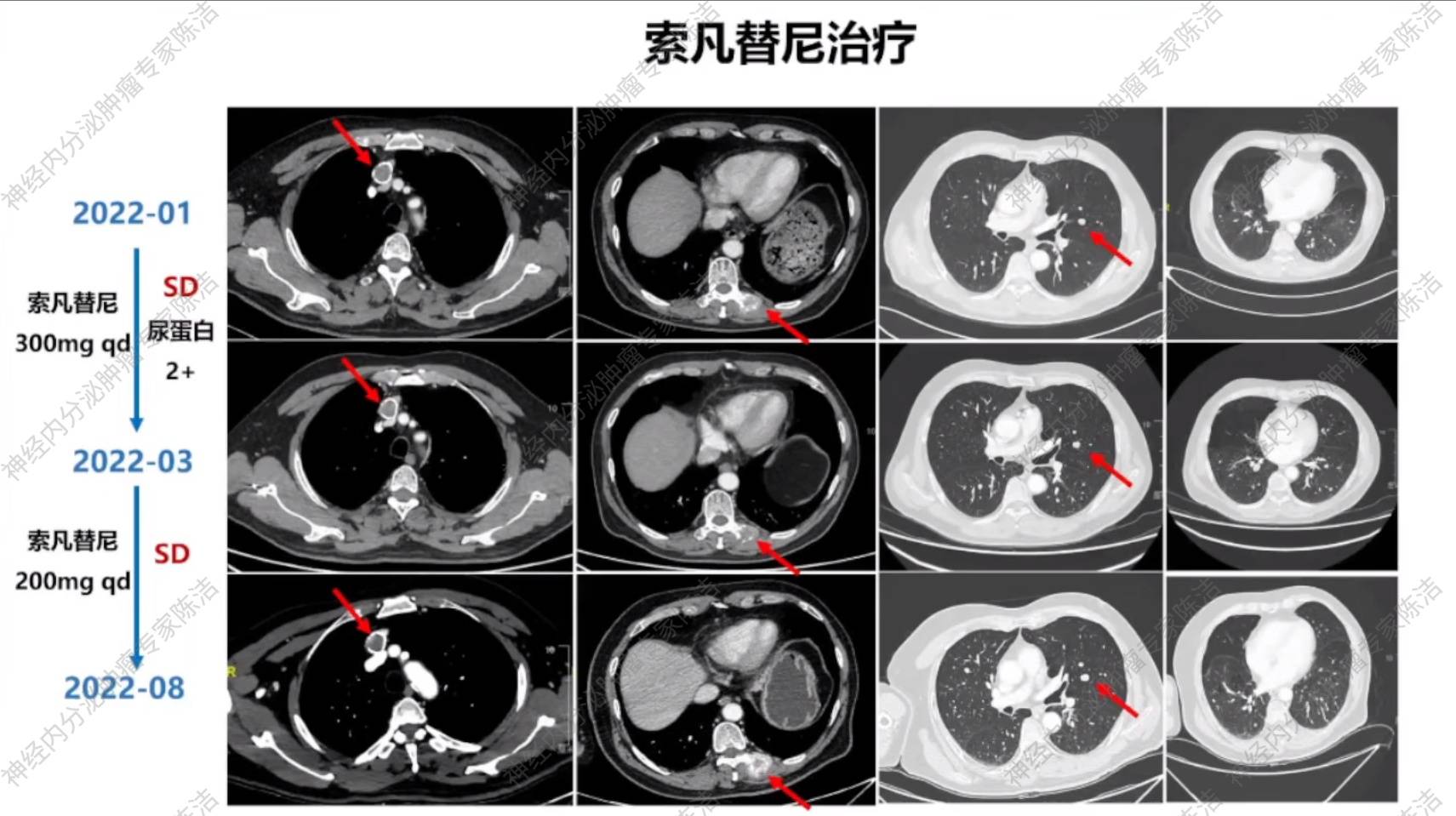
患者于2022年1月予以靶向药物索凡替尼(300mg qd)治疗,期间出现血压升高,予以缬沙坦+氨氯地平降压后血压恢复正常。
2022年3月,患者出现血压升高及尿蛋白阳性(++),尿蛋白定量为337mg/24h。因此,索凡替尼减量至200mg qd,并辅以百令胶囊治疗。
2022年8月复查胸腹部增强CT,提示疾病稳定(SD),继续予以索凡替尼(200mg qd)治疗。
替莫唑胺单药化疗
2022年10月,患者因“不稳定型心绞痛”行球囊扩张成形术,术后予以氯吡格雷+吲哚布芬双联抗血小板治疗。考虑到索凡替尼及抗血小板药物联用存在高出血风险,予停用索凡替尼,更换为替莫唑胺(350mg d1-5 q28d)单药化疗。替莫唑胺治疗期间,复查影像学评估为SD。

2024年1月,复查胸腹盆增强CT检查,提示肝脏出现新发转移灶且增大,肺部病灶亦有增大,疾病再次进展。
患者重新予以索凡替尼(200mg qd)治疗。但用药仅1个月后,患者便出现咯血,再次停用索凡替尼,2024年3月予以替莫唑胺治疗。
2024年5月,胸腹盆增强CT检查提示PD,进展以肝脏病灶为主。
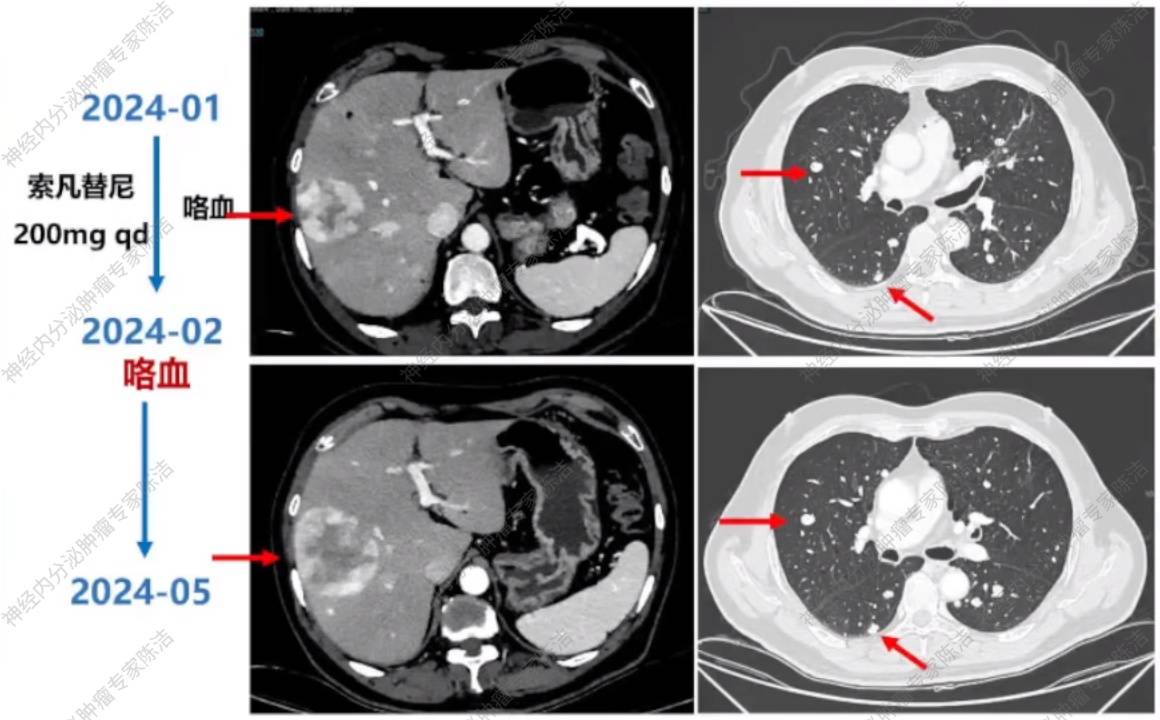
局部减瘤手术
为控制肝脏的巨大负荷,患者于2024年7月行“肝右叶部分肿瘤切除术+胆囊切除术+肝肿瘤射频消融术”。
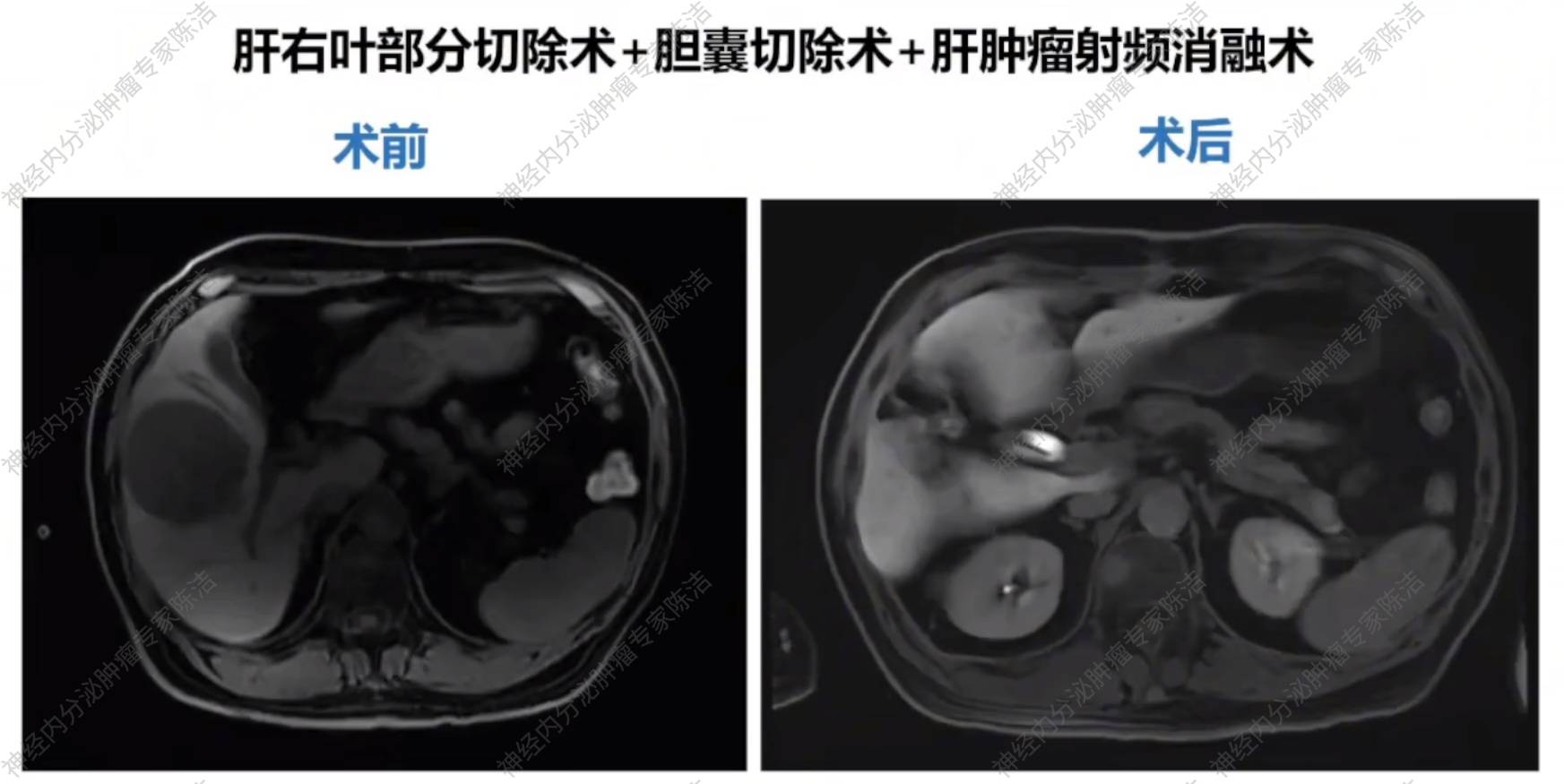
术后病理提示:肿瘤具有NET组织学形态,但IHC神经内分泌标记物(Syn,CgA和INSM1)均为阴性。结合病史,不除外治疗后标记物失表达的可能,脉管瘤栓(+),肿瘤大小9.5*8*5cm,肝切缘阴性。免疫组化结果:AE1/AE3(+),Syn(-),CgA(-),INSMI1(-),RB1(部分+),P53(部分+),SSTR2(-),PAX8(+),GATA3(-),Ki-67(+15%)。

依维莫司靶向治疗
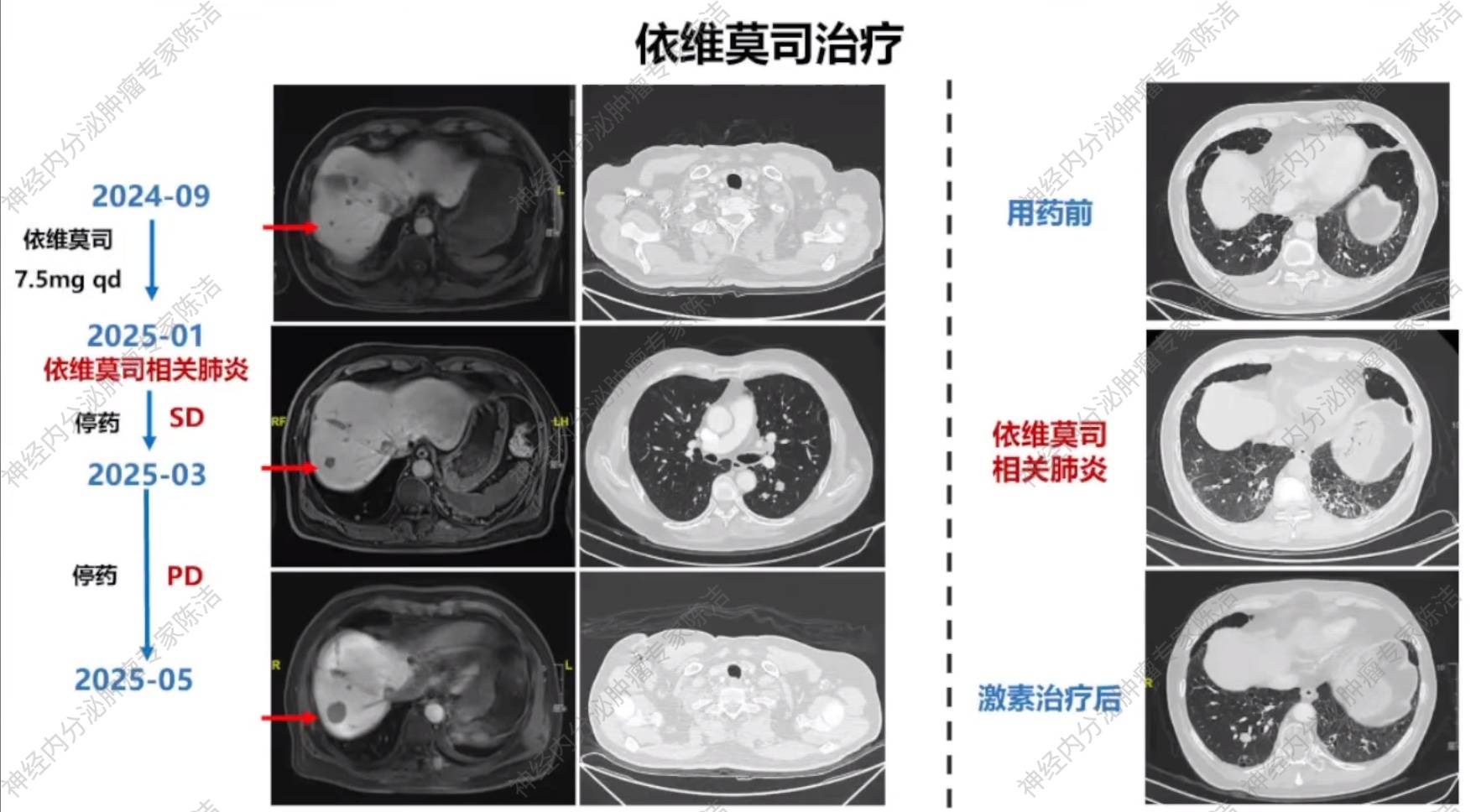
患者术后予以索凡替尼(200mg qd)治疗。用药2个月后(2024年9月),患者再次出现咯血。停用索凡替尼,予以依维莫司(5mg qd➞7.5mg qd)治疗。
2024年12月复查胸腹盆增强CT+肝普美显MRI检查,疗效评估为SD。

依维莫司治疗4个月后(2025年1月),患者出现发热、咳嗽,胸部CT提示双下肺炎症。随即停用依维莫司,并使用泼尼松(35mg qd,每周减量5mg)治疗。
2025年3月复查胸腹盆增强CT检查,疗效评估为SD。
2025年5月,影像学检查评估为PD。
化疗
患者予以FOLFOX方案化疗。截至2025年7月,已完成一个周期的治疗,正等待后续的疗效评估。
MDT讨论
李媛教授:该患者的病理表现不典型。首次骨盆转移灶的病理,形态学上具有NET特征(富于血窦),但神经内分泌标记物CgA和Syn仅为灶状阳性。Ki-67(12%),符合G2级别。后期肝转移灶的切除标本,所有的神经内分泌标记物均为阴性。这种情况可能反映了肿瘤的异质性,即在疾病进展和多线治疗后,肿瘤细胞的表型发生了改变。尽管标记物阴性,但在排除了其他肿瘤类型的可能性后,结合其完整的病史和形态学特征,目前的诊断仍然是中等级别的NET。
徐俊彦教授:该患者的核医学影像结果与其病理特征和临床过程相符。18F-FDG-PET/CT扫描提示整体肿瘤的糖代谢水平不高,无论是前纵隔的原发灶,还是肺、骨的转移灶,FDG摄取都只是轻度增高。这提示肿瘤的恶性程度相对较低,增殖活性不强,符合一个相对惰性的G2级别NET的特征;99mTc-TOC SPECT扫描提示仅有T9椎体的转移灶存在轻度摄取,而肺内结节及其他病灶均为阴性。这与病理免疫组化SSTR阴性的结果一致,这表明该患者不适合接受基于SSTR的治疗,如常规剂量的长效奥曲肽或肽受体放射性核素治疗(PRRT)。
汤伟教授:患者初期表现为前上纵隔占位,其罕见的“蛋壳样”钙化特征提示可能为胸腺肿瘤或畸胎瘤。在2022年1月至8月的索凡替尼治疗期间,尽管纵隔病灶大小变化不显,但内部强化减弱,肺部及骨转移灶也保持稳定,总体疗效评估为SD。后病情出现进展,此次进展主要体现在肝右叶包膜下病灶及盆腔转移灶的显著增大,同时肺部转移结节也同步增大。随后患者接受了手术切除,术后(2024年9月)影像显示,肝内残余小病灶与肺部转移灶仍在持续增大。至2025年5月,肝脏病灶急剧增大,再次被明确评估为PD。
陈洁教授总结
这个病例的诊疗过程充满挑战,充分体现了晚期胸腺NET治疗的复杂性。索凡替尼虽对患者有效,但也带来了严重的毒性问题。由于患者存在基础疾病需使用抗血小板药物,服用索凡替尼后反复出现出血,即便调整了抗凝方案也未能避免,最终被迫停药。索凡替尼导致出血的风险确实存在,尤其在合并使用抗凝药的患者中风险更高。因此,临床实践中建议从200mg的小剂量开始使用索凡替尼,而非标准剂量的300mg,若小剂量有效则无需加量,以最大程度降低高血压、蛋白尿、出血等不良反应的发生率。
同样,依维莫司的治疗也因毒副反应而中断。该患者在使用7.5mg的剂量时(标准剂量为10mg)就出现了药物相关性肺炎,导致治疗无法继续。临床中,超过半数的患者都难以耐受10mg的标准剂量,因此建议从5mg的小剂量开始,视患者耐受情况缓慢上调。
该病例生动地展示了在治疗一位基础病众多的老年患者时所面临的挑战。尽管治疗过程充满波折,但通过对药物不良反应的高度重视和及时处理,患者自发病以来已生存五年,突显了在治疗过程中精细化管理的重要性。对于晚期胸腺NET,我们应根据患者的具体情况(基础疾病、药物耐受性、SSTR表达等)制定个体化的全程管理策略,密切监测并积极处理药物不良反应,适时调整剂量或更换方案,确保治疗得以延续并最终让患者获益。
更多精彩病例,可点击或复制以下链接,粘贴到浏览器查看神经内分泌肿瘤MDT云诊室-胸腺类癌/不典型类癌专场回放:
https://doctor.liangyihui.net/#/doc/150698

本文仅供健康科普使用,不能作为诊断、治疗的依据,请谨慎参阅。











 苏公网安备32059002004080号
苏公网安备32059002004080号


