青海省肿瘤质量控制中心秘书
青海省乳腺癌质控专家组委员
青海省抗癌协会中西医整合肿瘤专业委员会委员
青海医学会乳腺分会委员
青海省病理生理学会低氧医学与高原疾病专业委员会委员
甘青宁乳腺疾病中青年医师联盟委员
荣获2023年度西南、西北输液港手术大赛总冠军,全国二等奖
以第一作者(含共同)在STTT(NeoSAC研究), BMC cancer等杂志发表SCI及核心论文6篇
ASCO 解读文献
Abstract 511
A phase 2 study of response-guided neoadjuvant sacituzumab govitecan and pembrolizumab (SG/P) in patients with early-stage triple-negative breast cancer: Results from the NeoSTAR trial.
一项以治疗反应为指导的戈沙妥珠单抗联合帕博利珠单抗(SG/P)新辅助治疗早期三阴性乳腺癌的II期研究:NeoSTAR试验结果
摘要
研究背景
戈沙妥珠单抗(Sacituzumab govitecan,SG)是一种靶向TROP-2的抗体偶联药物(ADC),已获批用于治疗转移性三阴性乳腺癌(TNBC)。帕博利珠单抗(Pembrolizumab,P)作为抗程序性死亡受体1单克隆抗体,获批用于早期TNBC及PD-L1阳性转移性TNBC的治疗。然而,SG/P联合方案在早期TNBC中的安全性与疗效尚未明确。我们既往发表了NeoSTAR研究中A1组评估新辅助SG单药治疗早期TNBC的结果(Spring等,《肿瘤学年鉴》2024)[1]。本文旨在呈现NeoSTAR研究A2组(临床试验注册号NCT04230109)关于新辅助SG/P联合方案治疗早期TNBC的研究结果。
研究方法
入组标准:未经治疗的早期三阴性乳腺癌(TNBC)患者(肿瘤直径≥ 2cm或淋巴结阳性)。治疗方案:患者接受SG起始剂量10mg/kg(每21天周期第1、8日给药),联合P 200 mg(每周期第1日给药),共4个周期。评估方法:试验方案结束后行影像学检查,依据RECIST v1.1标准评估残留影像学病灶;疑似残留病灶(RD)者行组织活检;根治性手术前是否行补充新辅助化疗(ANACT)由主治医师决定。研究终点:主要研究终点:新辅助SG/P治疗的病理完全缓解率(pCR);次要研究终点:ANACT率、影像学缓解率(RR)、安全性及耐受性(按CTCAE v5.0标准记录不良事件[AEs])、2年无事件生存期(EFS)。统计方法:采用Simon两阶段设计及标准描述性统计,所有率值估计均计算95%置信区间(图1)。
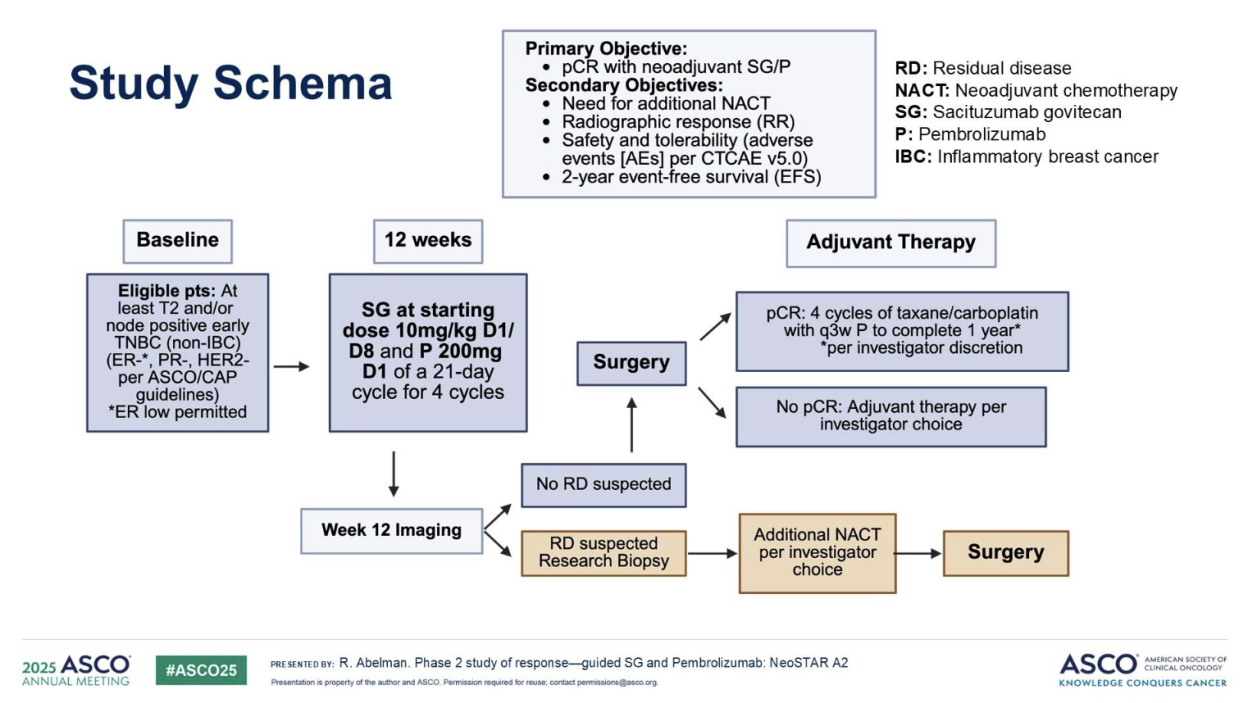
研究结果
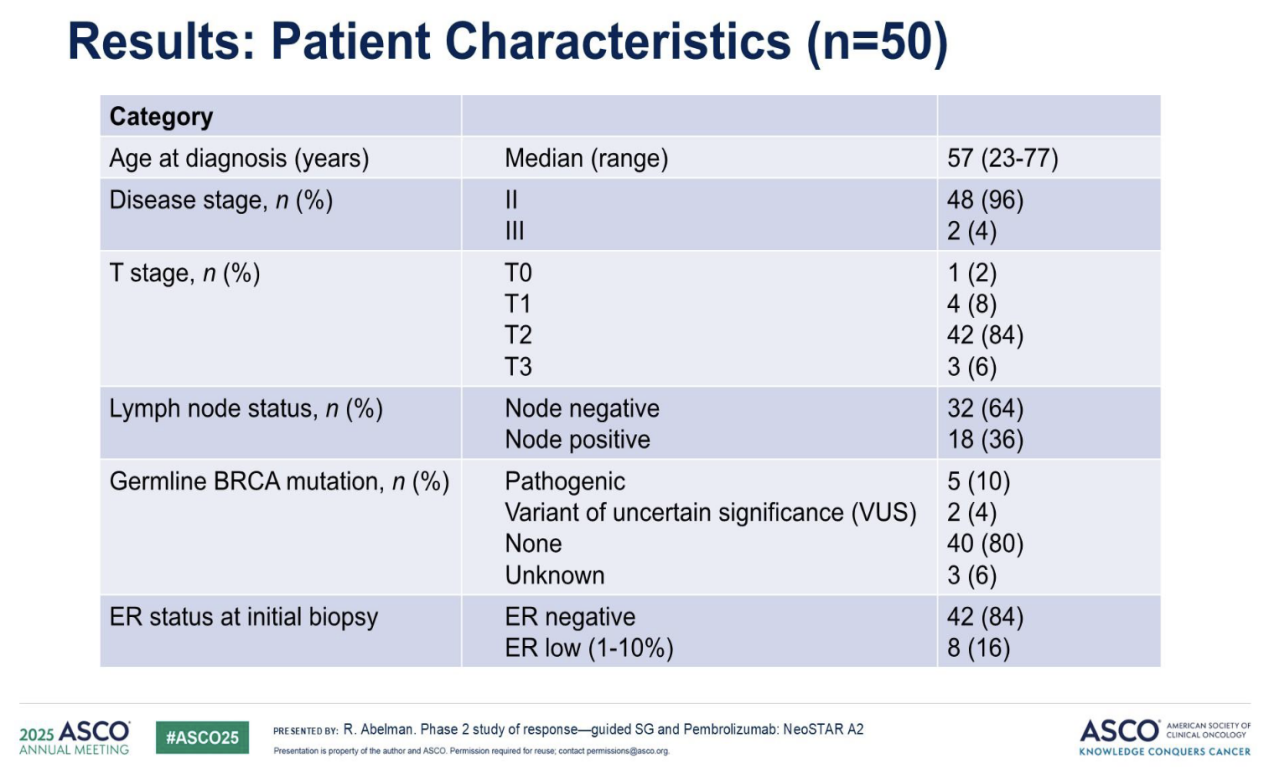
(1)入组患者基线特征
在2023年5月19日至2024年8月13日期间,共入组50例患者(中位年龄:57岁,范围:23-77岁)。临床分期:II期患者48例(96%),III期患者2例(4%)。64%的患者在确诊时为淋巴结阴性(详见表1)。
表1 NeoSTAR患者基线特征
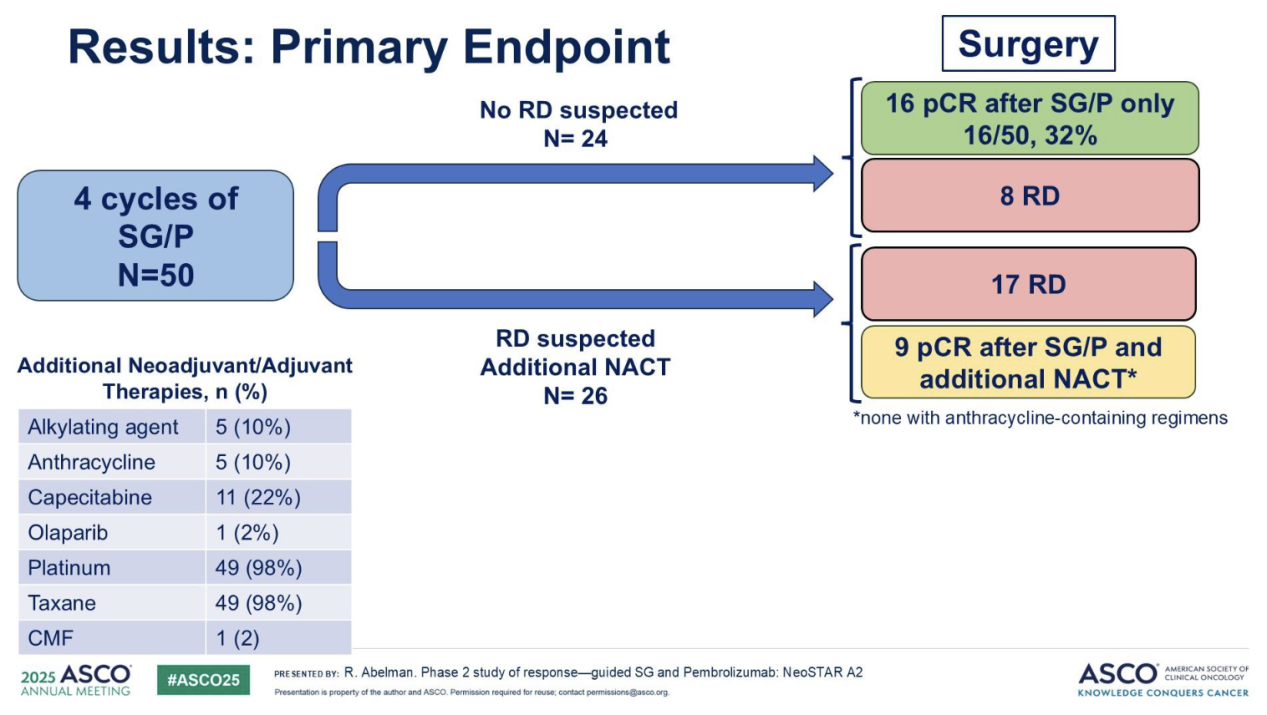
(2)主要研究终点
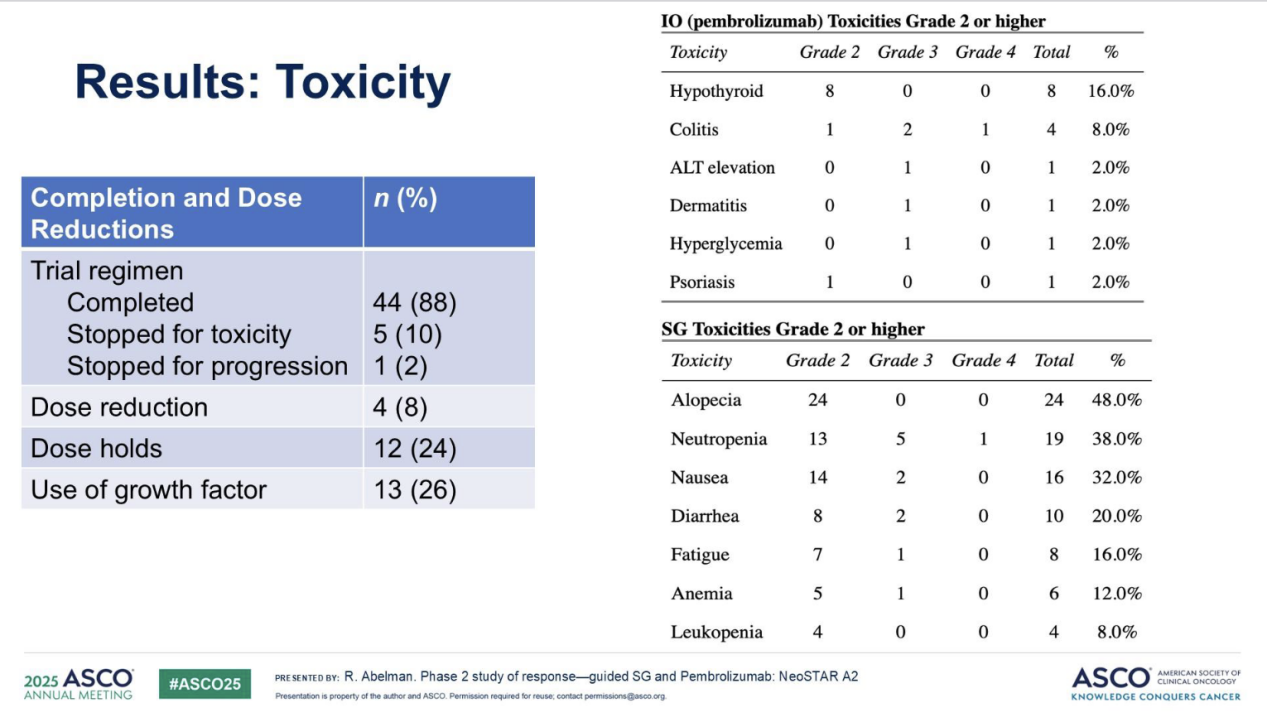
44例患者(88%)完成了试验方案规定的治疗(5例因毒性停药,1例治疗期间疾病进展)。在中期分析中,15例患者中有5例达到pCR,后续入组了剩余的35例患者。主要研究终点(pCR率-方案定义:患者在接受SG/P治疗后,未接受补充新辅助化疗(ANACT),直接手术时达到pCR),pCR率为16/50(32%, 95% CI 19.5-46.7)(图2)。
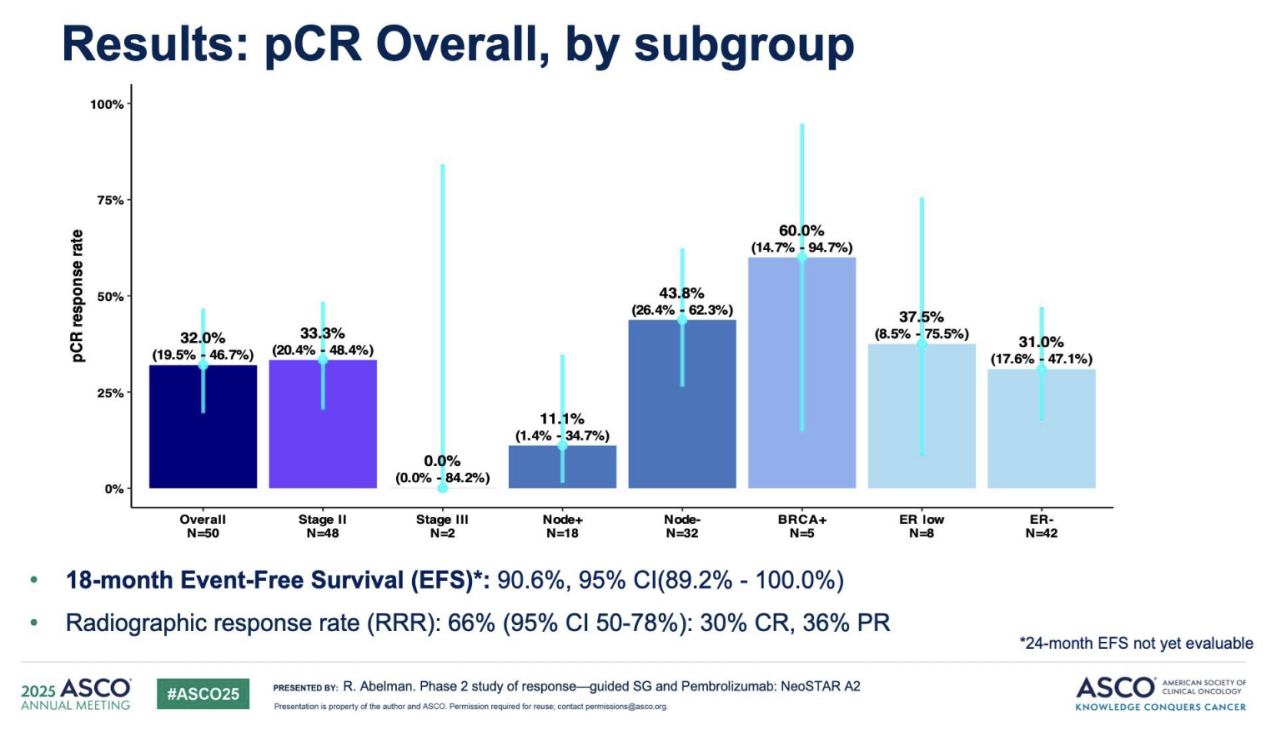
(3)次要研究终点
客观缓解率(ORR):(完全缓解 [CR] 或部分缓解 [PR])为66%(95% CI 50-78%),其中CR率30%,PR率36%。在26例后续接受了ANACT的患者中,9例最终在手术时达到pCR(其中:2例活检确认有残留病灶[RD],6例残留病灶活检结果为阴性或非诊断性,1例未行活检)。总体pCR率:共有25例患者(50%,95%CI 35.5-64.5)在手术时达到pCR。BRCA突变患者疗效:在5例携带致病性BRCA突变的患者中,3例(60%)在接受SG/P治疗后即达到pCR,另有1例患者在后续接受ANACT后达到pCR。各亚组疗效结局详见图4。
(4)安全性
20例患者(40%)发生了3级及以上的不良事件(AEs)。最常见的不良事件(任何级别)包括:恶心(28例,56%),脱发(26例,52%),疲劳(23例,46%),腹泻(22例,44%)。SG的剂量降低发生在4例患者(8%)中(表2)。
表2 NeoSTAR不良反应结果
研究结论
在针对早期三阴性乳腺癌(TNBC)的首项SG/P联合方案研究中,32%的患者达到病理完全缓解(pCR)。需进一步探索以确定SG/P新辅助治疗联合化疗的最佳持续时间和用药顺序,为TNBC患者制定个体化治疗策略。
解读
NeoSTAR研究亮点解读
NeoSTAR研究是全球首个在早期TNBC中探索抗体偶联药物(SG)联合免疫检查点抑制剂(P)的新辅助治疗模式的探索,该研究打破了既往传统化疗框架的束缚,首开“ADC+免疫”新辅助治疗方案的先河。戈沙妥珠单抗(SG)作为TROP-2 ADC药物,通过释放拓扑异构酶I抑制剂SN-38杀伤肿瘤细胞,同时诱导免疫原性细胞死亡,增强PD-1抑制剂(帕博利珠单抗)的疗效,研究创新性鲜明,为TNBC新辅助治疗“去化疗”策略提供了新的方向。
首先,本研究严格把控入排标准,符合条件的患者:至少T2和/或淋巴结阳性早期TNBC(非IBC)(ASCO/CAP指南ER-、PR-、HER2-),其中,允许ER低表达。用药方面,SG起始剂量10mg/kg D1/D8,P 200mg D1,每21天为一个周期,共4个周期。12周疗程结束后给予影像学评估,无可疑残留病灶者进入手术阶段;有可疑残留病灶者进入由研究者选择额外的新辅助化疗阶段后再行手术治疗。本研究基于治疗反应为指导的动态治疗决策设计具有个体化、科学化的特点,为疗效不足的患者提供了有效的补救预案。
可喜的是,本研究取得了疗效与安全性的双重突破,与TNBC新辅助标准治疗方案,如IMpassion031[2]、KEYNOTE-522[3]和CamRelief [4]研究相比。NeoSTAR研究方案中,16/50(32%)的患者在SG/P治疗4个周期后达到pCR。虽然本研究pCR率低于目前的“化疗+免疫”标准治疗方案,但是,值得注意的是,SG/P疗程延长(6-8周期)、剂量调整、用药顺序或能进一步提高pCR率尚不明确,有待进一步探索。同时,目前正在进行的转化分析旨在识别与SG/P治疗反应相关的机制及生物标志物有望为筛选获益人群做出精准指导。安全性方面,与既往研究相比,未发现新的安全性信号,3级以上不良反应发生率低于既往研究,较少患者出现剂量降低(8%)或治疗中止(10%)。
TNBC新辅助化疗方案有待进一步优化
目前,国内外指南一致推荐新辅助治疗为高危早期TNBC的标准治疗[5]。研究表明,新辅助治疗后获得pCR的患者预后显著改善[无事件生存期(EFS)HR(95%置信区间):0.24(0.20-0.29);总生存期(OS):0.19(0.15-0.24)][6,7]。既往以蒽环和紫杉类药物为基石的化疗方案其疗效存在局限性,pCR率仅为25%-40%[8,9]。多项研究表明,铂类药物与紫杉类药物联合使用,相较于传统的蒽环联合紫杉类方案,能够进一步提高TNBC新辅助治疗的pCR率和生存期并改善安全性[10-13]。
TNBC新辅助免疫+化疗方案成为标准治疗方案
既往IMpassion031研究[2]结果显示,阿替利珠单抗联合化疗对比安慰剂联合化疗可显著提升pCR率(58% vs 41%,P=0.0044)。KEYNOTE-522[3]研究结果一致证实,帕博利珠单抗联合化疗对比安慰剂联合化疗进一步提升pCR率(64.8% vs 51.2%,P<0.001),5年总生存数据显示,免疫联合化疗显著优于单纯化疗(86.6% vs 81.7%,P=0.002)。CamRelief研究[4]结果显示,卡瑞利珠单抗组pCR率较安慰剂组显著提升12.2%(56.8% vs 44.7%,95%CI 3.3-21.2;单侧P=0.0038)。目前,免疫联合化疗已成为国内外指南一致推荐的TNBC新辅助治疗标准方案。然而,免疫联合化疗方案仍存在耐药的局限性,40%左右的患者仍未达到pCR,亟待探索新型治疗策略逆转耐药难题。
本人前期开展的NeoSAC研究进一步提升了TNBC的新辅助pCR率
为了解决免疫耐药临床问题,我们在国际上率先开展了抗血管联合免疫和化疗的前瞻性、多中心临床研究(NeoSAC研究),研究结果令人鼓舞,在意向治疗人群(ITT)中,进一步提升pCR率至70.6%,在符合方案人群(PPP)中,进一步提升pCR率至72.7%,创历史新高[14]。安全性方面,与既往IMpassion031研究[2]、KEYNOTE-522研究[3]相当,未发现新的安全信号,不良反应可防可控。
总之,NeoSTAR研究开创性探索了抗体偶联药物戈沙妥珠单抗(SG)联合帕博利珠单抗(P)治疗早期TNBC。研究中,接受试验方案治疗后整体pCR率为32%,需要特别强调的是,多数患者手术前接受了额外的化疗,其中部分患者未确认在接受SG/P试验方案治疗后是否有残留病灶,因此SG/P联合方案的真实pCR率仍需进一步验证。同时,该方案的毒性显著低于当前标准治疗KEYNOTE-522方案[3],可有效保障患者治疗期间的生活质量。目前,研究者通过实验室分析积极探寻预测SG/P联合方案敏感性的生物标志物,这对实现个体化治疗、提升临床获益意义深远,而更进一步的深化研究、建立精准的患者筛选策略,是推动其成功转化的必经之路。
赵久达教授---青海大学附属医院乳腺疾病诊疗中心
刘之林博士对2025ASCO大会上NeoSTAR临床研究的摘要部分进行了系统性解读,内容全面而深刻,解读覆盖了研究背景、研究设计等内容,后深入分析解读了研究的结果和结论部分,并对目前TNBC新辅助研究现状进行了横向拓展和纵向延伸。刘之林博士精准提炼了NeoSTAR研究的核心价值——开创性地探索了“ADC+免疫”新辅助治疗模式,更凸显了其“去化疗”策略的前瞻性临床意义。同时刘博士指出该研究的两大突破:一是为不可耐受传统化疗的患者提供了低毒的替代方案(3级以上AE发生率显著低于KEYNOTE-522研究)。二是通过动态治疗设计实现了个体化干预措施(如ANACT补救机制)。尤为可贵的是,刘博士结合自身NeoSAC研究(pCR率70.6%)、IMpassion031研究、KEYNOTE-522研究、以及最新的CamRelief研究进行横向对比,辩证分析了SG/P方案pCR率(32%)的潜在提升空间,并强调了转化研究对生物标志物探索的关键性。点评中,刘博士立足临床需求,既肯定该研究为TNBC治疗开辟了新路径,也客观指出其局限性(如ANACT对pCR率的干扰),体现了青年学者严谨的循证思维与创新视野。未来需聚焦生物标志物挖掘及方案优化,进一步推动精准治疗服务于临床实践。
【温馨提示】:如果您觉得刘之林医生解读的好,请在下方为他点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!
[1]Spring LM, Tolaney SM, Fell G, et al. Response-guided neoadjuvant sacituzumab govitecan for localized triple-negative breast cancer: results from the NeoSTAR trial. Ann Oncol. 2024;35(3):293-301.
[2] Mittendorf EA, Zhang H, Barrios CH, et al. Neoadjuvant atezolizumab in combination with
sequential nab-paclitaxel and anthracycline-based chemotherapy versus placebo and chemotherapy in patients with early-stage triple-negative breast cancer (IMpassion031): a
randomised, double-blind, phase 3 trial. Lancet. 2020;396(10257):1090-1100.
[3] Schmid P, Cortes J, Dent R, et al. Overall Survival with Pembrolizumab in Early-Stage
Triple-Negative Breast Cancer. N Engl J Med. 2024;391(21):1981-1991.
[4] Chen L, Li H, Zhang H, et al. Camrelizumab vs Placebo in Combination With Chemotherapy as Neoadjuvant Treatment in Patients With Early or Locally Advanced Triple-Negative Breast Cancer: The CamRelief Randomized Clinical Trial. JAMA. 2025;333(8):673-681.
[5] National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology:
Breast Cancer. Version 3.2025. 2025.
[6] Guillermo, Villacampa,Victor, Navarro,Alexios, Matikas et al. Neoadjuvant Immune
Checkpoint Inhibitors Plus Chemotherapy in Early Breast Cancer: A Systematic Review and
Meta-Analysis.[J] .JAMA Oncol, 2024, 10: 0.
[7] Huang M, O'Shaughnessy J, Zhao J, et al. Association of Pathologic Complete Response with
Long-Term Survival Outcomes in Triple-Negative Breast Cancer: A Meta-Analysis. Cancer Res.
2020;80(24):5427-5434.
[8] Sikov WM, Berry DA, Perou CM, et al. Impact of the addition of carboplatin and/or
bevacizumab to neoadjuvant once-per-week paclitaxel followed by dose-dense doxorubicin and
cyclophosphamide on pathologic complete response rates in stage II to III triple-negative breast
cancer: CALGB 40603 (Alliance). J Clin Oncol. 2015;33(1):13-21.
[9] Untch M, Jackisch C, Schneeweiss A, et al. Nab-paclitaxel versus solvent-based paclitaxel in
neoadjuvant chemotherapy for early breast cancer (GeparSepto-GBG 69): a randomised, phase 3
trial [published correction appears in Lancet Oncol. 2016 Jul;17 (7):e270]. Lancet Oncol.
2016;17(3):345-356.
[10] Liu Z, Li J, Zhao F, et al. Long-term survival after neoadjuvant therapy for triple-negative
breast cancer under different treatment regimens: a systematic review and network meta-analysis.
BMC Cancer. 2024;24(1):440.
[11] Gluz O, Nitz U, Kolberg-Liedtke C, et al. De-escalated Neoadjuvant Chemotherapy in Early
Triple-Negative Breast Cancer (TNBC): Impact of Molecular Markers and Final Survival
Analysis of the WSG-ADAPT-TN Trial. Clin Cancer Res. 2022;28(22):4995-5003.
[12] Zhao F, Shen G, Dong Q, et al. Impact of platinum-based chemotherapy on the prognosis of
early triple-negative breast cancer: a systematic review and meta-analysis. Clin Exp Med.
2023;23(6):2025-2040.
[13] Zhang L, Wu ZY, Li J, et al. Neoadjuvant docetaxel plus carboplatin vs epirubicin plus
cyclophosphamide followed by docetaxel in triple-negative, early-stage breast cancer (NeoCART): Results from a multicenter, randomized controlled, open-label phase II trial. Int J Cancer.
2022;150(4):654-662.
[14] Shen G, Liu Z, Wang M, et al. Neoadjuvant apatinib addition to sintilimab and
carboplatin-taxane based chemotherapy in patients with early triple-negative breast cancer: the
phase 2 NeoSAC trial. Signal Transduct Target Ther. 2025;10(1):41.











 苏公网安备32059002004080号
苏公网安备32059002004080号


