非小细胞肺癌(NSCLC)是全球癌症死亡的主要原因之一,表皮生长因子受体(EGFR)突变是亚洲NSCLC患者中最常见的驱动基因突变。EGFR酪氨酸激酶抑制剂(EGFR-TKI)虽显著改善了患者预后,但获得性耐药几乎不可避免,严重限制了生存获益。间质上皮转化因子(MET)通路异常激活是重要的耐药机制之一,通常表现为MET基因扩增或蛋白过表达,在EGFR-TKI治疗进展患者中发生率约5%-26%。针对这一耐药机制, MET-TKI联合EGFR-TKI的组合策略逐渐受到重视。
近期,重庆大学附属江津医院王玉波教授团队在BMC Cancer发布了一篇全面评估MET-TKI联合EGFR-TKI在EGFR突变伴继发性MET改变的NSCLC患者中的疗效和安全性的系统性荟萃分析,为优化这类患者的治疗策略提供了重要循证依据。【肿瘤资讯】特邀王玉波教授深度解读这一研究成果,畅谈EGFR-TKI耐药后继发MET变异治疗前景。
重庆大学附属江津医院呼吸与危重症医学科主任
中国抗癌协会肿瘤缺氧生物学和临床应用专委会 委员
中国控制吸烟协会医疗机构控烟及健康促进专委会 委员
重庆市生物信息协会呼吸专委会 副主任委员
重庆市老年学和老年医学学会呼吸与共病分会 副主任委员
重庆医学会呼吸病学分会青委会 副主任委员
重庆医学会结核病学分会青委会 副主任委员
重庆市医师协会呼吸医师分会 常务委员
重庆市预防医学会呼吸病预防与控制专委会 常务委员
获湖南省科技进步一等奖、重庆市科技进步二等奖各1项。主持国家自然基金、国家卫健委课题及重庆市自然基金等9项课题。通讯或第一作者在Journal of Thoracic Oncology、Clinical Cancer Research及Clinical Infectious Diseases 等SCI期刊发表论文17篇。通讯或第一作者在核心统计源期刊发表论文20余篇。获国家发明专利3项。
文献解读
该荟萃分析严格遵循PRISMA指南,通过检索PubMed、Embase和Cochrane Library数据库,筛选了截至2024年8月的相关临床研究。最终纳入6项前瞻性研究,共562例患者。这些研究考察了不同MET-TKI(卡马替尼、特泊替尼、赛沃替尼)联合不同代次EGFR-TKI(吉非替尼、厄洛替尼、奥希替尼)治疗EGFR-TKI耐药后继发MET变异的晚期NSCLC患者的疗效和安全性。值得注意的是,各研究对MET变异的定义和检测方法存在一定差异,但大多采用MET基因拷贝数(GCN)≥5或MET:CEP7比值≥2和/或MET蛋白表达IHC 2+/3+作为纳入标准。荟萃分析结果显示:
整体疗效:
MET-TKI联合EGFR-TKI治疗EGFR突变伴继发性MET变异NSCLC患者,客观缓解率(ORR)达49.2%,疾病控制率(DCR)达78.6%,中位缓解持续时间(mDOR)为6.85个月,中位无进展生存期(mPFS)为5.62个月(图1)。这些疗效指标显著优于既往数据中传统化疗或免疫治疗(ORR:0-18.2%;DCR:50%-72.7%;mPFS:2.5- 2.9个月)。
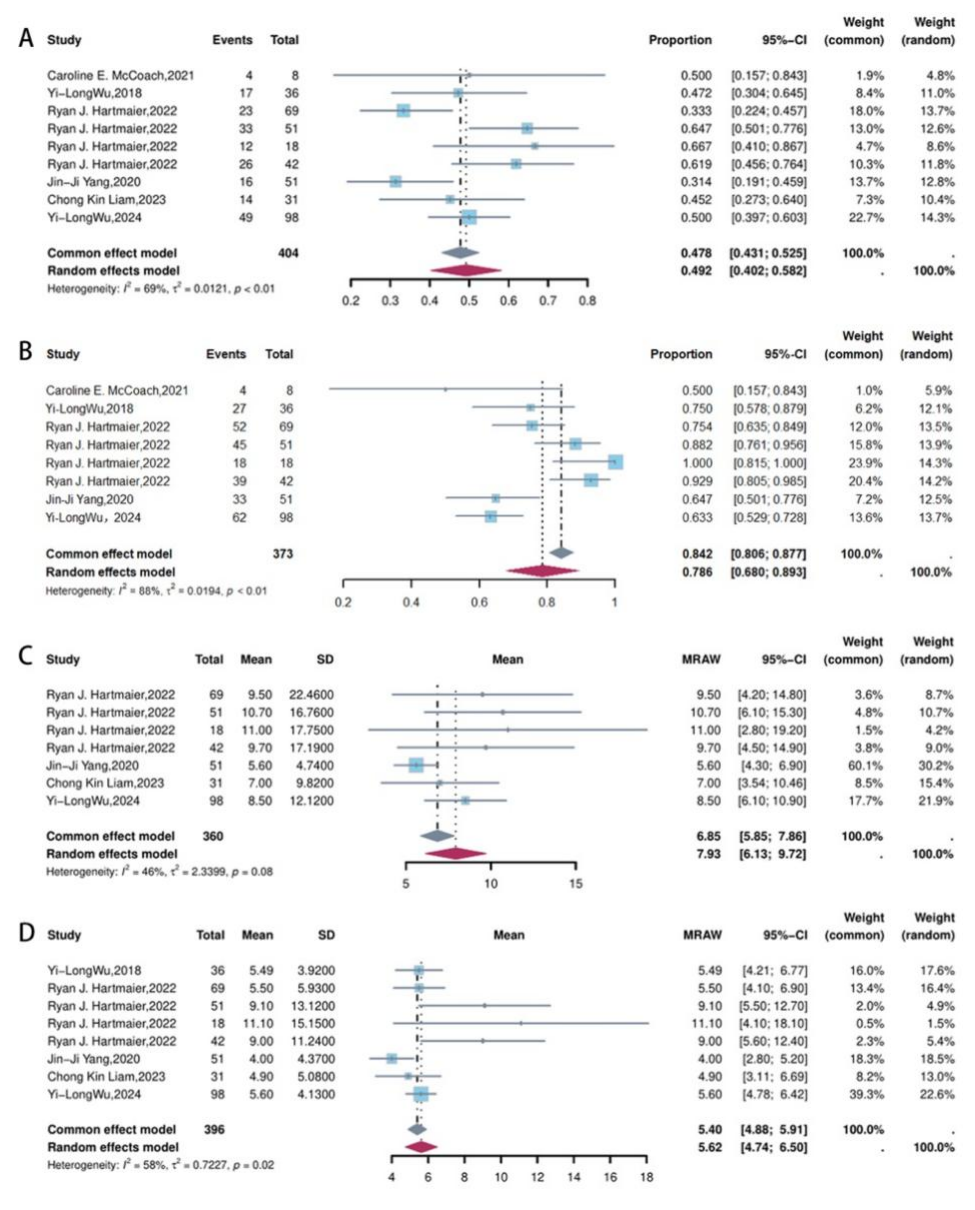
不同代次EGFR-TKI比较:
在T790M阴性伴继发性MET变异的EGFR-TKI耐药患者中,MET-TKI联合第三代EGFR-TKI(主要为奥希替尼)相较于联合第一代EGFR-TKI在所有关键疗效指标上均显示出数值优势:ORR(56.8% vs 47.8%),DCR(81.6% vs 75%),mDOR(9.08个月 vs 7.00个月),以及mPFS(7.45个月 vs 4.55个月,p=0.05)。尽管多数指标未达到统计学显著性(可能受限于亚组样本量)(图2),但这一一致趋势仍具有重要临床意义,提示对于继发性MET变异的EGFR-TKI耐药患者,无论其T790M状态如何,MET-TKI联合第三代EGFR-TKI有望提供更佳预后。
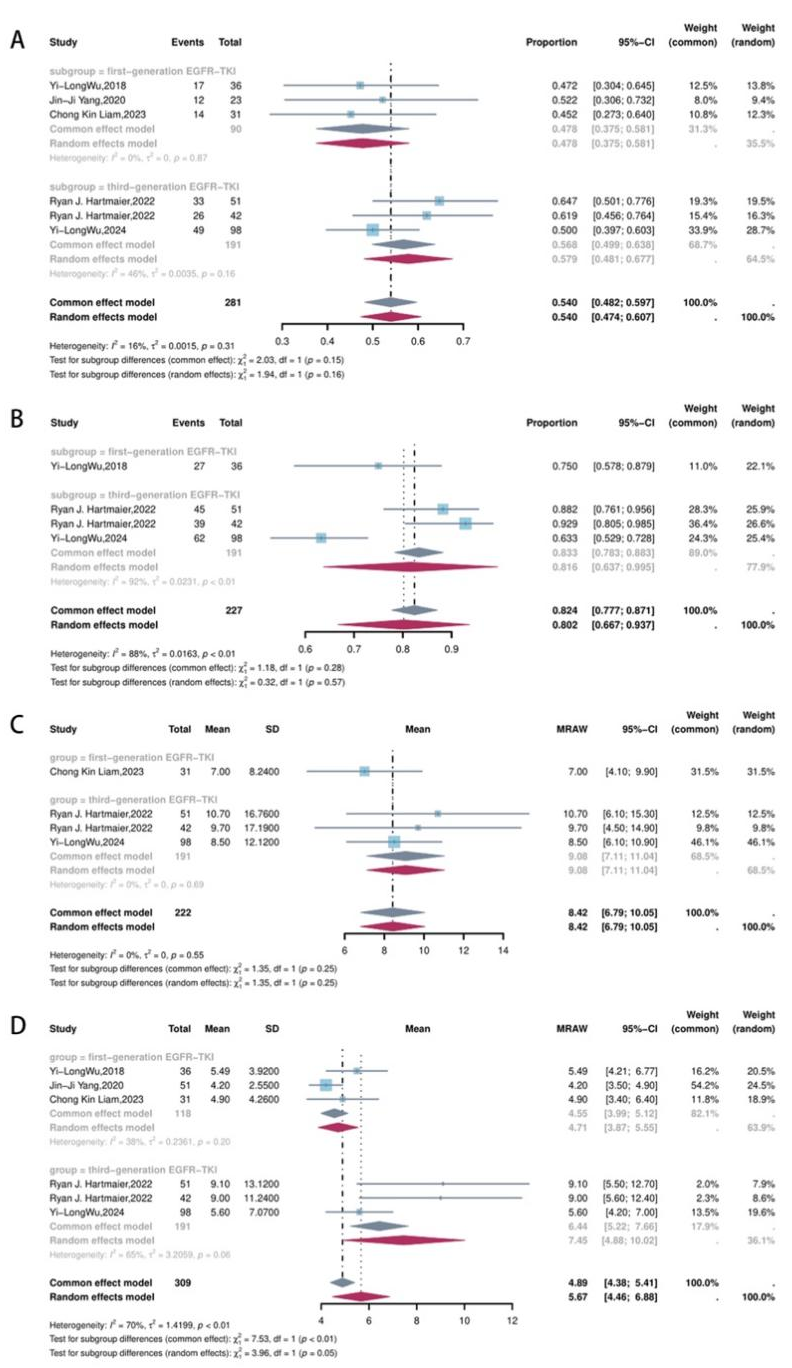
不同MET-TKI比较:
卡马替尼、赛沃替尼、特泊替尼联合不同代次EGFR-TKI在主要疗效指标上未见显著统计学差异:ORR(47.7% vs 50.7% vs 48.8%,p=0.96),mDOR(卡马替尼组数据不完整,赛沃替尼8.4个月 vs 特泊替尼8.01个月,p=0.18)和mPFS(5.49个月 vs 6.88个月 vs 5.48个月,p=0.56)。
安全性分析对比:
MET-TKI联合EGFR-TKI的治疗方案总体可耐受,大多数治疗相关不良事件(TRAE)为1-2级。最常见的AE包括恶心(36.7%)、水肿(31.7%)、腹泻(31.6%)、皮疹(27.1%)、呕吐(25.7%)、肝酶升高(约17%)和肺炎(7.3%)。卡马替尼组在肝毒性方面显示出数值上的明显优势,AST升高(2.8% vs 18.8% vs 17.4%,p=0.66)和ALT升高(14.2% vs 17.6% vs 20.1%,p=0.91)的发生率均低于其他两组(图3)。此外,卡马替尼组≥3级TRAE的发生率也呈现出更低的趋势(30.0% vs 46.7% vs 41.2%,p=0.07)。

专家点评
EGFR-TKI耐药后治疗选择是当前精准肺癌治疗的核心挑战。随着三代EGFR-TKI在EGFR突变NSCLC一线治疗中的广泛应用以及TKI耐药后再次检测的精准治疗需求MET变异作为主要耐药机制引起越来越多的学术关注。AURA3研究耐药分析显示,约19%的患者在奥希替尼治疗进展后出现MET扩增,而我国学者的研究数据显示这一比例可达34%,凸显了开发有效抗MET策略的紧迫性[1, 2]。
本荟萃分析系统整合了现有证据,为MET-TKI联合EGFR-TKI治疗策略提供了有力支持。近50%的ORR和近6个月的mPFS表明,针对这类特定耐药机制精准靶向联合干预确实具有临床价值。更重要的是,研究通过系统性比较揭示了MET-TKI联合第三代EGFR-TKI在整体疗效上可能优于联合第一代EGFR-TKI,为临床选择最佳联合策略提供了指导。从生物学机制角度,这一结果具有理论合理性。MET通路激活与EGFR信号存在复杂交互作用,两者可通过多种机制相互强化。MET扩增不仅能通过ErbB3旁路激活EGFR下游信号,还可能通过调节EGFR内化和降解影响其表面表达[3]。因此,即使在T790M阴性背景下,更强效的EGFR抑制如奥希替尼,联合MET-TKI可能提供更全面的信号阻断,产生协同抗肿瘤效应。
在联合不同方案的比较中,一个特别值得关注的发现是:虽然卡马替尼组仅纳入了与第一代EGFR-TKI联合的研究数据,而其他两种MET-TKI组则同时纳入了与第三代EGFR-TKI联合的数据,但卡马替尼联合方案仍然在ORR和mPFS等关键指标上与其他组合达到了相当的水平。考虑到本研究已明确证实联合第三代EGFR-TKI的疗效优于联合第一代,这一结果提示卡马替尼联合治疗可能具有较为优越的抗肿瘤活性。在安全性方面,卡马替尼联合治疗方案表现出明显的潜在优势,特别是在肝毒性和严重不良事件方面。虽然这些差异未达统计学显著性,但这一趋势对临床决策仍具重要参考价值,尤其考虑到这类患者通常需要长期维持治疗,安全性和耐受性成为影响生活质量和治疗依从性的关键因素。既往研究也表明卡马替尼可用于轻、中、重度肝功能损伤患者且无需调整剂量,这对于合并肝脏基础疾病或转移的患者尤为重要[4]。
卡马替尼作为第一个获FDA批准的高选择性MET-TKI,其独特的分子设计赋予了特殊的药理学和安全性特征。与其他MET-TKI不同,卡马替尼具有极高的MET选择性(IC50值为0.13nM),且对其他激酶如RON、AXL等的抑制作用微弱,因此理论上具有更精准的靶向活性和更低的脱靶毒性[4]。2024年6月,卡马替尼获得中国NMPA批准用于未经系统治疗的METex14局部晚期或转移性NSCLC成人患者的一线治疗,同年11月又成功纳入国家医保目录,大幅降低了患者经济负担。2025年CSCO指南也将卡马替尼一线治疗METex14跳突NSCLC的推荐等级提升至I级推荐。卡马替尼也是最早探索联合治疗EGFR耐药后MET扩增的MET抑制剂,2010年7月有临床专家提出在原有EGFR TKI的基础上联合抑制MET通路的药物,实现EGFR突变与耐药的“双阻断”。值得一提的是,近期一项病例系列研究评估了卡马替尼联合奥希替尼用于一线奥希替尼进展后伴MET改变NSCLC患者的疗效,研究显示该联合方案具有良好的耐受性,主要不良反应为轻度的外周水肿和胃肠道不适,患者获益显著,ORR为50%,中位PFS为18.1个月,明显优于既往研究结果[4]。
目前,MET-TKI联合EGFR-TKI治疗策略的优化仍面临若干挑战。首先是MET检测的标准化问题。当前临床实践中MET检测方法多样(FISH、IHC、NGS等),判读标准不一,不同研究采用的MET阳性界值从GCN≥3到≥10不等,这种异质性可能导致临床获益人群的判定差异。应建立统一的检测流程和阈值标准,更准确地识别联合治疗的最佳受益人群。其次,MET耐药模式的复杂性也值得关注。研究表明,MET扩增可分为原发性(de novo)和继发性扩增两种模式,且可能与其他耐药机制如C797S突变共存[5]。针对不同耐药模式的最佳治疗策略有所不同,这凸显了耐药发生时进行全面分子分型检测的必要性。
此外,动态监测在优化MET靶向治疗中的作用不容忽视。液体活检作为一种低创伤、可重复的检测手段,为实时监测MET改变和早期干预创造了时间窗口。基于“分子进展先于临床进展”的策略,有望通过及时调整治疗方案,延缓疾病进展,提高生存获益。
结语
综合现有证据和这一荟萃分析的结果,对于接受EGFR-TKI治疗后出现获得性MET变异的NSCLC患者,应考虑MET-TKI联合EGFR-TKI(优选第三代)的治疗策略。在选择具体MET-TKI时,卡马替尼因其在肝毒性方面的潜在优势和在肝功能不全患者中的安全使用特性,可能具有一定临床优先性。同时,治疗过程中应加强动态分子监测,及时识别新的耐药机制,为治疗调整提供依据,最终实现精准个体化的耐药管理。
未来,随着更多前瞻性随机对照试验数据的积累、MET检测标准的统一、更精准的疗效预测生物标志物的发现,以及创新联合治疗策略的探索,EGFR突变伴获得性MET改变NSCLC患者的预后有望得到进一步改善。
1. Ling, P. and D. Xiaorong, After third generation EGFR-TKI resistance, where is the path of advanced NSCLC patients with EGFR mutations. Tumor, 2024. 44(06): p. 566-573.
2. Chmielecki, J., et al., Analysis of acquired resistance mechanisms to osimertinib in patients with EGFR-mutated advanced non-small cell lung cancer from the AURA3 trial. Nat Commun, 2023. 14(1): p. 1071.
3. Feldt, S.L. and C.M. Bestvina, The Role of MET in Resistance to EGFR Inhibition in NSCLC: A Review of Mechanisms and Treatment Implications. Cancers (Basel), 2023. 15(11).
4. Chen, X., et al., Pharmacokinetics of capmatinib in participants with hepatic impairment: A phase 1, open-label, single-dose, parallel-group study. Br J Clin Pharmacol, 2022. 88(1): p. 91-102.
5. Elghawy, O., et al., Brief Report: Osimertinib Plus Capmatinib for Patients With MET-Altered EGFR-Mutant NSCLC Following Progression on Front Line Therapy. Clin Lung Cancer, 2025. 26(2): p. 158-163.e2.
6. Coleman, N., et al., Beyond epidermal growth factor receptor: <em>MET</em> amplification as a general resistance driver to targeted therapy in oncogene-driven non-small-cell lung cancer. ESMO Open, 2021. 6(6).
排版编辑:肿瘤资讯-CYX











 苏公网安备32059002004080号
苏公网安备32059002004080号


