激素受体阳性(HR+)/人表皮生长因子受体2阴性(HER2-)早期乳腺癌患者经过标准内分泌治疗后普遍预后良好,但临床实践证实,部分患者仍受疾病复发的威胁,且复发风险可持续数十年[1]。近年,不少研究对HR+早期乳腺癌复发风险模型进行了探索。鉴于我国乳腺癌患者群体的独特性,为了帮助我国患者实现早期治愈目标,中国医学科学院肿瘤医院徐兵河院士团队基于中国人群进行了一项跨度十年、国癌中心大样本量回顾性分析——基于中国国家癌症数据库的HR+/HER2-早期乳腺癌患者早期复发风险评估的回顾性研究[2]。2024年SABCS大会上[2],该研究首次亮相,并此后于2025 SGBCC上迎来更新[3]。
HR+早期乳腺癌复发风险暗藏玄机
辅助治疗领域存在未竟之需
乳腺癌是女性中最常被诊断的癌症,也是全球女性癌症死亡的首要原因,占女性所有癌症病例的近四分之一和癌症相关死亡的六分之一[4]。根据全球数据,2022年新增乳腺癌病例230万例,占所有新发癌症的约12%,其中66.6万例死亡[4]。乳腺癌是一种异质性疾病,过去二十年中,治疗理念已逐步发展为基于疾病生物学差异的分类策略。目前,多种分类系统被用于区分不同亚型。其中, HR+/ HER2−的管腔样肿瘤占所有乳腺癌的绝大多数(约70%)[5-6]。大多数HR+/HER2−乳腺癌患者确诊时为早期乳腺癌,并接受包括局部和全身治疗的多模式治疗[7]。
管腔型乳腺癌的全身治疗核心是5-10年的辅助内分泌治疗(ET),联合或不联合新辅助(术前)或辅助(术后)化疗。化疗通常可使选定患者的复发风险降低约30%[8-10]。辅助ET可显著降低局部复发、远处转移复发及对侧乳腺癌风险,同时改善总生存(OS)[11-12]。
然而,尽管系统性治疗高度有效,但许多女性在辅助治疗后仍面临持续的远处复发及死亡风险[13]。与多数实体瘤不同,管腔型乳腺癌的复发风险可持续数十年,近50%的复发发生在确诊5年后[14,15]。
辅助ET后的远处复发风险长期存在。早期乳腺癌协作组(EBCTCG)数据显示,即使完成5年辅助ET,患者在20年随访中仍可能发生远处转移[13]。远处复发风险与原发解剖分期密切相关,20年远处复发风险范围为10%-57%。例如,T2N0期(肿瘤直径2.0-5.0 cm且无淋巴结转移)的II期患者20年复发风险为29%;若累及4-9枚淋巴结,风险升至57%。
一项包含3133例患者的真实世界队列中,II期EBC患者的10年浸润性病变复发风险为41%。值得注意的是,淋巴结阴性亚组的10年复发风险仍高达36%[16]。
多项研究探索了辅助ET延长至10年的效果,数据显示延长治疗可适度降低高风险患者的复发风险[17-20]。尽管存在获益,但迄今未观察到额外生存获益,且延长治疗与骨痛、骨折及新发骨质疏松症发生率增加相关[21]。即使延长ET,复发风险依然存在。因此,了解HR+早期乳腺癌复发模型,识别复发风险患者,并探索潜在新兴治疗手段迫在眉睫。
鉴于我国乳腺癌患者群体的独特性,为了帮助我国患者实现早期治愈目标,中国医学科学院肿瘤医院徐兵河院士团队基于中国人群进行了一项跨度十年、国癌中心大样本量回顾性分析,研究结果先后公布于2024年SABCS[2],与2025 SGBCC[3]。
亮相SABCS
跨度十年、国癌中心大样本量回顾性分析
基于中国国家癌症数据库的HR+/HER2-早期乳腺癌患者早期复发风险评估的回顾性研究[2]纳入了2013年1月至2022年12月期间在中国国家癌症数据库中的3295例I-III期HR+/HER2-早期乳腺癌患者。入组人群特征如下:
患者年龄中位数为49岁(范围为22-80岁);
II期和III期患者占比分别为22.1%、47.3%和30.6%;
淋巴结转移(LN+)患者占62%;
92.1%的患者接受了辅助内分泌治疗,其中96例(3.2%)接受了CDK4/6抑制剂联合治疗。
于2024 SABCS上亮相的分析结果显示,在20.8个月随访中位时间里,总人群的3年RFS率为87.3%,5年RFS率为77.5%。I期、II期和III期的3年RFS分别为95.2%、91.2%和75.1%。与I期相比,III期(HR= 4.77,95% CI 3.35-6.79)和II期(HR=1.51,95% CI 1.03-2.20)患者的复发风险较高。
本研究证实,II-III期中国早期乳腺癌的3年复发风险较高。未来如何降低这部分HR+/HER2-早期乳腺癌患者的复发风险,实现更多患者临床治愈成为临床医生特别关注的问题。
更新数据亮相2025 SGBCC
再证HR+早期乳腺癌复发风险不容忽视
2025年St.Gallen国际乳腺癌会议上再次更新《中国HR+/HER2-早期乳腺癌的临床病理学特征、辅助治疗模式以及生存结局》的回顾性研究[3],进一步分析了超过2万(n=28623)样本量的患者。研究入组流程图见图1。
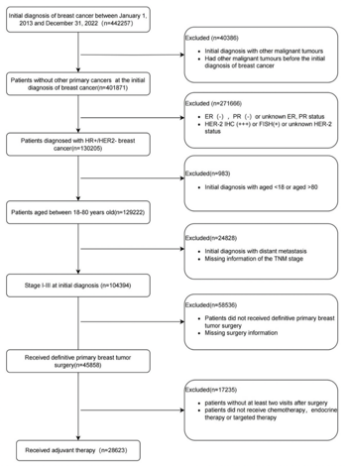
入组人群特征如下:
中位年龄为49岁(范围19-80岁);
I期、II期、III期患者的占比分别为30.28%、49.43%、20.29%;
N+患者占比为46.46%;
87.59%的患者接受了辅助内分泌治疗
表1 患者特征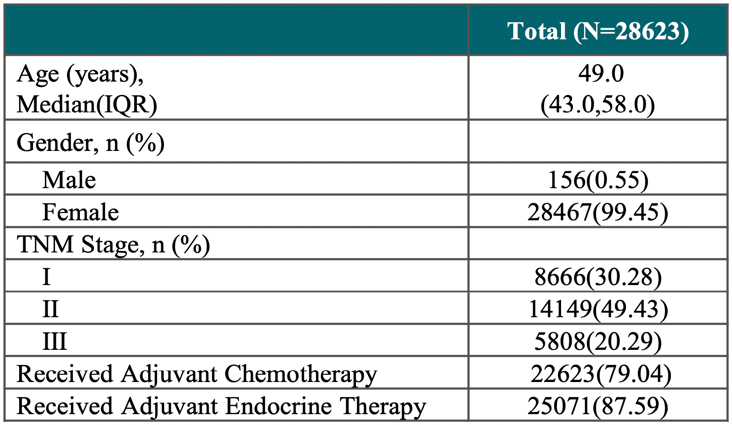
结果发现,截至2023年12月31日,中位随访时间为34.3个月。研究数据显示,总人群的3年、5年和7年真实世界无浸润性疾病生存(rwiDFS)率分别为92.15%(95%CI 91.78%-92.52%)、85.93%(95%CI 85.33%-86.53%)和78.65%(95%CI 77.65%-79.67%)。进一步分析表明,I期、II期和III期患者的5年rwiDFS率分别为93.30%、88.08%和71.41%。
淋巴结分层分析结果显示,N2-N3患者的5年rwiDFS率为72.00%。N1和N0伴高危因素患者的复发风险相似,5年rwiDFS率分别为85.80%和85.91%。而N0不伴高危因素患者的5年rwiDFS率为93.37%。值得注意的是,N0伴高危因素患者的复发风险显著高于N0不伴高危因素患者,约为后者的2倍(HR=2.16,P < 0.0001)。
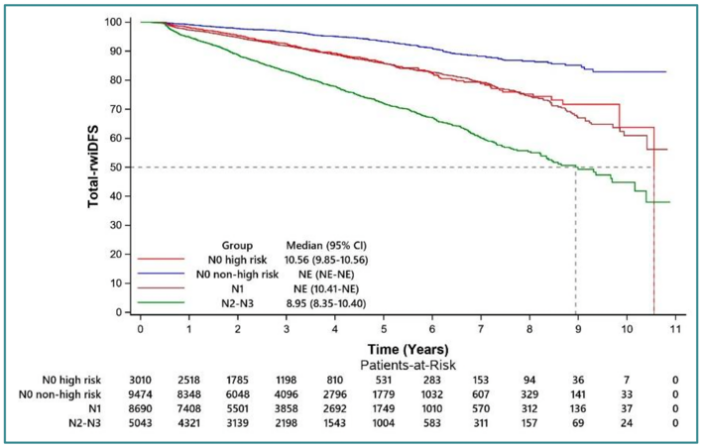
本次更新数据再次表明,中国II-III期HR+/HER2-早期乳腺癌患者存在较高的短期和长期复发风险。此外,N0伴高危因素患者的复发风险与N1患者相似,且显著高于N0不伴高危因素患者。未来如何有效降低这些高风险患者的复发风险,仍需临床进一步探索。
[1] K.R. Hess, L. Pusztai, A.U. Buzdar, G.N. Hortobagyi Estrogen receptors and distinct patterns of breast cancer relapse Breast Cancer Res Treat, 78 (1) (2003), pp. 105-118, 10.1023/a:1022166517963.
[2]Li Q, Jiang MX, Liu JX, et al. Evaluation of the Early Risk of Recurrence in HR+/HER2- Early Breast Cancer Patients A Retrospective Study Based on the Chinese National Cancer Database. SanAntonio: SABCS abstract, 2024: P3-12-09.
[3] Li Q, Jiang MX, Liu JX, et al. Clinicopathologic Features, Adjuvant Treatment Patterns and Clinical Outcomes of HR+/HER2- Early Breast Cancer in China. 2025 SGBCC abstract, P265.
[4]Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2024; 74: 229–263.
[5]Harbeck N, Penault-Llorca F, Cortes J, et al. Breast cancer. Nat Rev Dis Primers 2019; 5: 66.
[6]Howlader N, Altekruse SF, Li CI, et al. US incidence of breast cancer subtypes defined by joint hormone receptor and HER2 status. J Natl Cancer Inst 2014; 106: dju055.
[7]Loibl S, André F, Bachelot T, et al. Early breast cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol 2024; 35: 159–182.
[8]Early Breast Cancer Trialists’ Collaborative Group (EBCTCG); Peto R, Davies C, Godwin J, et al. Comparisons between different polychemotherapy regimens for early breast cancer: meta-analyses of long-term outcome among 100,000 women in 123 randomised trials. Lancet 2012; 379: 432–444.
[9]Early Breast Cancer Trialists’ Collaborative Group (EBCTCG); Braybrooke J, Bradley R, Gray R, et al. Anthracycline-containing and taxane-containing chemotherapy for early-stage operable breast cancer: a patient-level meta-analysis of 100 000 women from 86 randomised trials. Lancet 2023; 401: 1277–1292.
[10]Early Breast Cancer Trialists’ Collaborative Group (EBCTCG); Gray R, Bradley R, Braybrooke J, et al. Increasing the dose intensity of chemotherapy by more frequent administration or sequential scheduling: a patient-level meta-analysis of 37 298 women with early breast cancer in 26 randomised trials. Lancet 2019; 393: 1440–1452.
[11]. Early Breast Cancer Trialists’ Collaborative Group (EBCTCG). Aromatase inhibitors versus tamoxifen in early breast cancer: patient-level meta-analysis of the randomised trials. Lancet 2015; 386: 1341–1352.
[12]Bradley R, Braybrooke J, Gray R, et al. Aromatase inhibitors versus tamoxifen in premenopausal women with oestrogen receptor-positive early-stage breast cancer treated with ovarian suppression: a patient-level meta-analysis of 7030 women from four randomised trials. Lancet Oncol 2022; 23: 382–392.
[13] Pan H, Gray R, Braybrooke J, et al. 20-year risks of breast-cancer recurrence after stopping endocrine therapy at 5 years. N Engl J Med 2017; 377: 1836–1846.
[14]Gomis RR, Gawrzak S. Tumor cell dormancy. Mol Oncol 2017; 11: 62–78.
[15]Pedersen RN, Esen BÖ, Mellemkjær L, et al. The incidence of breast cancer recurrence 10–32 years after primary diagnosis. J Natl Cancer Inst 2022; 114: 391–399.
[16]O’Shaughnessy J, Yardley D, Hart L, et al. Abstract P3-03-12: risk of recurrence with adjuvant endocrine therapy in real world patients with hormone receptor positive/human epidermal growth factor receptor-negative early breast cancer: a US database analysis. Cancer Res 2023; 83: P3-03-12.
[17]Gnant M, Fitzal F, Rinnerthaler G, et al. Duration of adjuvant aromatase-inhibitor therapy in postmenopausal breast cancer. N Engl J Med 2021; 385: 395–405.
[18]Del Mastro L, Mansutti M, Bisagni G, et al. Extended therapy with letrozole as adjuvant treatment of postmenopausal patients with early-stage breast cancer: a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol 2021; 22: 1458–1467.
[19]Mamounas EP, Bandos H, Lembersky BC, et al. Use of letrozole after aromatase inhibitor-based therapy in postmenopausal breast cancer (NRG Oncology/NSABP B-42): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2019; 20: 88–99.
[20]Blok EJ, Kroep JR, Meershoek-Klein Kranenbarg E, et al. Optimal duration of extended adjuvant endocrine therapy for early breast cancer; results of the IDEAL trial (BOOG 2006-05). J Natl Cancer Inst 2018; 110: 40–48.
[21]Goss PE, Ingle JN, Pritchard KI, et al. Extending aromatase-inhibitor adjuvant therapy to 10 years. N Engl J Med 2016; 375: 209–219.
审批码:KIS0044387
排版编辑:肿瘤资讯-CYX











 苏公网安备32059002004080号
苏公网安备32059002004080号


