慢性淋巴细胞白血病(CLL)是一种以CD5+B细胞克隆性增殖为特征的B细胞血液恶性肿瘤,主要发生于老年人,诊断时的中位年龄大于70岁。2019年全球CLL新发病例的估计发病率为1.34例/10万人,与美国或欧洲相比,亚洲国家CLL的发病率约低5至10倍。在美国和欧洲等西方国家定居的亚洲人患CLL的风险没有增加,说明遗传因素在CLL易感性中起主要作用,而非环境因素。
在过去的十年中,慢性淋巴细胞白血病的疾病生物学和新型靶向治疗取得显著进展。随机临床试验证实,与免疫化疗相比,靶向治疗可改善无进展生存期和总生存期,因此免疫化疗在当今时代治疗CLL中的作用有限。BTK抑制剂、BCL2抑制剂和CD20单抗是CLL患者的合理治疗选择,无论是作为一线治疗还是治疗复发或难治性CLL。多项进行中的3期试验正在探索不同的靶向治疗组合,其结果可能会改变CLL一线治疗的框架。非共价BTK抑制剂、CAR-T细胞疗法和其他治疗策略也在复发性CLL中探索。用于复发性CLL的治疗方法,如非共价BTK抑制剂,也在早期治疗中进行探索,包括一线治疗。
柳叶刀杂志近日发表综述,阐述了慢性淋巴细胞白血病的诊断、基因组学、临床特征和治疗。现整理如下:

诊断和鉴别诊断
CLL的诊断需要外周血单克隆B淋巴细胞 ≥ 5x109/L。CLL细胞同时表达B细胞抗原CD19和CD5,也表达CD23、CD200和CD43。CLL中 B 细胞表面表达的IgM或IgD和CD20的特征性地低于正常B细胞表达。CLL细胞不表达CD10,FMC7和 CD79b 通常为阴性或弱表达。对于大多数患者,通过外周血流式细胞术可以确定CLL的诊断,而不需要骨髓或淋巴结活检。
约5~10%的CLL患者主要表现为基于淋巴结的病变,如果外周血中克隆性B淋巴细胞低于5x109/L且无血细胞减少,则称为小淋巴细胞淋巴瘤(SLL)。诊断为SLL的患者可在疾病进展时维持诊断或随时间推移发展为CLL。克隆性B细胞免疫表型与CLL一致、克隆性B细胞计数<5x109/L且无血细胞减少、淋巴结肿大或器官肿大的患者归单克隆B细胞增多症。在一般人群中,单克隆B细胞增多症的发生率高达5~12%,而在CLL患者的亲属中高达22%。单克隆B细胞增多症与进展为CLL的风险增加、感染风险增加和继发性恶性肿瘤风险增加相关。在CLL、SLL和单克隆B细胞增多症患者中均可观察到克隆性B细胞骨髓受累,因此不能用于区分三种疾病。
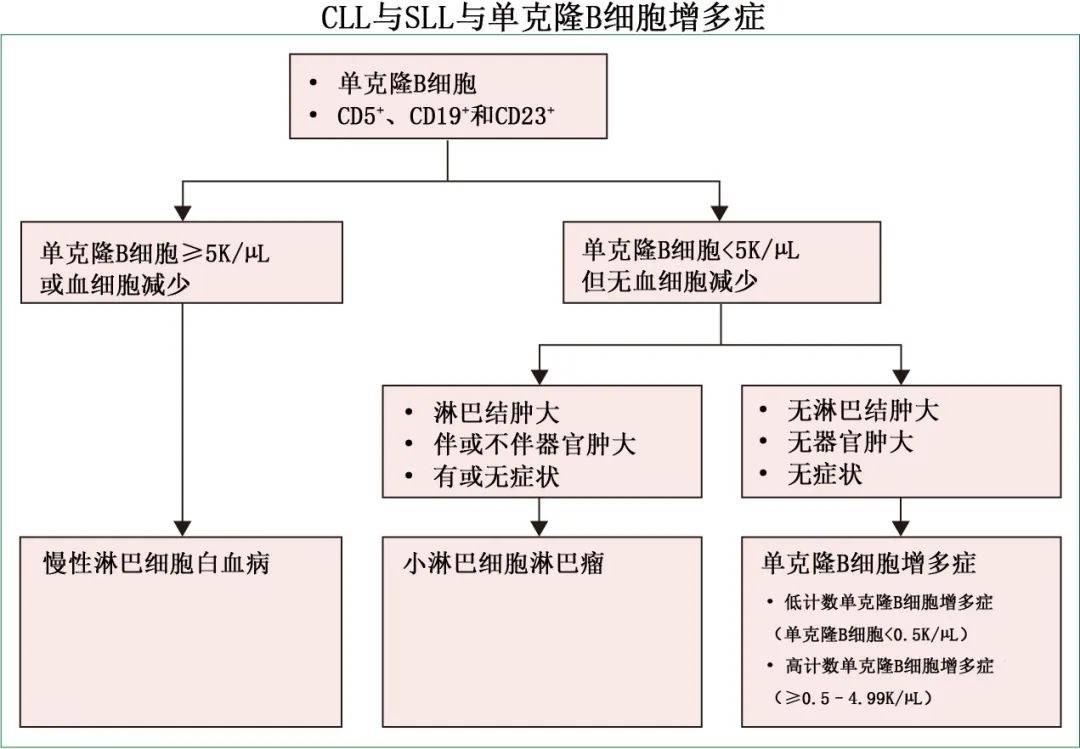
鉴别CLL和套细胞淋巴瘤很重要,因为 CD5 在两种疾病中均有表达。但与 CLL不同,套细胞淋巴瘤细胞通常为FMC7阳性、CD23和CD200阴性、CD20表达较高、表面IgM或IgD强表达。此外,存在t(11;14) 易位、cyclin D1染色阳性或两者则提示为套细胞淋巴瘤。
基因组学
在CLL患者中发现了多种临床相关的基因组改变,其中许多是CLL开始治疗前的重要检测项目,例如IGHV基因突变状态、CLL FISH异常和TP53突变。IGHV基因突变评估将患者分为 IGHV未突变CLL(与生殖细胞系的同源性≥98%)与IGHV突变CLL(与生殖细胞系的同源性<98%)。IGHV突变克隆的生长速度倾向于比IGHV未突变克隆慢,并且与IGHV未突变CLL相比,免疫化疗后的结局更优。对于IGHV突变与IGHV 未突变CLL,连续BTK抑制剂治疗的长期预后似乎相似;但接受有限期维奈克拉–CD20单抗治疗的IGHV突变CLL患者的长期结局似乎优于IGHV未突变CLL患者。CLL FISH检测将患者分为del(17p)、del(11q)、12号染色体三体、del(13q) 和正常FISH。采用免疫化疗时,del(17p) 患者疗效最差,而孤立性 del(13q) 患者疗效最佳。然而对于新型靶向治疗,与其他 FISH 亚组相比,仅 del(17p) 与较差结局相关。TP53突变可与del(17p)同时发生,也可在无 del(17p)时发生。大多数(但不是全部)研究表明,del(17p) 或TP53突变的存在对临床结局具有相似的负面影响。关于TP53双等位基因功能丧失(同时携带 del(17p)和TP53 突变或两种不同TP53 突变)是否比单一畸变预后更差,相关数据存在矛盾。
临床特征
大多数人患者因偶然发现白细胞升高或淋巴细胞升高而诊断CLL,部分患者可以因为偶然发现淋巴结无痛性肿大就诊。疾病早期大多数患者无症状,随着时间的推移可能出现 B 症状(例如发热、盗汗和体重减轻)和疲乏加重。进行性淋巴结肿大或器官肿大可能导致不适。贫血和血小板减少症恶化可导致劳力性呼吸困难和出血并发症,但大出血罕见。部分CLL 患者表现为或发生进行性低丙球蛋白血症,大多数低丙种球蛋白血症患者不需要任何特殊干预。低丙球蛋白血症患者可发生频繁感染,尤其是上呼吸道感染和肺炎。对于低丙种球蛋白血症(通常IgG<500 mg/dL)和重度感染患者(例如需要住院或反复感染损害生活质量的患者),建议给予免疫球蛋白替代治疗。
CLL患者也可能发生自身免疫性并发症,最常见的是自身免疫性溶血性贫血和免疫性血小板减少症。建议对所有CLL患者进行适合年龄的癌症筛查。
治疗
大多数诊断为CLL的患者在诊断时不需要治疗,可接受积极观察(观察等待)。在积极观察过程中,大多数患者可接受连续监测,每3-6个月收集病史、体格检查和全血细胞计数评估。慢性淋巴细胞白血病国际研讨会(iwCLL)建立了开始 CLL 治疗的指征,最常见的指征包括进行性骨髓衰竭(血红蛋白<10mg/dL且血小板计数<100×109/L);大量(最长直径 ≥ 10 cm)或进行性或症状性淋巴结病;巨脾(如左肋缘下>6cm)或进行性或有症状的脾大;有临床意义的 CLL 症状影响生活质量;症状性结外受累;自身免疫性溶血性贫血和/或血小板减少对皮质类固醇或其他标准治疗反应不佳。
iwCLL 指南还指出,进行性淋巴细胞增多(2个月内增多≥50%或淋巴细胞倍增时间<6个月)也是治疗的指征。但作者认为,除非伴有其他治疗开始的标准,否则不应单独使用进行性淋巴细胞增多的标准开始 CLL 治疗。此外,白细胞计数可因并发疾病或使用类固醇而发生一过性增加,应纳入决策。淋巴细胞绝对值显著升高(例如>400×109/L)且无其他治疗指征时,建议以较低的启动治疗阈值进行密切监测;鉴于淋巴细胞计数大幅升高可能使靶向治疗的开始更具挑战性(例如毒性更大且需要住院),因此作者认为该建议适用于临床管理。对于贫血患者,应排除 CLL 以外的其他贫血原因,如缺铁性贫血、非免疫性溶血性贫血或骨髓增生异常综合征。部分患者,尤其是IGHV突变CLL患者,可表现为血小板计数缓慢下降,血小板计数可在70~100×109/L范围内随时间推移保持稳定,无任何其他治疗指征;这些患者可继续观察。
Rai和Binet用于CLL的临床分期,两个系统都依赖于常见的实验室参数和体格检查,并且不需要影像学。最近的CLL国际预后指数(CLL-IPI)是使用约3400例患者的患者水平数据所确定的,其中5个因素与较差的生存期独立相关:存在del(17p)或突变TP53;IGHV-未突变CLL;β2微球蛋白水平>3.5mg/L;临床分期(Rai I–IV或Binet B–C);年龄>65岁。需要注意的是,这些分期系统来源于免疫化疗时代的患者数据,在新型靶向治疗时代的效用仍有待确定,总的来说,这些分期系统在常规临床实践中的应用有限。
对于不符合 iwCLL 治疗标准的患者,免疫化疗和伊布替尼早期治疗均未显示获益。进行中的试验(如SWOG S1925)正在探索维奈克拉为基础的治疗用于疾病进展高风险患者的早期干预,主要终点为总生存期。目前的建议是,对于不符合iwCLL治疗标准的患者应继续观察,即使他们早期疾病进展的风险更高;尤其是del(17p)或TP53突变伴IGHV突变患者至首次治疗的时间更长。CLL1-PM、CLL-IPI和IPS-E等模型可用于预测至首次治疗的时间。
一线治疗
直到最近几年,免疫化疗一直是CLL患者的标准一线治疗,但也一直在发展,从几十年前的烷化剂、到嘌呤类似物,再到20世纪90年代的CD20 单抗,再到免疫化疗联合方案(如氟达拉滨、环磷酰胺和利妥昔单抗;苯达莫司汀和利妥昔单抗;苯丁酸氮芥和奥妥珠单抗)。对于没有显著合并症的年轻患者(一般为<65岁),氟达拉滨、环磷酰胺和利妥昔单抗曾是标准治疗。而老年患者(一般为≥65岁)一般适合苯达莫司汀和利妥昔单抗或苯丁酸氮芥和奥妥珠单抗。
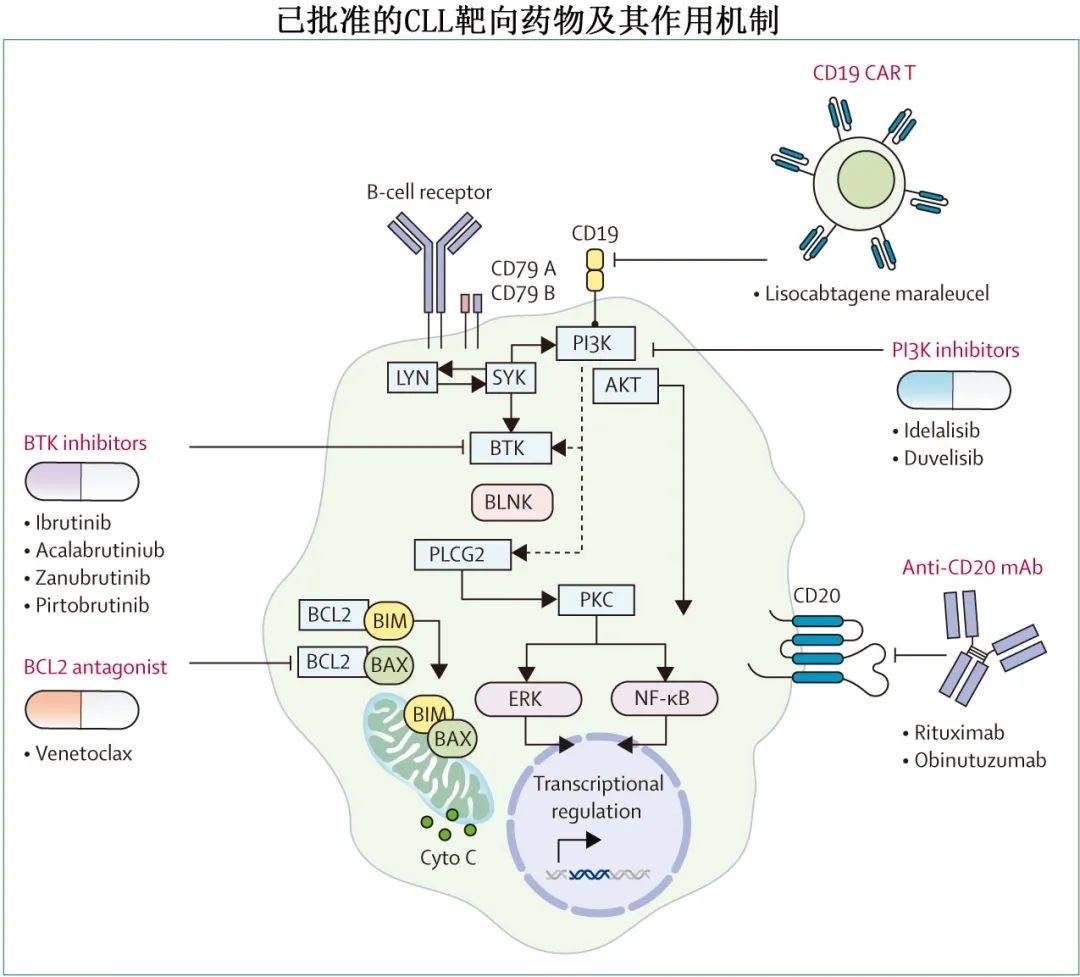
随着靶向药物的出现,免疫化疗逐步被靶向治疗所取代,多个随机研究证实一线和复发难治性CLL中靶向治疗具有更优的无进展生存期和总生存期。
多种靶向药物已获批用于一线治疗,包括共价BTK抑制剂,如伊布替尼、阿可替尼和泽布替尼,以及国内上市的奥布替尼;BCL2抑制剂,如维奈克拉;以及CD20单抗,如利妥昔单抗和奥妥珠单抗。伊布替尼是首个被美国食品药品管理局批准用于 CLL 患者的共价 BTK 抑制剂,2014年2月获批用于复发或难治性CLL,2016年3月获批用于CLL的一线治疗。伊布替尼治疗后大多数患者达到部分缓解,而完全缓解不太常见,达到残留病灶无法测量(U-MRD)的情况罕见。大多数接受BTK抑制剂(如伊布替尼)的患者在治疗开始后不久,由于CLL细胞从淋巴结和其他部位重新分布至外周血(淋巴细胞增多症再分布),导致淋巴细胞绝对计数增加(有时是治疗前淋巴细胞计数的数倍)。淋巴细胞计数升高不会对治疗的总体反应产生不良影响,大多数患者在继续接受BTK抑制剂治疗后随时间推移可消退,无需进行任何额外干预。伊布替尼的常见不良反应包括关节痛或肌痛、容易瘀伤、腹泻、皮肤和指甲变化、房颤、出血和高血压。
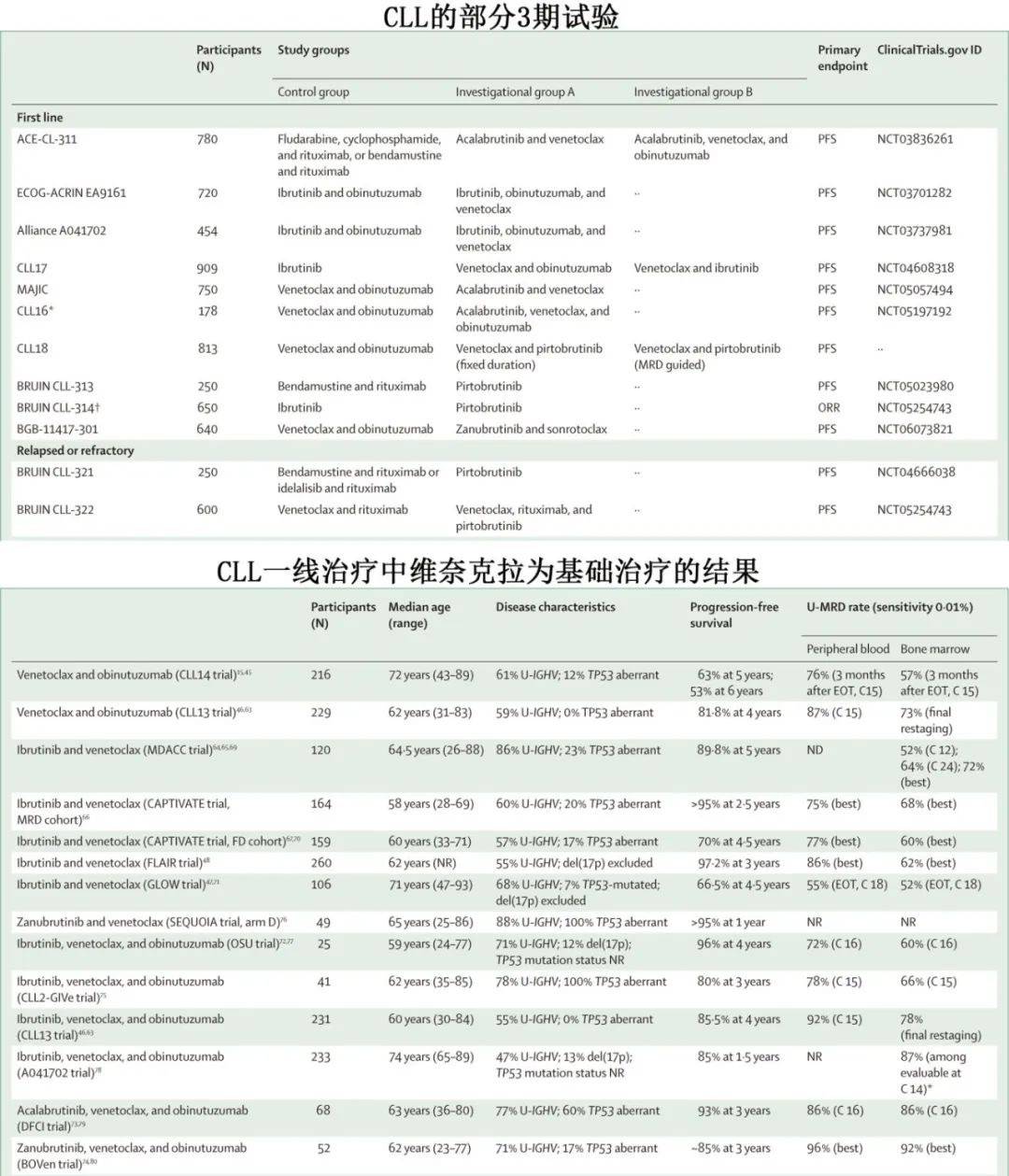
在RESONATE-2试验中,符合iwCLL治疗指征的 ≥ 65岁既往未经治疗的CLL患者随机分配接受连续伊布替尼治疗(n=136;中位年龄73岁)或12个周期苯丁酸氮芥治疗(n=133;中位年龄72岁)。伊布替尼组中位随访7.4年后,136例患者中57例 (42%) 仍在治疗,32例 (24%) 因不良事件停用伊布替尼,18例 (13%) 因疾病进展停用伊布替尼。最佳反应方面,34%的患者获得完全缓解或完全缓解伴血细胞计数不完全恢复,59%获得部分缓解或部分缓解伴淋巴细胞增多。伊布替尼组7年无进展生存率为59%,与IGHV基因突变状态无关。
RESONATE-2试验中两组均无CD20单抗;iLLUMINATE试验纳入老年CLL患者,患者随机分配接受连续伊布替尼+6个周期奥妥珠单抗(n=113;中位数年龄70岁)或6个周期苯丁酸氮芥+奥妥珠单抗(n=116;中值年龄72岁);伊布替尼+奥妥珠单抗组的3.5年无进展生存率为74%,而苯丁酸氮芥+奥妥珠单抗组为33%。与伊布替尼单药治疗后 U-MRD 罕见有所不同,在 iLLUMINATE 试验中接受伊布替尼+奥妥珠单抗治疗的患者中,外周血和骨髓瘤U-MRD率分别为33%和25%(灵敏度0.01%)。尽管改善了U-MRD,但iLLUMINATE 试验中的伊布替尼+奥妥珠单抗组与 RESONATE-2 试验中的伊布替尼组无进展生存期相似,但需要注意的是iLLUMINATE试验中高危患者更多。目前尚无比较伊布替尼联合或不联合奥妥珠单抗的随机数据,根据作者临床实践,使用伊布替尼单药治疗而不添加 CD20 单抗。
在 Alliance A041202 试验中,≥ 65岁且需要治疗的CLL患者随机分配接受苯达莫司汀+利妥昔单抗(n=183)、伊布替尼(n=182)或伊布替尼+利妥昔单抗(n=182)。两个伊布替尼组的无进展生存期均优于苯达莫司汀+利妥昔单抗组;但无进展生存期获益仅限于IGHV未突变CLL患者,而IGHV突变CLL患者之间无差异。与伊布替尼单药相比,伊布替尼+利妥昔单抗未改善无进展生存期。
ECOG E1912试验纳入年龄 ≤ 70岁且可耐受氟达拉滨、环磷酰胺和利妥昔单抗的CLL患者,患者随机分配接受6个周期的氟达拉滨+环磷酰胺+利妥昔单抗(n=158)或连续伊布替尼+6个周期利妥昔单抗(n=352)。与氟达拉滨+环磷酰胺+利妥昔单抗相比,接受伊布替尼+利妥昔单抗的患者无进展生存期改善,且IGHV未突变CLL和IGHV突变CLL患者均有改善;总生存期也更优,但两组均很少发生死亡。与E1912试验相似,在英国进行的 FLAIR 试验中,患者随机分配接受6个周期的氟达拉滨+环磷酰胺+利妥昔单抗(n=385)或连续伊布替尼+6个周期利妥昔单抗(n=386)。与E1912试验不同,在FLAIR试验中,伊布替尼+利妥昔单抗相对于氟达拉滨+环磷酰胺+利妥昔单抗的无进展生存期获益仅见于IGHV未突变CLL患者,此外无总生存期获益。
二代共价BTK抑制剂(如阿可替尼和泽布替尼)的选择性更强且在复发或难治性 CLL 的头对头试验中不良事件更少。III期试验ELEVATE-TN在CLL的一线治疗中比较了连续阿可替尼单药治疗(n=179;中位年龄70岁)、连续阿可替尼+6个周期奥妥珠单抗(n=179;中位年龄70岁)、6个周期苯丁酸氮芥+奥妥珠单抗(n=177;中位年龄71岁)。73例患者(14%)携带 del(17p)或TP53突变,337例(63%)IGHV未突变。随访6年时,阿可替尼+奥妥珠单抗组的无进展生存率为78%,阿可替尼单药组为62%,苯丁酸氮芥+奥妥珠单抗组为17%。含阿可替尼两组与苯丁酸氮芥+奥妥珠单抗相比均具有无进展生存期优势。值得注意的是,阿可替尼+奥妥珠单抗与阿可替尼单药治疗相比无进展生存期改善(风险比[HR]=0.58,P=0.02)。添加奥妥珠单抗会增加输液反应,增加骨髓抑制的风险,需要注意的是,携带del(17p)或TP53突变CLL的少数高危患者接受奥妥珠单抗联合阿可替尼治疗无获益。
在CLL的一线治疗中,3期SEQUOIA试验比较了泽布替尼单药治疗(n=241;中位年龄70岁)与苯达莫司汀+利妥昔单抗(n=238;中位年龄70岁),排除del(17p) CLL患者;28/455例(6%)患者携带TP53 突变,246/465例(53%)患者为 IGHV 未突变。泽布替尼组的3.5年无进展生存率优于苯达莫司汀+利妥昔单抗组(82.4% vs 50%;P<0.001),且IGHV未突变CLL和IGHV突变CLL均显著改善。
12个周期的维奈克拉联合6个周期的奥妥珠单抗为CLL的一线治疗提供了一种为期1年的有限期治疗。3期 CLL14 试验中,CLL 患者随机分配接受维奈克拉+奥妥珠单抗(n=216;中位年龄72岁)或12个周期苯丁酸氮芥+6个周期奥妥珠单抗(n=216;中位年龄71岁)。417例患者中有49例(12%)携带 del(17p)或TP53突变CLL,408例患者中有244例(60%)为IGHV未突变CLL。治疗结束后约3个月,维奈克拉+奥妥珠单抗外周血和骨髓U-MRD(灵敏度0.01%)缓解率分别为76%和57%。治疗开始后6年,维奈克拉+奥妥珠单抗组的无进展生存率为53.1%,而苯丁酸氮芥+奥妥珠单抗组为21.7%(HR=0.35,P<0.0001)。值得注意的是,对于维奈克拉+奥妥珠单抗组,IGHV 突变CLL的6年无进展生存率优于IGHV 未突变CLL(70% vs 45%)。治疗1年结束时的U-MRD可预测无进展生存期和总生存期延长。在 CLL13 试验中,926例既往未经治疗的CLL患者随机分配接受免疫化疗(≤ 65岁的患者接受氟达拉滨、环磷酰胺和利妥昔单抗,> 65岁的患者接受苯达莫司汀和利妥昔单抗)或维奈克拉+利妥昔单抗、维奈克拉+奥妥珠单抗、维奈克拉+奥妥珠单抗+伊布替尼。中位年龄为60-62岁,取决于患者随机分配到哪个组;排除携带 del(17p)或TP53突变CLL的患者。与免疫化疗和维奈克拉+利妥昔单抗组相比,维奈克拉+奥妥珠单抗(联合或不联合伊布替尼)的 U-MRD 率和4年无进展生存率更高。
在过去十年中,伊布替尼联合维奈克拉的全口服有限期方案得到越来越多的研究,并且最近获批作为CLL患者的一线治疗。在MD安德森癌症中心(MDACC)的一项试验中,伊布替尼联合维奈克拉治疗24个周期,对于持续性骨髓MRD(灵敏度0.01%)患者给予12个额外周期的联合治疗。120例患者(中位年龄64.5岁)接受治疗。该试验优先入组具有高危基因组特征的患者,因此116例患者中的100例(86%)为IGHV未突变CLL,27/120例 (23%)患者携带del(17p)或TP53突变。120例患者中的86例(72%)最佳缓解为骨髓U-MRD(灵敏度0.01%),5年无进展生存率为89.8%。CAPTIVATE试验中报告了类似结果,其中中位年龄约为60岁的患者分配接受12个周期的伊布替尼+维奈克拉(固定持续时间队列)或 MRD 驱动治疗,即在第12周期后给予额外治疗,具体取决于 MRD 状态(MRD队列)。在两个队列中,约75%的患者获得外周血U-MRD(灵敏度0.01%),固定持续时间队列的4.5年无进展生存率为70%。在最近报告的UK FLAIR 试验中,患者随机分配接受氟达拉滨+环磷酰胺+利妥昔单抗(n=263)与伊布替尼+维奈克拉(n=260);伊布替尼+维奈克拉的持续时间为 MRD 指导,范围为2年至6年。伊布替尼+维奈克拉组的3年无进展生存率为97.2%,而氟达拉滨+环磷酰胺+利妥昔单抗组为76.8%(HR=0.13,P<0.001);伊布替尼+维奈克拉组的总生存期也显著改善(P<0.005)。GLOW 试验评价了伊布替尼+维奈克拉对比苯丁酸氮芥+奥妥珠单抗。值得注意的是,GLOW试验中的患者年龄(中位年龄71岁)大于MDACC(中位年龄64.5岁)和CAPTIVATE(中位年龄58-60岁)。伊布替尼+维奈克拉组的4.5年无进展生存率优于苯丁酸氮芥+奥妥珠单抗(66.5% vs 19.5%;P < 0.0001)。
多项试验正在研究BTK抑制剂联合维奈克拉和奥妥珠单抗的三联方案治疗CLL患者。所有获批的共价BTK抑制剂(例如伊布替尼、阿可替尼和泽布替尼)联合维奈克拉和奥妥珠单抗的U-MRD缓解率均较高。几项正在进行的 III 期试验正在以随机方式评价这些联合治疗;目前三联方案仍在研究中,此外三联方案是否优于两联方案或单药治疗仍有待观察。
1. TP53异常CLL的一线治疗
在34例既往未经治疗的TP53异常CLL患者中报告了伊布替尼单药治疗的长期疗效,6年无进展生存率为61%。其他几项研究也报告了BTK联合或不联合CD20单抗在TP53异常CLL患者中的良好长期疗效。
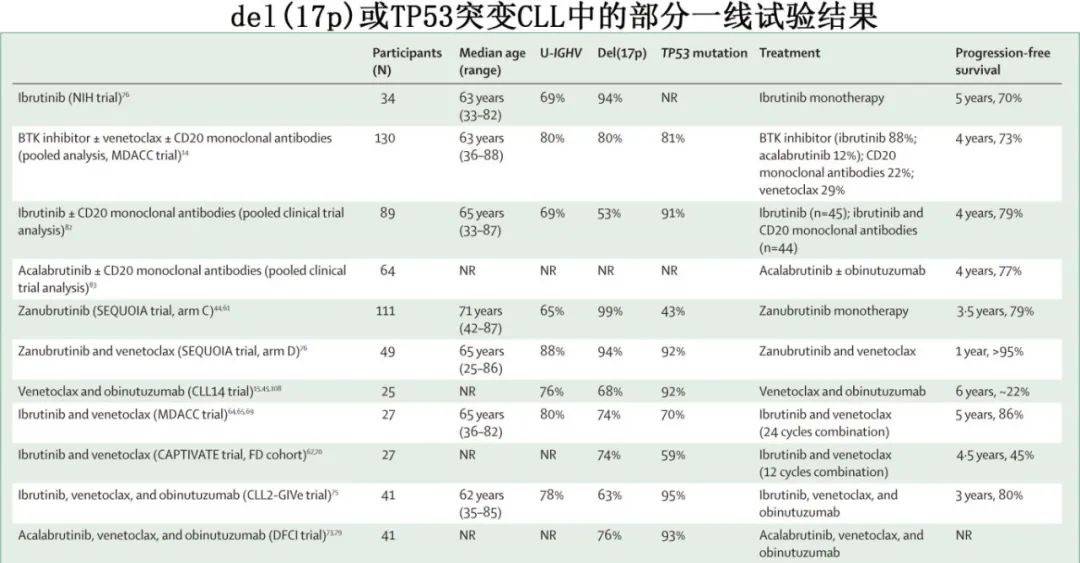
在一线TP53异常CLL的最大样本之一前瞻性试验中,111例患者接受连续泽布替尼单药治疗,3.5年无进展生存率为79.4%。值得注意的是,在CLL14试验中,12个周期维奈克拉+6个周期奥妥珠单抗报告TP53异常CLL的5年无进展生存率仅为41%。多项试验正在研究BTK抑制剂联合维奈克拉联合或不联合奥妥珠单抗作为 TP53 异常 CLL 患者的有限期治疗。在CLL2-GIVe试验中,41例既往未经治疗的TP53异常CLL患者接受伊布替尼+维奈克拉+奥妥珠单抗。在第15周期后,66%的患者达到骨髓U-MRD缓解(灵敏度0.01%),3年无进展生存率为79.9%。还需要对这些试验进行更长时间的随访,以确定对于TP53异常CLL,BTK抑制剂联合维奈克拉为基础的治疗是否优于BTK抑制剂单药。
2. 免疫化疗在一线治疗中的作用
尽管免疫化疗在CLL中的应用大幅下降,但在氟达拉滨+环磷酰胺+利妥昔单抗治疗后,IGHV突变CLL患者仍可获得长期缓解并可能治愈。在MDACC一项试验中,IGHV突变 CLL患者中约48%在氟达拉滨+环磷酰胺+利妥昔单抗一线治疗后15年持续缓解。多项试验研究了伊布替尼联合免疫化疗作为CLL一线治疗。一项仅针对化疗敏感亚组(IGHV突变且无del[17p]或TP53突变的CLL)的试验联合使用12个周期的伊布替尼与3个周期的氟达拉滨和环磷酰胺,然后(取决于患者反应)6或12个周期的奥妥珠单抗(iFCG方案),结果骨髓U-MRD缓解率(灵敏度0.01%)为98%,6年无进展生存率为89.2%。然而考虑到免疫化疗的潜在毒性,包括治疗相关骨髓增生异常综合征或急性髓系白血病的风险,作者不推荐化学免疫治疗,即使是IGHV突变CLL患者,除非存在靶向治疗可及性或成本的问题。
3.一线治疗的选择
CLL一线靶向治疗的选择介于连续BTK抑制剂和有限期维奈克拉联合奥妥珠单抗之间,两方案各有利弊。单药BTK抑制剂更容易开始治疗,肿瘤溶解综合征的风险小,不需要静脉输注;但BTK抑制剂推荐持续治疗直至进展,并且存在BTK抑制剂相关不良事件。虽然并非禁忌,但在冠状动脉疾病、未控制的心房颤动或需要长期抗凝治疗的患者中使用BTK抑制剂时应谨慎。以维奈克拉为基础的治疗提供了一种有限期方案,但患者需要密切监测肿瘤溶解综合征,此外约50%的患者可发生3-4级中性粒细胞减少症;淋巴结显著肿大和肾功能不全患者发生肿瘤溶解综合征的风险增加。可为患者提供两种治疗方法,并根据患者的偏好做出治疗决定。
如前所述,某些合并症的存在可能意味着一种方案优于另一种方案。值得注意的是,对于TP53异常CLL患者,维奈克拉和奥妥珠单抗的长期缓解不佳,而持续BTK抑制剂治疗是目前的首选方案。由于二代BTK抑制剂(如阿可替尼和泽布替尼)与伊布替尼相比具有更好的安全性,作者更倾向于二代BTK抑制剂。鉴于伊布替尼和维奈克拉都是口服药物,在后勤管理上更容易。此外,在维奈克拉开始前几个月使用伊布替尼可降低肿瘤溶解综合征的风险。BTK抑制剂联合维奈克拉的最新数据显示,在所有基因组亚组中,U-MRD缓解率都很高;但这些试验随访时间相对较短,无法判断长期持久性,特别是对于TP53异常CLL患者。一些正在进行的试验正在研究二代BTK抑制剂联合BCL2抑制剂(联合或不联合奥妥珠单抗),这些试验的长期结果值得期待。不建议CLL患者使用免疫化疗,但在资源有限的情况下(例如新型靶向治疗无法获得或负担不起),可以考虑免疫化疗,特别是对于没有del(17p)或TP53突变的IGHV突变CLL患者。
复发难治性CLL的治疗
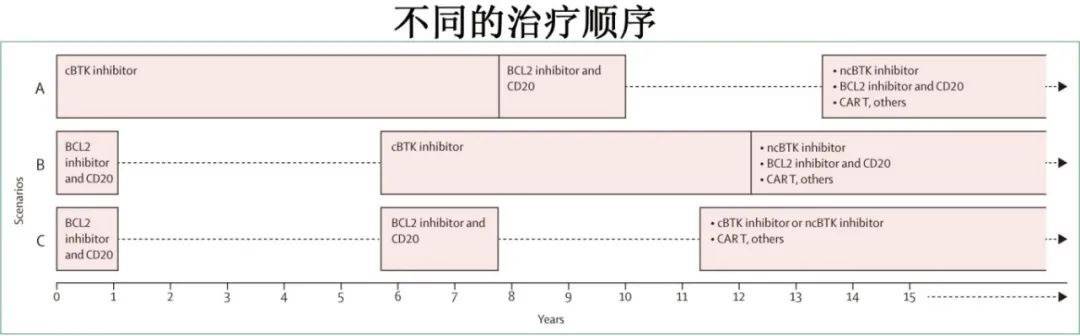
复发或难治性CLL的治疗选择在很大程度上取决于患者以前接受的治疗,应评估患者是在接受治疗时复发(如BTK抑制剂治疗时进展)还是在停止治疗后疾病进展(如在完成有限期维奈克拉治疗后进展,或由于不良事件或医学并发症而中断BTK抑制剂后进展)。应注意的是,单纯疾病复发的证据(如绝对淋巴细胞计数上升或小体积淋巴结肿大)并非开始治疗复发疾病的指征;复发或难治性CLL患者在开始治疗前也应符合iwCLL治疗指征。在BTK抑制剂治疗期间出现疾病进展迹象的患者,如果突然停用BTK抑制剂,可能会出现疾病快速燃瘤(flare);对于这类患者,建议将BTK抑制剂与后线治疗重叠使用。下图描述了几种潜在的治疗顺序方案;其中部分顺序选择的临床试验数据尚未获得,随着CLL治疗的不断发展,可以展望其他的治疗顺序选择。该图一个重要特征在于提供了超过10年的治疗选择的时间表,可以意味着CLL治疗的成功。
基于RESONATE试验,伊布替尼最初获批用于复发或难治性CLL,复发或难治性CLL患者随机分配接受伊布替尼和奥法妥木单抗(ofatumumab)。伊布替尼组患者接受中位3线既往治疗;中位无进展生存期为44个月,而奥法妥木单抗为8个月。CLL患者的III期ASCEND试验中,患者随机分配接受阿可替尼或苯达莫司汀+利妥昔单抗或idelalisib+利妥昔单抗。阿可替尼在无进展生存期方面优于苯达莫司汀+利妥昔单抗及idelalisib+利妥昔单抗。最近,在一项纳入复发或难治性伴del(11q)或del(17p) CLL患者的ELEVATE-RR开放标签随机试验中,正面对比阿可替尼(n=268)与伊布替尼(n=265),主要终点为无进展生存期的非劣效性。既往中位治疗2线,中位随访40.9个月,两组无进展生存期相似(中位38.4个月;与伊布替尼相比,阿可替尼达到无进展生存期的非劣效性),与伊布替尼相比,阿可替尼的所有级别心房颤动、高血压和出血事件发生率较低。在ALPINE开放标签随机试验中,泽布替尼(n=327)也与伊布替尼(n=325)在复发或难治性CLL患者中进行了头对头比较。与ELEVATE-RR试验不同,ALPINE试验纳入所有基因组亚组。主要终点为总缓解率。既往中位治疗1线。中位随访39个月,与伊布替尼相比,泽布替尼显著改善无进展生存期:泽布替尼组的3年无进展生存率为64.9%,而伊布替尼组为54.8% (p=0.001)。与伊布替尼相比,泽布替尼组的所有级别房颤发生率较低,高血压和出血事件发生率相似。基于ELEVATERR和ALPINE试验,二代BTK抑制剂(如阿可替尼和泽布替尼)已成为治疗CLL患者首选的BTK抑制剂。
非共价BTK抑制剂(也称为可逆BTK抑制剂)不与BTK的半胱氨酸481残基结合,因此对共价BTK抑制剂产生耐药性(机制为BTK C481突变)的患者具有临床活性。Pirtobrutinib是首个获批的非共价BTK抑制剂,于2023年底在美国获批用于接受过 ≥ 2线治疗(包括BTK抑制剂和BCL2抑制剂)的CLL患者。BRUIN试验纳入247例复发或难治性CLL患者,既往都有共价BTK抑制剂暴露史(190例[77%]在既往共价BTK抑制剂治疗后进展,57例[23%]因毒性或其他原因停止使用共价BTK抑制剂),100例(41%)患者有维奈克拉暴露史,患者接受Pirtobrutinib单药治疗。患者重度经治,既往中位3线治疗,大多数患者具有高危基因组学(85%为IGHV未突变CLL, 47%携带del[17p]或TP53突变)。总缓解率为82%,中位无进展生存期为19.6个月。在既往接受过共价BTK抑制剂和维奈克拉的患者中(n=100),既往中位治疗5线,总缓解率为79%,中位无进展生存期为16.8个月。此外缓解率与BTK C481突变无关。
维奈克拉治疗复发或难治性CLL的3期MURANO试验中,患者随机分配到苯达莫司汀+利妥昔单抗组与维奈克拉+利妥昔单抗2年有限期治疗组。既往中位治疗为1线。维奈克拉+利妥昔单抗的无进展生存期和总生存期均显著优于苯达莫司汀+利妥昔单抗。在维奈克拉+利妥昔单抗组,与IGHV突变CLL相比,IGHV未突变CLL患者的无进展生存期显著缩短(5年无进展生存率分别为29%和73%,P<0.001)。
PI3K抑制剂(如idelalisib和duvelisib)已获批用于治疗复发或难治性CLL。总的来说,在交叉试验比较中,与BTK抑制剂和维奈克拉相比,PI3K抑制剂在复发或难治性CLL中的疗效似乎更低,部分原因是由于PI3K抑制剂由于毒性而早期停药。此外,在ASCEND试验中,阿可替尼优于idelalisib联合利妥昔单抗。PI3K抑制剂与免疫介导的不良事件相关,如结肠炎和转氨酶升高,患者应密切监测这些并发症,此外感染并发症风险也较高。在临床实践中,PI3K抑制剂在BTK抑制剂和维奈克拉难治性或不耐受的患者中有一定作用。
CAR-T细胞疗法在多项复发或难治性CLL的临床试验中进行了评估。TRANSCEND CLL 004试验是目前在复发或难治性CLL患者中进行的最大样本试验,患者在氟达拉滨和环磷酰胺清淋预处理后接受lisocabtagene maraleucel治疗。117例患者接受了lisocabtagene maraleucel治疗,既往治疗中位数为5线,所有患者既往均接受过BTK抑制剂,94例(80%)既往接受过维奈克拉治疗。剂量水平2(100×106 CAR+ T细胞;N=87)的疗效评估患者的完全缓解率或完全缓解伴血细胞计数不完全恢复率为18%,总缓解率为47%。87例可疗效评估的患者中,外周血和骨髓U-MRD缓解率(灵敏度0.01%)分别为64%和59%。中位无进展生存期为18个月。10例(9%)患者发生3级细胞因子释放综合征(无4级或5级细胞因子释放综合征);3级神经毒性21例(18%),4级神经毒性1例(1%)。
在靶向治疗时代,异基因干细胞移植在CLL患者中的作用已经下降。作者认为,对于BTK抑制剂和维奈克拉没有反应、初次反应后复发或不耐受(所谓的双重难治性或双重暴露组)的年轻患者,应转诊异基因干细胞移植,特别是携带TP53异常的患者。
CLL或CLL靶向治疗的并发症或挑战
尽管BTK抑制剂和BCL2抑制剂治疗可取得长期缓解,但仍有许多患者最终复发。共价BTK抑制剂进展的患者携带BTK和PLCG2突变,而BCL2突变与维奈克拉耐药相关。在疾病进展时了解这些突变可能有助于选择后续的BTK抑制剂,因为在临床前模型中,共价和非共价BTK抑制剂似乎对BTK抑制剂耐药突变具有不同的敏感性。值得注意的是,并非所有患者在复发时都会发生耐药突变,表明存在其他耐药机制。接受免疫化疗(如氟达拉滨、环磷酰胺和利妥昔单抗)的患者中4~5%可发生治疗相关骨髓增生异常综合征或急性髓系白血病,这些患者预后不佳。Richter转化(最常见的是弥漫性大B细胞淋巴瘤)可发生于5~10%的CLL患者中,免疫化疗的生存期不到12个月,仍是未满足的医疗需求,特别是在弥漫性大B细胞淋巴瘤成分与CLL克隆相关的患者中。用于CLL的治疗方法,如共价BTK抑制剂、维奈克拉和非共价BTK抑制剂(如pirtobrutinib),已在临床试验中显示出对Richter转化患者的疗效。检查点抑制剂,如靶向PD1和PD-L1的检查点抑制剂,也正在Richter转化患者中研究。异基因干细胞移植仍是Richter转化患者唯一的治愈手段。
总结
在过去十年中,随着靶向治疗的发展,CLL的治疗前景发生了显著变化,这些靶向治疗在很大程度上取代了免疫化疗。目前BTK抑制剂和BCL2抑制剂仍是治疗CLL最有效的两类药物,多项随机试验证实优于免疫化疗。BTK抑制剂后BCL2抑制剂(反之亦然)、BTK联合BCL2抑制剂、三药联合(BTK抑制剂+ BCL2抑制剂+ CD20单抗),哪个方案长期结局最好的问题仍有待确定。治疗复发或难治性CLL的有效疗法(如非共价BTK抑制剂)正在早期治疗中研究,包括一线治疗。
Jain N, Wierda WG, O'Brien S.Chronic lymphocytic leukaemia.Lancet . 2024 Jul 25:S0140-6736(24)00595-6. doi: 10.1016/S0140-6736(24)00595-6.
排版编辑:肿瘤资讯-Grace











 苏公网安备32059002004080号
苏公网安备32059002004080号


