结直肠癌(CRC)是全球最常见的恶性癌症之一。根据最新版中国癌症统计报告数据显示,中国CRC的发病率、死亡率在全部恶性肿瘤中分别位居第2和第4位,其中2022年新发病例51.7万,死亡病例24万。大多数患者确诊时已发生转移,导致预后不佳。近年来,免疫疗法的深入研究为错配修复缺陷/微卫星高度不稳定(dMMR/MSI-H)晚期CRC患者带来了显著生存获益和预后改善。目前,多项免疫联合治疗的研究正在进行中,旨在进一步实现疗效升级并改善占比95%的错配修复完整/微卫星稳定(pMMR/MSS)型mCRC患者的预后,这些研究为临床实践提供了重要的循证医学支持。
《Hi Strong-消化道病例精粹》系列专栏深入剖析消化道肿瘤免疫治疗优秀临床病例,分享宝贵临床经验,以期共同推动消化道肿瘤免疫治疗学科发展,助力健康中国2030。
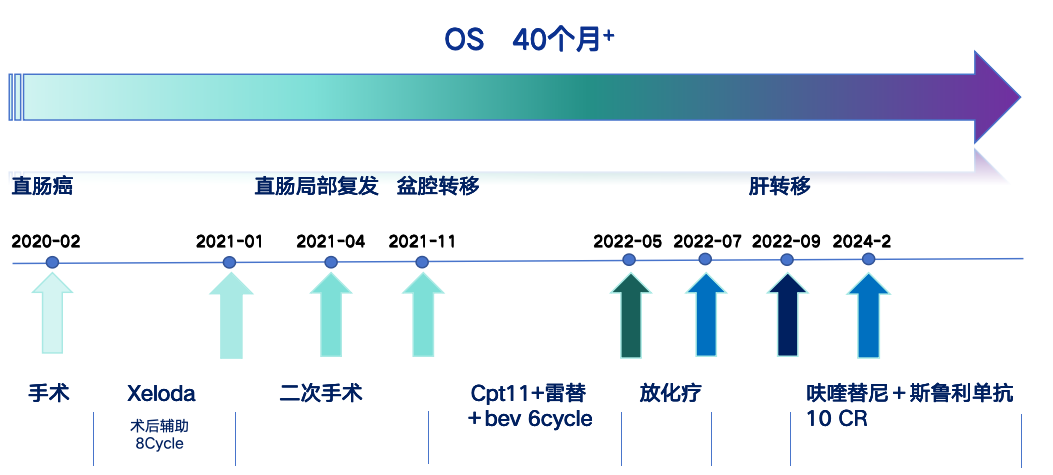
本期浙江省肿瘤医院/中国科学院大学附属肿瘤医院罗聪教授团队分享了一例晚期直肠癌患者病例。患者,男,60岁,诊断为直肠腺癌伴肝转移(IVA期),NGS基因检测提示MSS型。患者接受了斯鲁利单抗联合呋喹替尼三线治疗2周期后,疗效评价为完全缓解(CR),随后继续接受斯鲁利单抗联合呋喹替尼治疗,10周期时疗效评价为维持CR。诊疗过程中该患者的整体疗效评估持续CR已18个月以上,后续将密切随访,关注患者的病情变化。
病例作者:
国科大附属肿瘤医院肝胆胰胃内科
以第一作者发表SCI论文及中国核心期刊论文数篇
参与编撰专著2部
参与多项国家和省部级课题
病史简介
基本情况
患者,男,60岁。
主诉
直肠癌术后4年余。
现病史
2020年1月因“间断便血1年”就诊外院。肠镜、腹部增强CT、盆腔MR均提示符合直肠肿瘤表现。2020-2-16行手术治疗,术后病理:(直肠)隆起型中分化腺癌(3*3*2.5cm),pT1N1M0。术后于2020-4-18至2021-1-17行6周期XELOX化疗。2021-3-23于我院就诊,结肠镜病理提示吻合口管状腺癌。2021-4-19进行直肠癌复发根治术(Miles)+乙状结肠造口术+腹壁切口疝修补术。术后病理提示直肠中分化管状腺癌伴黏液腺癌分化(大小2*2*2cm)。术后患者拒绝治疗。2021-10-29盆腔MRI提示肿瘤复发,局部淋巴结转移。病理检测提示KRAS G12D、NRAS、PIK3CA、BRAF均为野生型,pMMR型。2021-11~2022-7患者接受化疗(伊立替康+雷替曲塞+贝伐珠单抗)序贯根治性同步放化疗。2022-9-3 我院胸腹盆增强CT提示肝右叶新出现占位性病变,考虑转移可能。2022-9-25开始接受斯鲁利单抗+呋喹替尼治疗,2周期后疗效评价CR,10周期后疗效评价维持CR。
既往疾病史
高脂血症和高尿酸血症3年,无高血压及心脏病史,无肿瘤家族史。
辅助检查
2022-9-3胸腹盆增强CT:对比之前CT检查,肝右叶新出现占位性病变,考虑转移可能。
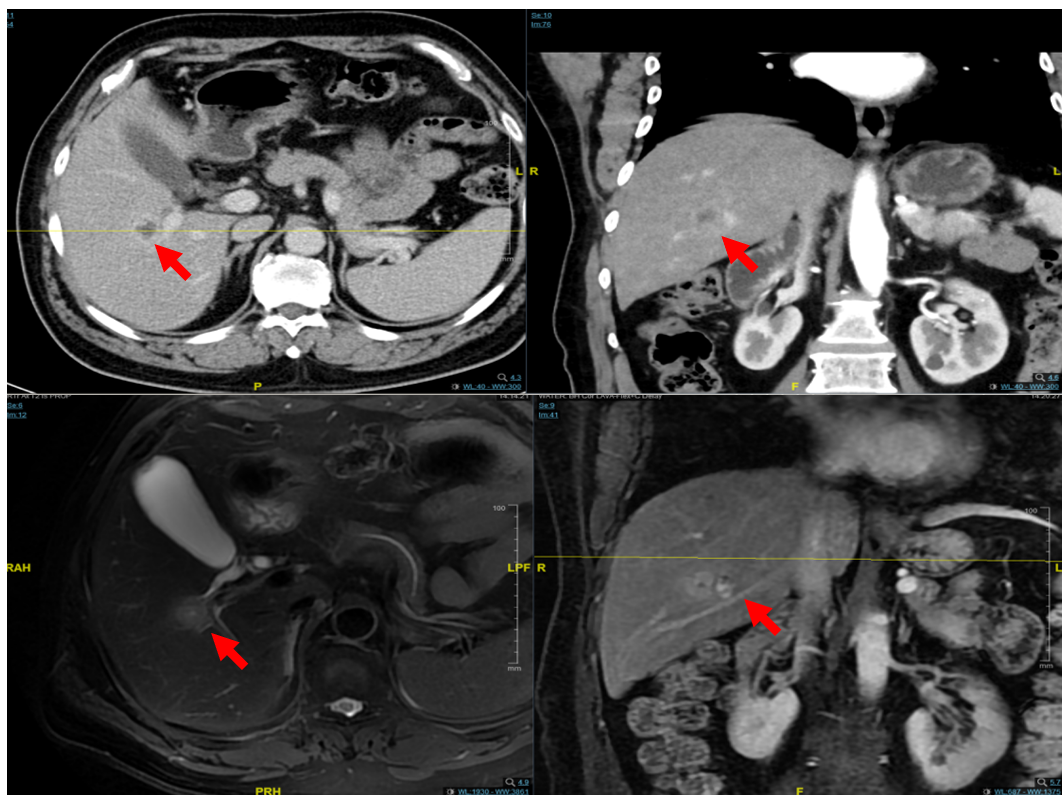
图1 2022-9-3胸腹盆增强CT
诊断
直肠癌肝转移(IVA期)、直肠癌术后、高脂血症、高尿酸血症。
诊疗经过
第一次治疗:手术+术后辅助化疗(XELOX)。
2020-2-16患者因诊断为直肠癌,行手术治疗。术后于2020-4-18至2021-1-17行6周期XELOX化疗。
2020年1月辅助检查:
1. 肠镜:距肛门口5cm可见溃疡隆起型肿物,占2/3管腔,质脆。
2. 腹部增强CT:直肠中下段管壁不均匀明显增厚,局部形成肿物,最大截面约2.9*3.9cm,符合直肠癌表现,伴周围多发淋巴结。
3. 盆腔MR:符合直肠肿瘤表现,直肠周围、骶前多发淋巴结。
2020-2-16术后病理:(直肠)隆起型中分化腺癌(3*3*2.5cm),侵及黏膜下层,距肿瘤1.5cm查见高级别管状-绒毛状腺瘤(2.5*1.5*2cm),区域癌变,侵及黏膜下层;脉管内未见癌栓,小神经束未见受累及;肠系膜淋巴结2/14查见癌转移。手术两侧切缘及另送(结肠残端)、(直肠残端)均未查见癌。术后分期:pT1N1M0。
第二次治疗:手术。
2021-4-19患者因吻合口复发于我院行直肠癌复发根治术(Miles)+乙状结肠造口术+腹壁切口疝修补术。术后患者拒绝治疗,2021-6-12 PET-CT检查和2021-7-13盆腔MRI检查均未出现复发。
术前第一次手术后的病理会诊:
(直肠)中分化管状腺癌。可见脉管内癌栓,其他改变请结合原单位病理报告。
免疫组化:MLH1(+),MSH2(+),MSH6(+),PMS2(+),Her-2(1+)。
基因检测:K-RAS(+),N-RAS(-),BRAF(-),PIK3CA(-)。
2021-3-21盆腔增强MRI:直肠癌术后,局部未见明确复发征象。 前列腺右侧外周带异常信号。 右侧精囊腺少许出血。
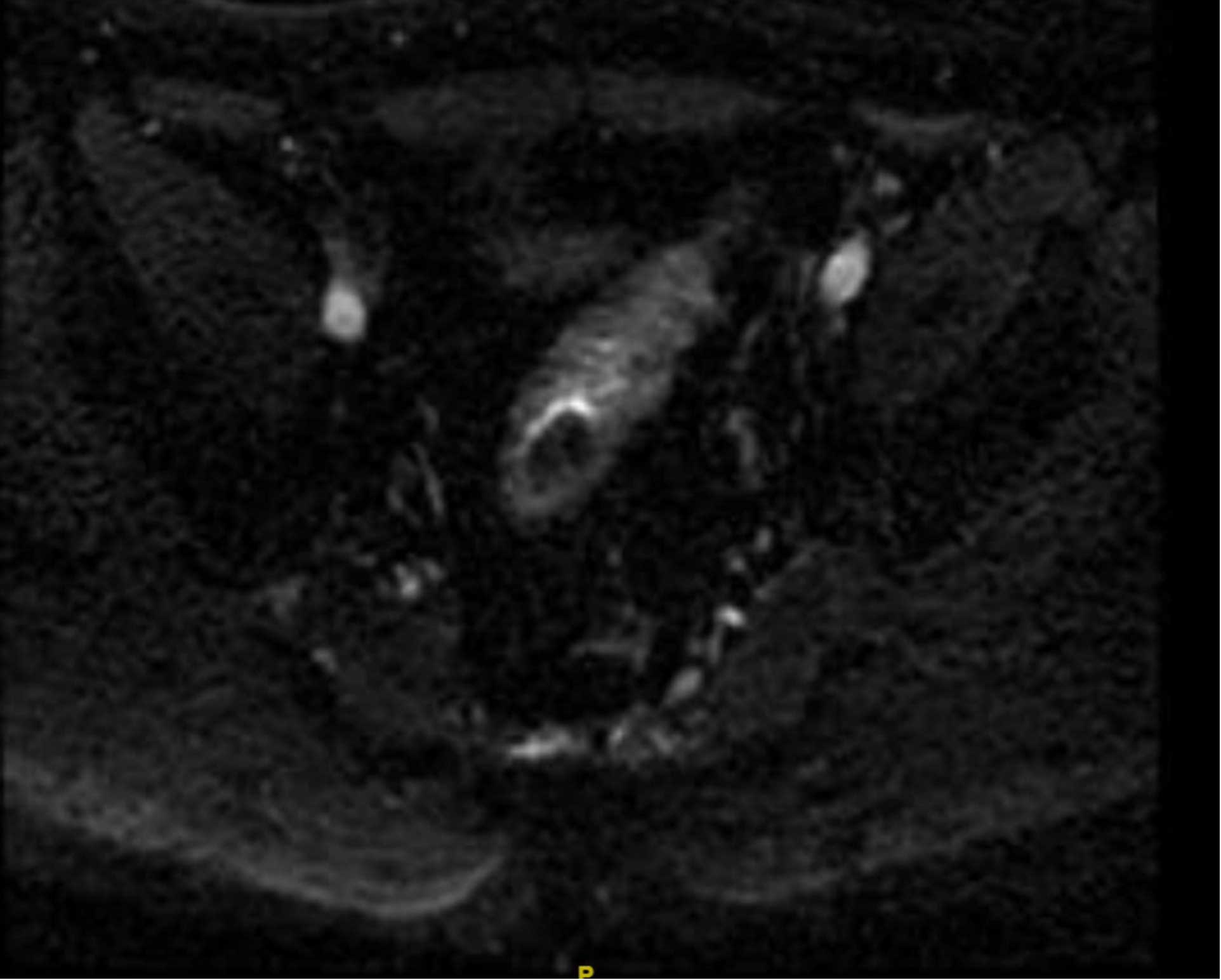
图2 2021-3-21盆腔增强MRI
图3 2021-3-21盆腔增强MRI
2021-3-23结肠镜检查:吻合口隆起,直肠癌复发可能。病理诊断:(吻合口隆起)管状腺癌。
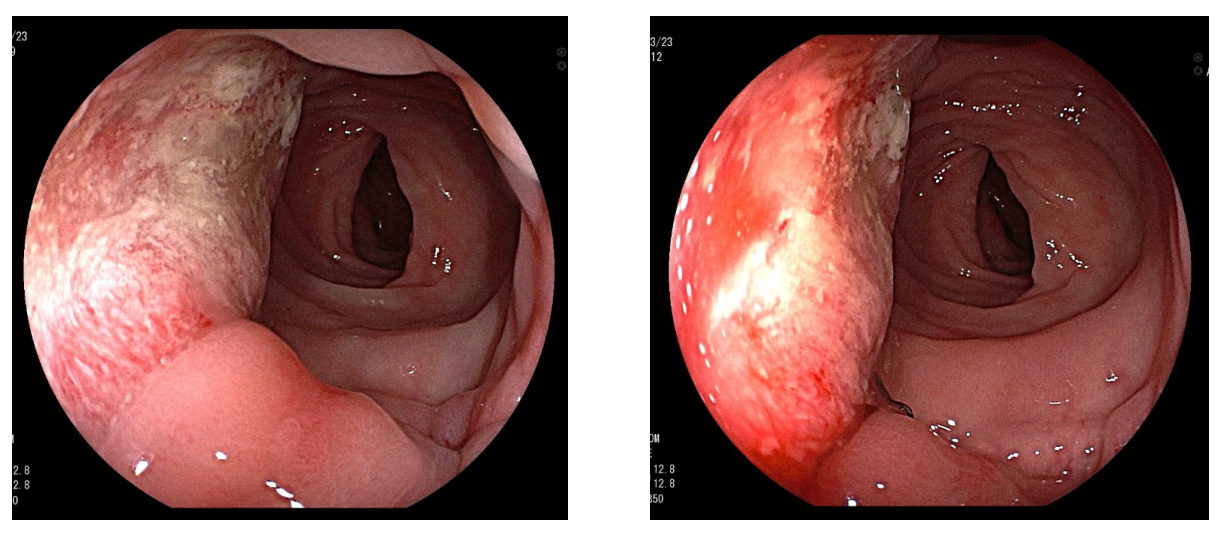
图4 2021-3-23结肠镜
2021-4-19第二次手术后病理:直肠中分化管状腺癌伴粘液腺癌分化(大小2*2*2cm),未见脉管癌栓,未见神经侵犯,侵及肠周组织,环周切缘、两断端未见肿瘤;淋巴结未见肿瘤(0/12)。免疫组化:CK(前端肿瘤微浸润1+),CD34(脉管癌栓-),D2-40(脉管癌栓-),S-100(神经侵犯-),Ki-67(70%+),P53(突变型),PD-L1(-),Her-2(1+),MSS。
2021-6-12 PET-CT检查:直肠切除术后,术区软组织密度影,葡萄糖代谢增高,伴前列腺精囊腺及后部盆壁粘连,对比本院2021-5-30腹盆部CT,较前范围缩小,考虑术后改变可能。
2021-7-13盆腔MRI检查:直肠癌术后改变,骶前间隙至肛周间隙多发异常信号,与2021-05-29日片比较,无著变。盆腔及双侧髂血管旁多发小淋巴结,无著变。
第三次治疗(二线化疗→盆腔放疗):化疗(伊立替康联合雷替曲塞和贝伐珠单抗)序贯根治性同步放化疗。
2021-11~2022-7患者接受化疗序贯根治性同步放化疗:(2021-11-7、2021-11-29、2021-12-29、2022-1-22、2022-3-1、2022-4-2)伊立替康400 mg,静滴d1,雷替曲塞6 mg,静滴d1,贝伐珠单抗600 mg,静滴d1,21天1周期。2、4、6周期评效均为缩小SD。2022-5-30至2022-7-3盆腔放疗:PTV盆45Gy/1.8Gy/25f,PGTV盆腔复发灶 60Gy/2.4Gy/25f,同步化疗卡培他滨1500 mg,口服Bid,d1-14,2022-6-2起1000 mg口服Bid d1-14,21天1周期。
2021-10-29(本次治疗前检查)盆腔MRI:直肠癌术后改变,骶前间隙至肛周间隙多发异常信号,与2021-7-20日片比较,较前增大,考虑肿瘤复发,局部淋巴结转移,精囊腺受累不除外。 盆腔及双侧髂血管旁多发小淋巴结。
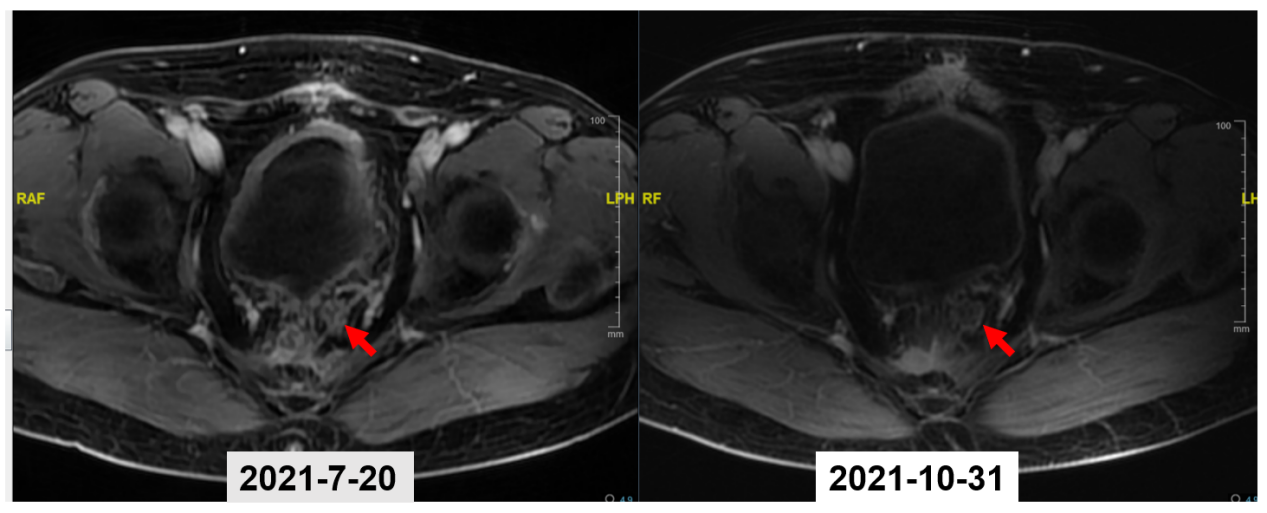
图5 2021-7盆腔MRI(左) vs 2021-10盆腔MRI(右)
2021-11-2(本次治疗前检查)结肠镜:未见肠道内复发。
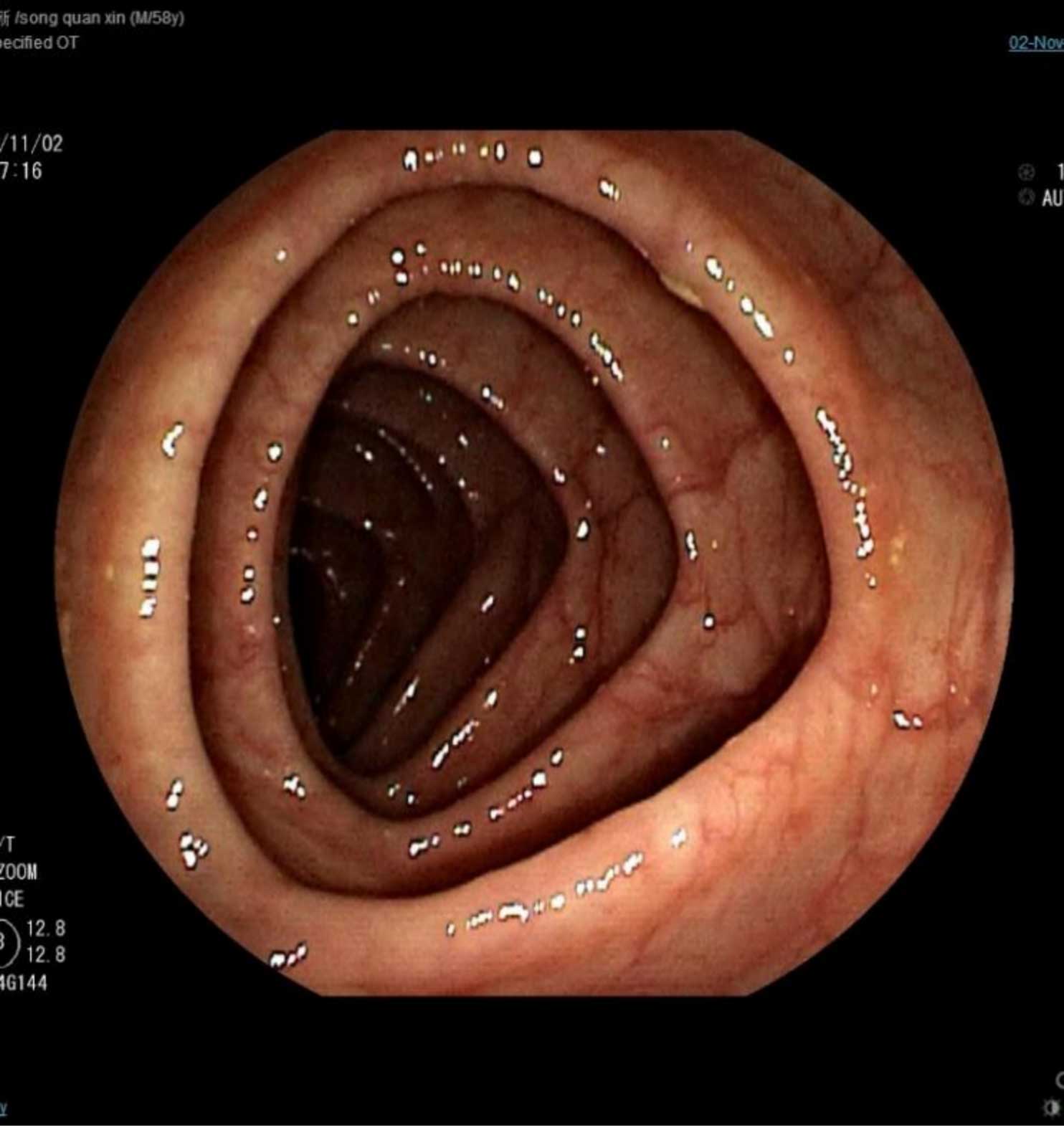
图6 2021-11-2结肠镜
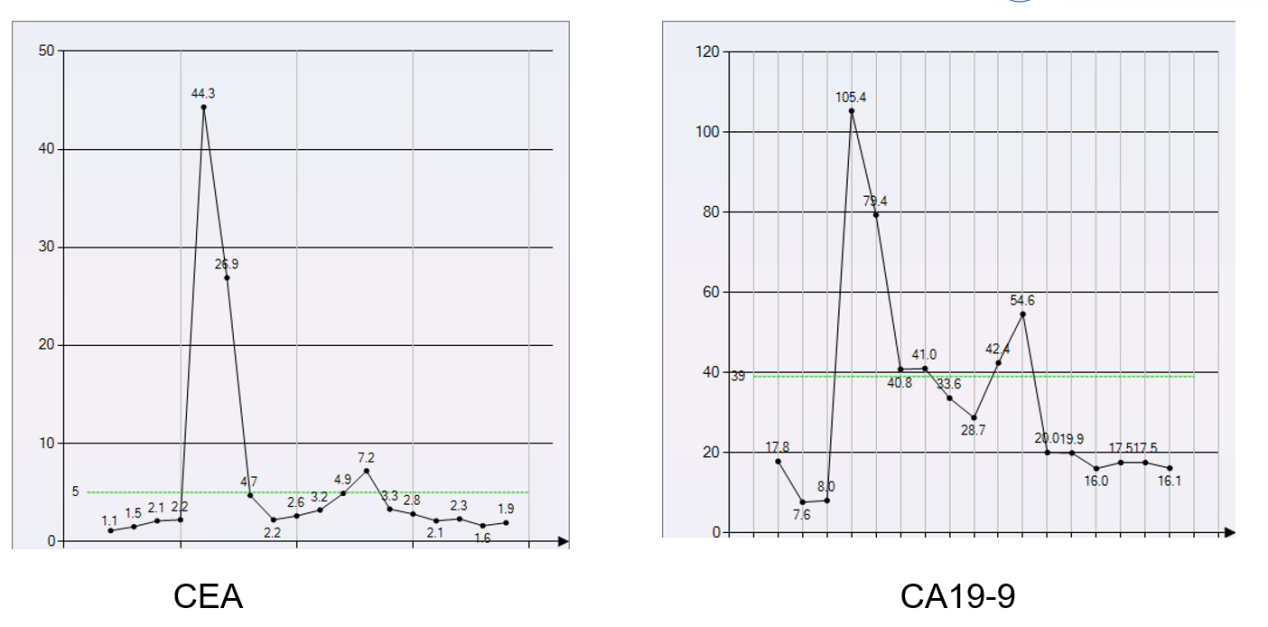
2021-10-24肿瘤标志物检测:CEA 44.3 ng/ml,CA199 105.2 U/ml。
二次病理检测:KRAS G12D、NRAS、PIK3CA、BRAF均为野生型,pMMR。
2周期疗效评价:疾病稳定(SD)

图7 2周期疗效评价(SD)
6周期疗效评价:SD
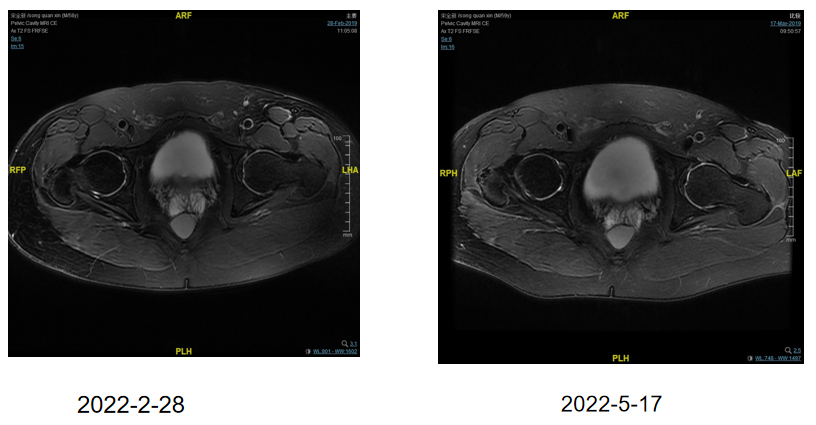
图8 6周期疗效评价(SD)
第四次治疗(三线治疗):斯鲁利单抗联合呋喹替尼。
2022-9-25患者因新出现直肠癌肝转移,开始接受斯鲁利单抗300 mg,静滴d1,呋喹替尼5 mg,口服d1-d21,28天1周期。2周期后疗效评价CR,10周期后疗效评价维持CR。2024年2月回当地继续斯鲁利单抗联合呋喹替尼治疗,暂未回我院评估后续治疗疗效。
2周期疗效评价:CR
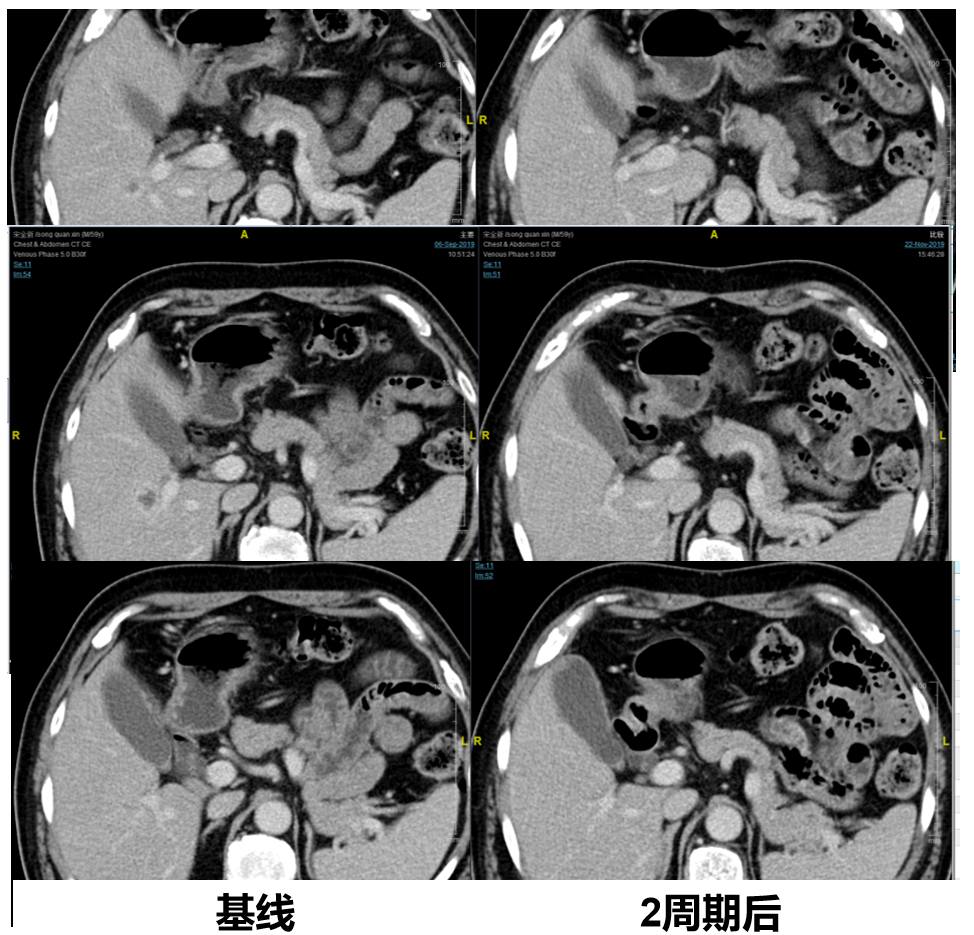
图9 2周期疗效评价
10周期疗效评价:CR
2024-2-1胸腹盆增强CT:1.两肺纹理增多、散在索条;2.右肺中叶结节,考虑良性病变可能性大;3.冠状动脉钙化;4.肝未见转移结节;5.符合直肠癌术后改变,左侧腹壁造瘘术后改变;6.马蹄肾,左肾囊肿。
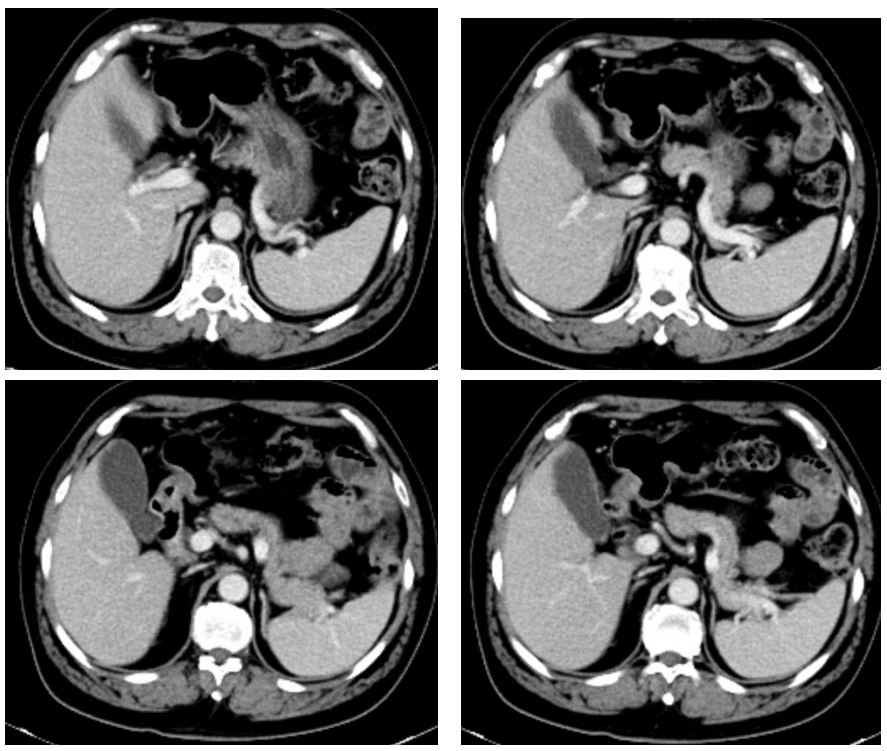
图10 10周期疗效评价(2024-2-1胸腹盆增强CT)
免疫治疗期间肿瘤标志物CEA、CA199变化趋势:
诊疗经过见下图:
专家点评
中国科学院大学附属肿瘤医院(浙江省肿瘤医院)肝胆胰胃内科主任医师
中国科学院大学附属肿瘤医院(浙江省肿瘤医院)副教授
温州医科大学硕士研究生导师
美国纽约州立大学上州医科大学访问学者
中国中医药信息学会中医临床药学分会常务理事
中国抗癌协会肿瘤营养专业委员会精准肿瘤营养专家协作组委员
浙江省免疫学会临床免疫专委会委员
浙江省信息学会精准医学专业委员会委员
浙江省毒理学会中毒与救治专委会委员
擅长消化道肿瘤的综合治疗及个体化治疗,主要从事肿瘤微环境基础及转化性研究。作为第一作者及通讯作者发表 SCI 论文20余篇,主持浙江省省(厅局)级4项,参与多项国家级和省级课题、参与多项国家级临床研究。现任中国中医药信息学会中医临床药学分会常务理事、《肿瘤预防与治疗》杂志青年编委。
罗聪教授:结直肠癌(CRC)是全球最常见的恶性癌症之一,许多CRC患者在初次就诊时已发生转移。近些年,以免疫检查点抑制剂(ICIs)为代表的免疫治疗为dMMR/MSI-H型mCRC的治疗带来新希望,抗PD-1单抗可为dMMR/MSI-H型mCRC患者带来显著生存获益。然而,dMMR/MSI-H型mCRC患者仅占5%左右,其余95%的mCRC肿瘤为pMMR/MSS型。
pMMR/MSS型mCRC肿瘤对单药免疫治疗反应率很低,被称为免疫治疗“冷肿瘤”。目前,全球尚无覆盖pMMR/MSS型mCRC患者的一线免疫疗法获批,这一患者群体存在巨大的未满足临床需求。ASTRUM-015研究是第一个免疫联合标准治疗(PD-1抑制剂+XELOX+贝伐珠单抗)在晚期一线治疗转移性结直肠癌全人群中取得突破性结果的随机、双盲、对照II期研究。2024年6月,该研究全文发表在Cell子刊MED杂志上。与对照组相比,mITT人群中斯鲁利单抗(汉斯状®)+贝伐珠单抗(汉贝泰®)+双药化疗方案mPFS达17.2个月 ,较对照组提高了6.5个月,疾病进展风险降低40%;MSS人群中,mPFS达17.2个月,较对照组提高7.1个月,疾病进展风险降低42%。安全性良好,所有不良反应和≥3级不良反应的发生率两组相似。
本病例为MSS型mCRC患者,三线接受斯鲁利单抗联合呋喹替尼治疗,安全性良好,2周期后疗效评价CR,10周期后疗效评价持续CR,取得了相对不错的疗效。可见,合适的免疫联合方案也有可能为MSS型mCRC患者带来获益,希望CRC免疫治疗研究进一步加强疗效预测生物标志物探索,以明确免疫治疗的获益人群,实现个体化精准用药,更好地节约医疗资源,同时使患者避免无效治疗,及相关副作用和潜在风险。期待未来能有更多的CRC患者能从免疫治疗中获益。
*免责声明:本文中的病例方案均通过患者及家属沟通并取得知情同意,期间所有不良反应事件已按要求上报。
排版编辑:肿瘤资讯-CYY











 苏公网安备32059002004080号
苏公网安备32059002004080号


