黑色素瘤文献月评项目秉承传递最新医学进展的理念,以专业视角多维度关注领域最新进展。继前两期获得业内高度评价后,项目第三期与大家如期而见,本期汇总了2020年3月发表的热点高水平研究,聚焦东亚人群接受达拉非尼联合曲美替尼治疗的真实世界数据、2019年MAPK通路抑制剂与免疫抑制剂对晚期黑色素瘤疗效分析、 BRAFi+MEKi “复敏”治疗方案等内容,特别邀请四川大学华西医院肿瘤中心姜愚教授为我们带来深入解读。

CSCO 恶性黑色素瘤专委会常委
CACA 肉瘤专委会委员
四川省肿瘤学会皮肤与软组织肿瘤专委会主任委员
四川省抗癌协会肿瘤疼痛学专委会候任主任委员
四川省抗癌协会肿瘤靶向治疗专委会副主任委员
四川省医促会肿瘤学MDT专委会副主任委员
四川省医促会生物免疫治疗专委会常委
四川省免疫学会肿瘤免疫专委会常委
四川省肿瘤学会骨肿瘤专委会委员
目录
1.达拉非尼联合曲美替尼治疗BRAF V600突变阳性晚期黑色素瘤日本患者的真实世界疗效及安全性 [IF: 3.377]
2.MAPK通路抑制剂与免疫检查点抑制剂对晚期转移性黑色素瘤生存影响——2019更新 [IF: 6.680]
3.BRAF抑制剂联合MEK抑制剂在晚期黑色素瘤“复敏”治疗的研究 [IF: 2.381]
4.BRAF V600E的免疫组化表达和肿瘤内BRAF V600E的异质性对肢端黑色素瘤特异性生存的影响 [IF: 5.688]
5.帕博利珠单抗与大剂量干扰素α-2b辅助治疗中国黑色素瘤Ⅲ期切除患者的比较:回顾性队列研究 [IF: 2.663]
1.达拉非尼联合曲美替尼治疗BRAF V600突变阳性晚期黑色素瘤日本患者的真实世界疗效及安全性
基于临床实践本文对达拉非尼联合曲美替尼治疗BRAF V600突变阳性晚期黑色素瘤的日本人群疗效及安全性进行了回顾性研究。本研究分析了作者所在的日本国家肿瘤中心医院的50例接受达拉非尼联合曲美替尼治疗的BRAF V600突变阳性晚期黑色素瘤患者(26名男性和24名女性,年龄21-86岁;中位年龄,53岁)。有效率为72.3%,其中完全缓解(CR) 8例(17.0%),部分缓解(PR) 26例(55.3%),病情稳定(SD) 9例(19.1%),疾病进展(PD) 4例(8.5%)。中位无进展生存期(PFS)为12个月,中位总生存期(OS)为23个月。在研究期间,共50例患者中有29例发生疾病进展,25例患者死亡。基线乳酸脱氢酶和转移器官数是PFS和OS的重要预测因素,CR是双靶治疗长期缓解的预测因素。不良事件总发生率为88%,其中3级及以上的占16%。50%以上患者出现的不良事件包括发热(52%)和皮疹(56%)。达拉非尼联合曲美替尼的日本患者疗效与全球研究报道数据相似,不良事件也基本一致;然而,在该小样本回顾性研究中,皮疹发生率似乎有所升高。
表1.总体最佳疗效

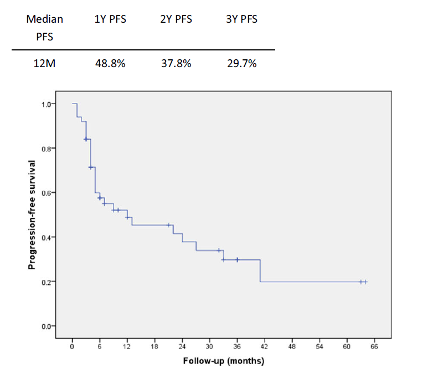
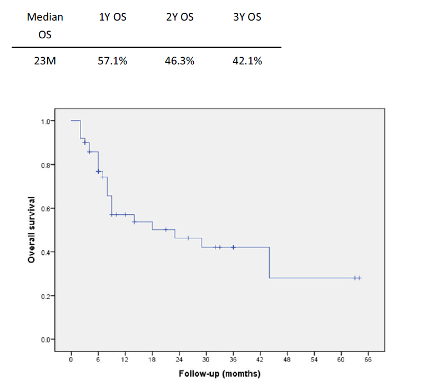
图1.接受达拉非尼联合曲美替尼治疗全部患者的无进展生存和总生存数据
2.MAPK通路抑制剂与免疫检查点抑制剂对晚期转移性黑色素瘤生存影响——2019年更新
背景:最近的治疗策略,特别是 MAPK通路抑制剂 (BRAF,MEK) 和免疫检查点抑制剂 (Anti CTLA-4,Anti-PD-1),已经被提出检验其对转移性黑色素瘤患者长期生存的不同影响。在这两个治疗组中,对各种药物、剂量方案和联合治疗进行了有力的相互对照试验。然而,仍然缺乏这两大策略间相互比较的前瞻性头对头试验的结果。
方法:我们对代表这两种治疗策略的晚期转移性黑色素瘤选定临床试验的生存数据进行了探索性分析。对来自 26 项临床试验的 84 条 Kaplane-Meier 生存曲线进行了数字化处理,并按治疗策略和治疗线进行了分组。对于这些组中的每一组,通过加权平均生成无进展生存期 (PFS) 和总生存期 (OS) 的平均生存曲线。
结果:按治疗策略分组的生存曲线显示了高度一致性,与后线治疗线相比,一线治疗选择空间更大。在一线治疗中,BRAF + MEK 抑制剂、PD-1 单药抑制剂和 CTLA-4 + PD-1抑制剂的平均 3 年 OS率分别为 41.3%、49.9% 和 58.4%。比较一线治疗中激酶抑制剂和免疫检查点抑制剂的平均 PFS 和 OS 曲线发现,在前 12 个月内BRAF 联合MEK 抑制具有优效性,之后PD-1 抑制剂单药或联合 CTLA-4 抑制剂的优效性更明显。在二线或更后线治疗中,前 3 年 BRAF + MEK 抑制剂优于抗 PD-1 单药治疗;BRAF + MEK 抑制的平均 3 年 OS率为 42.4%,PD-1抑制剂的平均 3 年 OS率为 40.1%。
结论和相关性:这些结果需要头对头比较随机临床试验的证实。
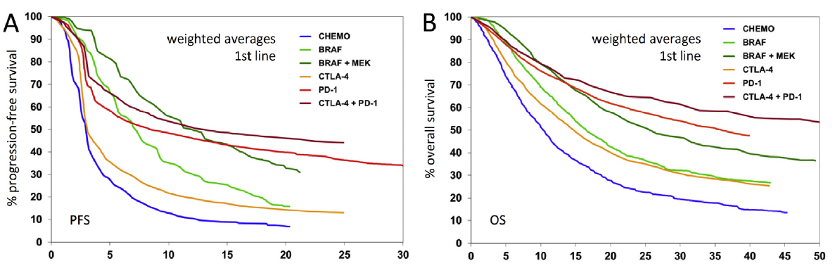
图2.对于临床试验中一线治疗的不同治疗药物分组后利用加权平均生成PFS的平均生存曲线(图A) 和OS的平均生存曲线(图B )
3.BRAF抑制剂联合MEK抑制剂在晚期黑色素瘤“复敏”治疗的研究
目的: 尽管BRAF抑制剂联合MEK抑制剂(BRAFi / MEKi)在晚期黑色素瘤患者的治疗方面取得了长足进展,但大多数接受治疗的患者由于获得性耐药而经历疾病进展。本研究旨在探索克服或逆转这一过程的可能性。
研究方法: 我们的多中心回顾性分析了51例BRAF突变的晚期黑色素瘤患者,患者一线或二线接受BRAFi 单药或BRAFi联合 MEKi治疗后进展,随后接受免疫治疗(PD-1或CTLA-4抑制剂),然后再次接受BRAFi / MEKi的“复敏”治疗。
结果:患者中位年龄为56岁(31-82岁)。首次BRAFi / MEKi治疗的mOS为29.7个月,mPFS为10.5 个月;“复敏”治疗的mOS为9.3个月,mPFS为5.9个月。首次接受BRAFi/MEKi和再次接受BRAFi/MEKi治疗的6个月OS%分别为98%和55%,1年OS%分别为92%和29%,2年OS率分别为69%和2%。与接受BRAFi / MEKi“复敏”治疗相比,首次接受BRAFi / MEKi治疗的临床反应率更高,ORR分别为72%和27%。疾病控制率92%和63%。首次BRAFi / MEKi治疗结束与开始BRAFi / MEKi“复敏”治疗之间的时间间隔不影响mOS或mPFS。BRAFi / MEKi“复敏”治疗的不良反应发生率降低。
结论: BRAFi / MEKi“复敏”治疗在临床上仍然是重要的治疗选择,并且不良反应发生率较低。对于一般情况良好,乳酸脱氢酶水平正常且无脑转移的患者的BRAFi / MEKi“复敏”临床疗效更好。
表2.首次接受BRAFi / MEKi治疗以及BRAFi / MEKi “复敏”治疗的ORR
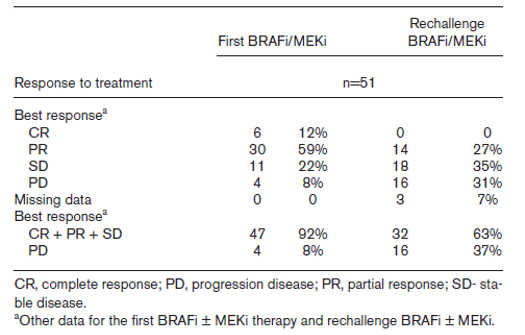
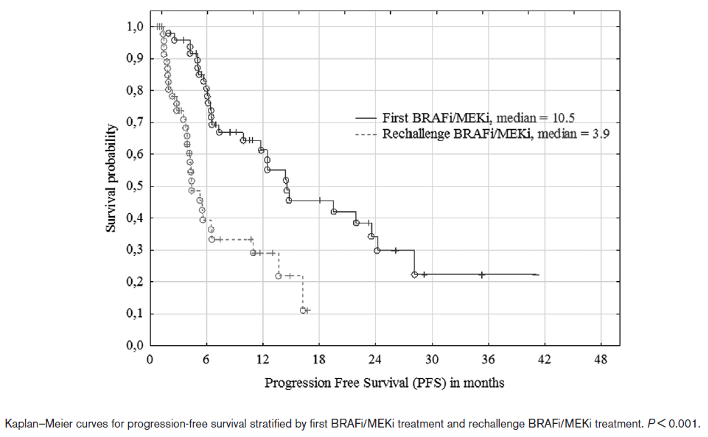
图3.首次接受BRAFi / MEKi治疗以及BRAFi / MEKi “复敏”治疗的PFS
BRAF突变恶性黑色素瘤患者在接受 BRAFi/MEKi 治疗后带来明显生存获益,但大部分的患者在治疗后常常面临耐药问题。该文章为目前最大宗的分析耐药患者复敏的队列研究之一,回顾性分析了51例BRAFi/MEKi 治疗进展的晚期黑色素瘤患者,在接受免疫治疗(Anti-PD-1或Anti-CTLA-4)后再次接受BRAFi / MEKi的治疗。该研究提示对于首次 BRAFi/MEKi 治疗进展的患者可能对BRAFi/MEKi 复敏也能获得一定程度的客观缓解(27%)。本研究中从首次 BRAFi/MEKi 治疗结束至 BRAFi/MEKi 复敏之间的中位时间间隔为 8.6 个月(类似研究中位间隔时间约为3.4-7.8月),较长的时间间隔与 BRAFi/MEKi 再次使用客观缓解率显著相关,但是并不影响mOS或mPFS。最后,研究还显示 BRAFi/MEKi 复敏毒性较低。
4. BRAF V600E的免疫组化表达和肿瘤内BRAF V600E的异质性对肢端黑色素瘤特异性生存的影响
肢端黑色素瘤是皮肤黑色素瘤的一种特殊形式,起源于手掌、脚底和甲床的无毛皮肤,其遗传背景与其他类型的皮肤黑色素瘤不同。BRAF基因突变在肢端黑色素瘤的发病机制和患者预后方面的作用尚未完全阐明。我们回顾性分析了112例原发性肢端黑色素瘤患者,并使用VE1抗体的免疫组化染色检测他们的BRAF V600E状态。在所有病例中,21例肢端黑色素瘤样本(18.8%)显示出BRAF V600E阳性染色,其中11例(9.8%)样本显示出异质性染色模式,即同时伴有VE1阳性和VE1阴性细胞的混合染色。BRAF V600E阳性与较厚的黑色素瘤显著相关(p = 0.0015)。临床病理因素在肢端黑色素瘤的均质性和异质性VE1阳性染色中无明显差异。在Kaplan–Meier分析中,BRAF V600E阳性和异质性阳性的肢端黑色素瘤患者生存期均明显短于BRAF V600E阴性的患者(分别为p = 0.0283 和 p = 0.0065)。这些发现为我们对肢端黑色素瘤病理生物提供了新的认识。
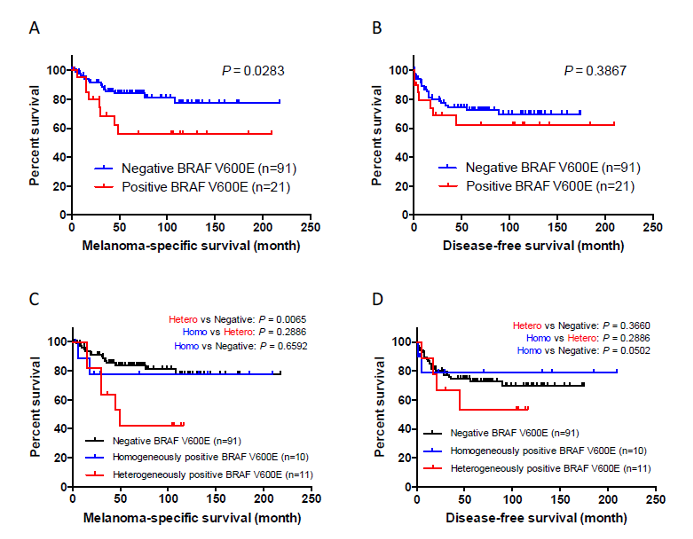
图4.黑色素瘤特异性生存期(MSS)和无疾病生存期(DFS)的Kaplan–Meier生存曲线。(A) BRAF V600E阳性的肢端黑色素瘤患者MSS明显短于BRAF V600E阴性的患者(p = 0.0283; 5年MSS分别为56.1%和83.9%). (B) BRAF V600E阳性并不是DFS的重要预后因素(p = 0.3867). (C) 当BRAF V600E阳性黑色素瘤被分成异质性和均质性亚组时,异位性肢端黑色素瘤患者的生存较BRAF阴性者更差(p = 0.0065). (D) 在三个亚组中,DFS没有显着差异
5. 帕博利珠单抗与大剂量干扰素α-2b辅助治疗中国黑色素瘤Ⅲ期切除患者的比较:回顾性队列研究
背景:帕博利珠单抗在晚期黑色素瘤中具有明确的抗肿瘤活性,且已在许多国家被批准用于黑色素瘤的治疗。在接受切除术后的III期黑色素瘤患者中,帕博利珠单抗辅助治疗可以延长无复发生存期(RFS)。本研究将完全切除术后的中国黑色素瘤III期黑色素瘤患者,接受帕博利珠单抗辅助治疗与接受干扰素α-2b(IFN-α-2b)的RFS结果进行了对比。
方法:研究者回顾在浙江肿瘤医院接受治疗、无移行转移的III期黑色素瘤患者的病历,并收集了在该院接受IFN-α-2b辅助治疗患者的病历资料。使用Kaplan–Meier曲线评估了RFS率,并且使用log-rank test检验了组间差异。
结果:共纳入29例接受帕博利珠单抗辅助治疗的患者和27例接受IFN-α-2b辅助治疗的患者。帕博利珠单抗组中位RFS未达到(95%CI不可估计[NE]),IFN-α-2b组为25个月。RFS在帕博利珠单抗组和IFN-α-2b组之间没有显著性差异(HR = 1.20,log-rank p = 0.75)。在肢端黑色素瘤患者中,帕博利珠单抗组和IFN-α-2b组之间没有显著性差异(HR = 1.22,log-rank p = 0.79)。对于ⅢC或ⅢD黑色素瘤患者,帕博利珠单抗组的RFS也与IFN-α-2b组相似(HR = 0.80,log-rank p = 0.47)。接受帕博利珠单抗的患者中,PD-L1表达阳性的患者RFS可能比PD-L1阴性的患者更长,但两组间无显著性差异(HR = 3.37,log-rank p = 0.17)。在接受帕博利珠单抗的患者中,高肿瘤突变负荷(TMB)并未能显示更长的RFS(HR = 1.63,log-rank p = 0.63)。 IFN-α-2b组27例患者中有6例(22.22%)发生3-4级不良事件(AE),2例接受IFN-α-2b治疗的患者因AE停药。帕博利珠单抗组中观察到5例患者(17.24%)发生了免疫相关的AE,帕博利珠单抗组中有2例患者(6.90%)发生了3-4级AE,其中1例患者需要停用1次药物,使用皮质类固醇激素治疗。没有患者因与治疗有关或免疫介导的AE而中断治疗。
结论:在中国接受手术切除术后的III期黑色素瘤患者中,帕博利珠单抗辅助治疗在延长RFS方面与IFN-α-2b疗效相似。与IFN-α-2b相比,帕博利珠单抗的治疗相关的AE发生率较低。需要进行前瞻性研究来证实帕博利珠单抗辅助治疗的临床获益,并确定可靠的生物标志物。
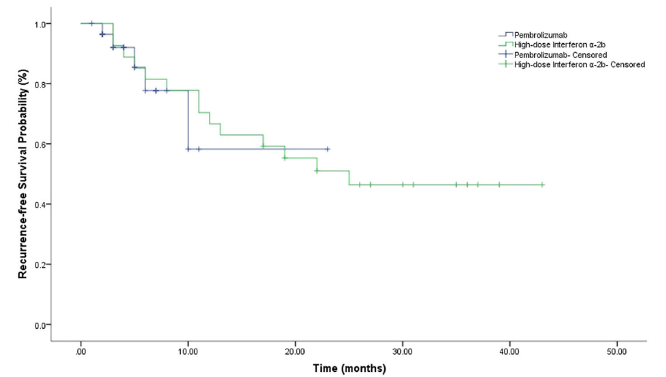
图5.接受帕博利珠单抗与大剂量干扰素α-2b辅助治疗全部患者的无复发生存(log-rank p=0.75)
排版编辑:Vicky
参考文献
[1]. J Dermatol, 2020, 47 (3), 257-264.
[2]. Eur J Cancer, 2020, 130, 126-138.
[3]. Melanoma Res, 2020. [Online ahead of print]. doi: 10.1097/CMR.0000000000000662.
[4]. J Clin Med, 2020, 9 (3), 690.
[5]. Invest New Drugs, 2020. [Online ahead of print]. doi: 10.1007/s10637-020-00913-6.
精彩回顾:
黑色素瘤文献月评 | 第一期 BRAF突变转移性黑色素瘤的最佳治疗方案决策
黑色素瘤文献月评 | 第二期 BRAFi+MEKi调节免疫微环境机制提供双靶治疗长期缓解理论基础















 苏公网安备32059002004080号
苏公网安备32059002004080号


