2019年9月27日至10月1日,2019年欧洲肿瘤内科学会(ESMO)年会在西班牙巴塞罗那举行,该会议是欧洲最负盛名和最具影响力的肿瘤学会议,会议期间大量肿瘤临床治疗相关的研究结果公布,为推动肿瘤诊疗进步发挥巨大作用。原发灶不明转移癌(CUP)是指组织学确诊为转移癌,而各种检测未能明确其原发解剖部位的恶性肿瘤。CUP约占所有恶性肿瘤的2%~5%,目前治疗手段有限,患者预后较差。近年来,基因组学研究显示,绝大多数CUP患者合并一个或以上临床有意义的治疗靶点,为CUP的治疗带来新思路。在本次ESMO大会上,两项研究分析了CUPISCO研究的相关数据,为CUP诊疗再添新思路。
(一)CUPISCO研究经验之CUP鉴定极具挑战
2037P:根据ESMO指南鉴定原发灶不明转移癌极具挑战性:CUPISCO研究经验
CUP是指经组织病理学证实为转移性恶性肿瘤,而通过全面的检查仍不能确定原发肿瘤部位的恶性肿瘤。CUP的发病率约占所有恶性肿瘤的2%~5%;临床表现多样、易播散、具有侵袭性及难以预测的转移模式是CUP的临床特点。大多数患者的预后很差,鉴于CUP患者缺乏明确的原发灶,这也限制了其治疗选择,大多数患者只能选择姑息化疗。为了更好的管理CUP患者,2015年欧洲肿瘤内科学会(ESMO)临床实践指南发布了CUP诊断、治疗和随访指南。指南中指出,可以将CUP患者分为2类:预后较好的亚群和非特异性亚群。对于前者,可以根据患者可能的起源部位进行组织特异性的治疗;而对于非特异性亚群,则根据患者的体力状况(PS)评分和血清乳酸脱氢酶(LDH)水平,选择双药、单药化疗或最佳支持治疗。
CUPISCO是一项II期、随机、开放性对照的多中心研究,旨在预后较差的CUP患者中评估基于CGP检测分子指导下的治疗是否优于传统的铂类为基础的标准化疗。研究根据ESMO标准入组了组织学确诊的CUP患者,无论其亚群;且CUP诊断经中心实验室确认,要求患者既往未接受过系统性治疗,有1个可测量病灶。所有入组患者进行CGP检测,组织或血液标本分别采用FoundationOneCDx和FoundationOne Liquid检测;评估MSI、TMB和gLOH状态。采用DAKO 22C3免疫组化检测PD-L1表达。该研究旨在回顾性分析既往的CUP患者,并对其进行CGP检测以评估有多少患者适合纳入CUPISCO组。
入组患者接受3个周期标准一线化疗后(紫杉醇卡铂,吉西他滨顺铂或吉西他滨卡铂),根据疗效进行分类:取得疾病控制(CR、PR或SD)的患者(类别1),随机3:1分配接受分子肿瘤治疗委员会指导下的治疗,由研究者选择(包括ROS1,NTRK1重排;ALK,RET重排;EGFR突变;ERBB2,ERBB3突变;PTCH1,SMO变异;BRAF V600突变;BRCA1/2突变;TMB高或MSI高;TMB低或未知以及无可靶向变异)或再接受3个周期的化疗;对于疗效评价为PD的患者(类别2),接受分子肿瘤治疗委员会指导下的治疗,由研究者选择(与类别1患者治疗一致)。主要研究终点为第1类患者中,分子靶向治疗对比化疗的无进展生存(PFS)。研究在32各个国家126个中心入组。
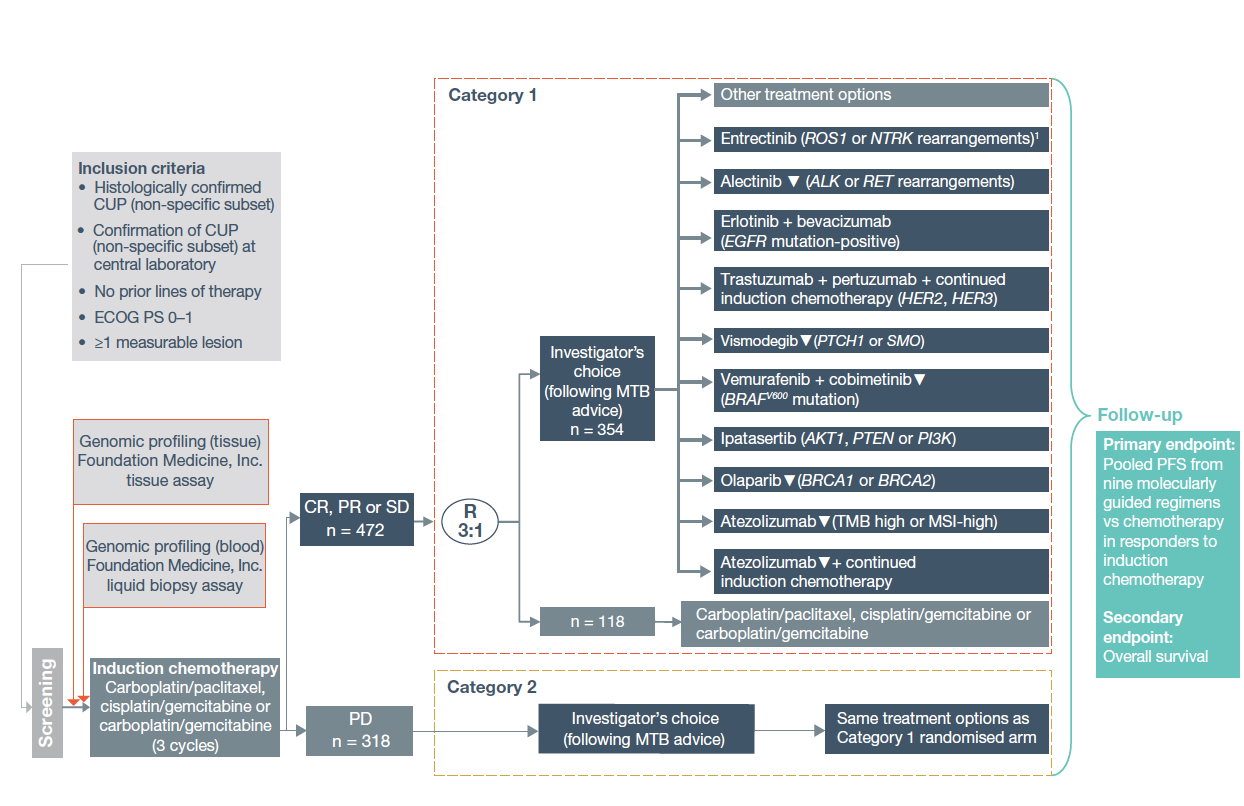
图1. CUPISCO研究设计
截至2019年8月26日,研究共筛查了334例患者,25例患者仍在筛查,137例(41.0%)患者已经入组。在全面筛查后,172例(51.5%)患者筛查失败。不符合入组条件的患者情况如下:
1. 研究纳入条件的挑战
肺癌:6例低分化腺癌或与肺癌符合的癌排除,其中4例CK7、TTF1以及NapsinA阳性;2例CK7阳性但TTF1和NapsinA阴性。
转移性乳腺癌:3例排除。2例为三阴性乳腺癌,GATA3、乳腺球蛋白、BRST2阳性;1例为HR阳性乳腺癌。
转移性肾癌:排除3例患者。约4%-5%的CUP符合转移性肾细胞癌。2%-3%的患者基于组织学和生物标志物谱(Pax8、Pax2、CK7、AMACR、CD10、RCC、TFE3、TFEB、FH)符合肾细胞癌。鉴别转移性肾细胞癌和CUP是非常重要的,但目前ESMO指南中关于转移性肾癌和CUP的鉴别流程并没有详细列出,形态学上怀疑肾细胞癌的患者需要经过进一步的临床鉴别,如影像学。
2. 诊断上的挑战
角蛋白阳性的软组织肿瘤:排除4例患者。促结缔组织增生性小圆细胞肿瘤和恶性肌上皮细胞肿瘤是非常罕见的肿瘤,根据免疫组合检测角蛋白阳性会被错分为低分化癌。上述4例患者角蛋白和肌间线蛋白均为阳性。促结缔组织增生性小圆细胞肿瘤为恶性间质细胞肿瘤,肌上皮肿瘤形态学表现多样。2例诊断为促结缔组织增生性小圆细胞肿瘤均为男性,表现为腹部包块,合并EWSR1-POU5A1重排。这两种类型的肿瘤需要进行进一步的分子检测,如FISH、RT-PCR或肉瘤融合检测,以明确诊断。
中线癌:1例患者排除。这是一例37岁女性,表现为复发性胸腔积液和胸膜癌。胸膜活检观察到小到中等体积细胞,表现为单一形态学。中线癌是一类侵袭性强、低分化肿瘤,表现为NUTM1重排。这例患者检测到NUTM1-BRD3/BRD4/NSD3重排。典型的免疫组合结果表现为p40/p63、角蛋白、突触素、NUT阳性。
神经内分泌肿瘤:4例患者排除。这类肿瘤病理形态学具有很大的异质性,缺乏典型的染色体模式,研究者认为突触素是最可靠的神经内分泌标志物。
(二)CGP的应用优化CUP患者管理
1983PD:原发灶不明转移癌全面基因组测序:根据CUPISCO研究对可靶向治疗或免疫治疗的肿瘤进行分子分类
CUPISCO临床研究设计上述已经介绍。303例CUP患者中,男女比例为1:1,中位年龄为67岁(22-89+岁)。303例接受CGP检测的患者96例(32%) 匹配到CUPISCO研究治疗组。患者的平均TMB为8 mut/Mb; 23%的患者TMB≥10, 12%≥16,9%≥20。3 例(1%)患者为MSI-H型。20%的患者gLOH ≥16。42例(14%)患者为PD-L1高表达(TPS评分≥50%)。重要的基因变异包括HER2 (7%), PIK3CA, NF1 (发生率均为6%), NF2 (5%), BRAF, PTEN, FGFR2, EGFR, MET (共占4%), CDK6 (3%), FBXW7和CDK4 (均为2%)。重要的基因融合包括ALK, RET和ROS1 (共占1%)。KRAS突变发生率为 27%; 6%的患者为KRAS G12C突变。在23例TMB≥20 mut/Mb的患者中,8例(35%)有吸烟史,5例(22%)有紫外线照射史或表现为错配修复特征。20%的患者携带癌症修复相关的胚系DNA突变。
表1. CUPISCO研究中,发现的基因变异和相应治疗选择
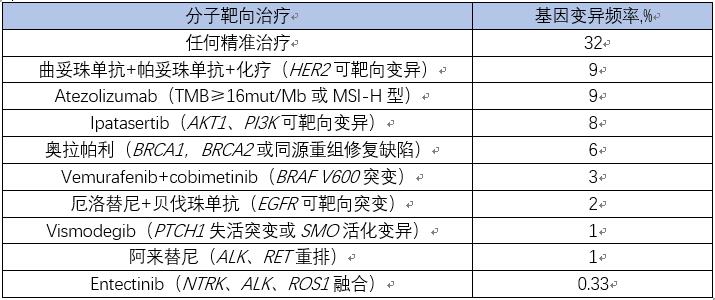
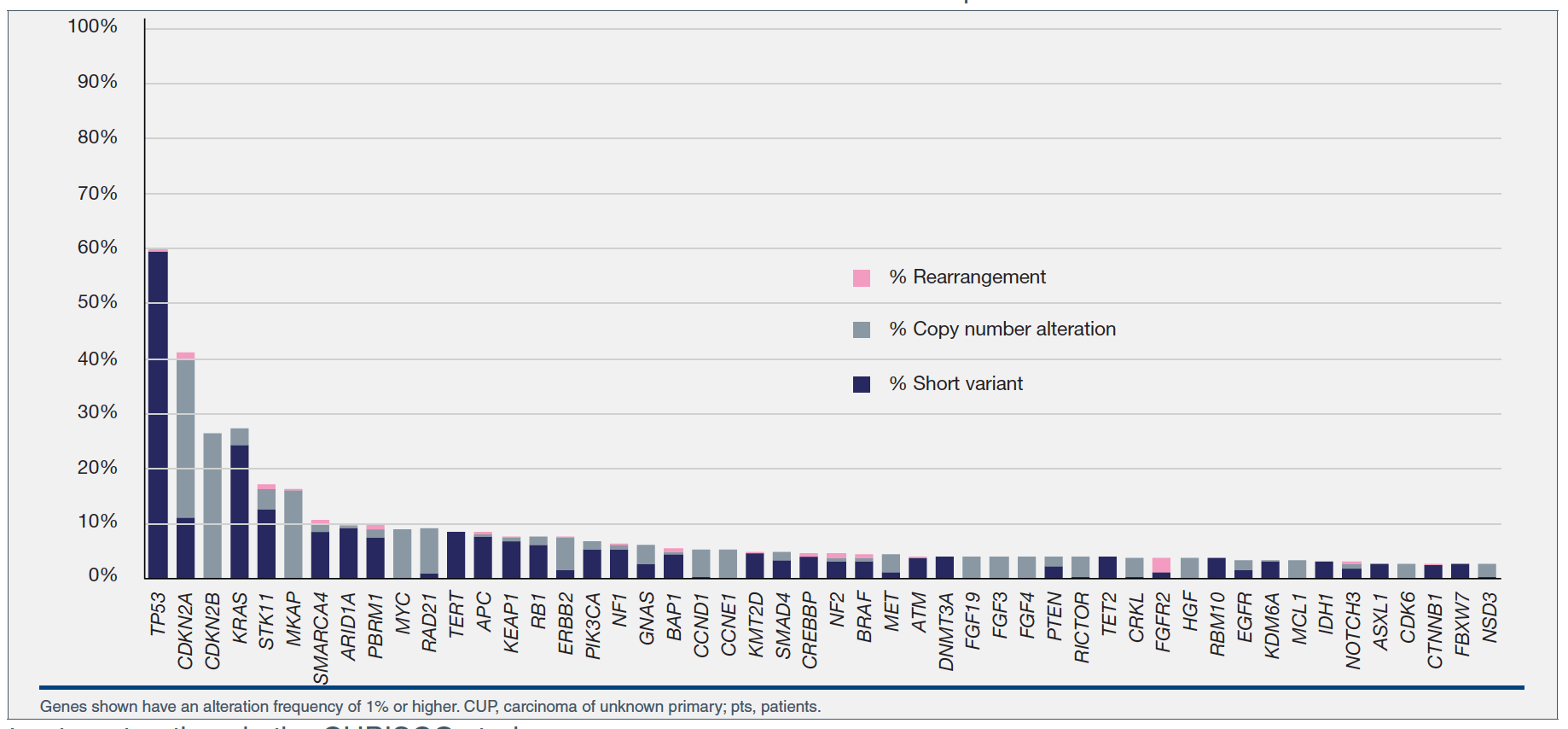
图2. 303例CUP患者基因变异的长尾现象
研究同时报道了2例CUP患者接受相应靶向治疗:
这例CUP 患者,65岁高加索女性,表现为肾上腺转移,病理表现为实性生长的低分化癌。免疫组化染色CK7和AE1/3阳性,但CK20, PAX8, CDX2, TTF1, 钙网膜蛋白, WT1,所有的乳腺癌标志物,神经内分泌标志物和黑色素瘤标志物均为阴性。肿瘤细胞膜上PD-L1 蛋白强染色。CGP检测为MET剪切位点短片段突变2888-1G>A (D), NF1 W9*, PTEN S287*, RB1 剪切位点1814+1G>A和TP53 P151A。HGF和RICTOR扩增。肿瘤为MSI稳定型,TMB为1 mut/Mb。鉴于患者为MET剪切点突变,已经成功接受MET抑制剂治疗。此外,这例患者还可以考虑多种靶向治疗和免疫治疗。
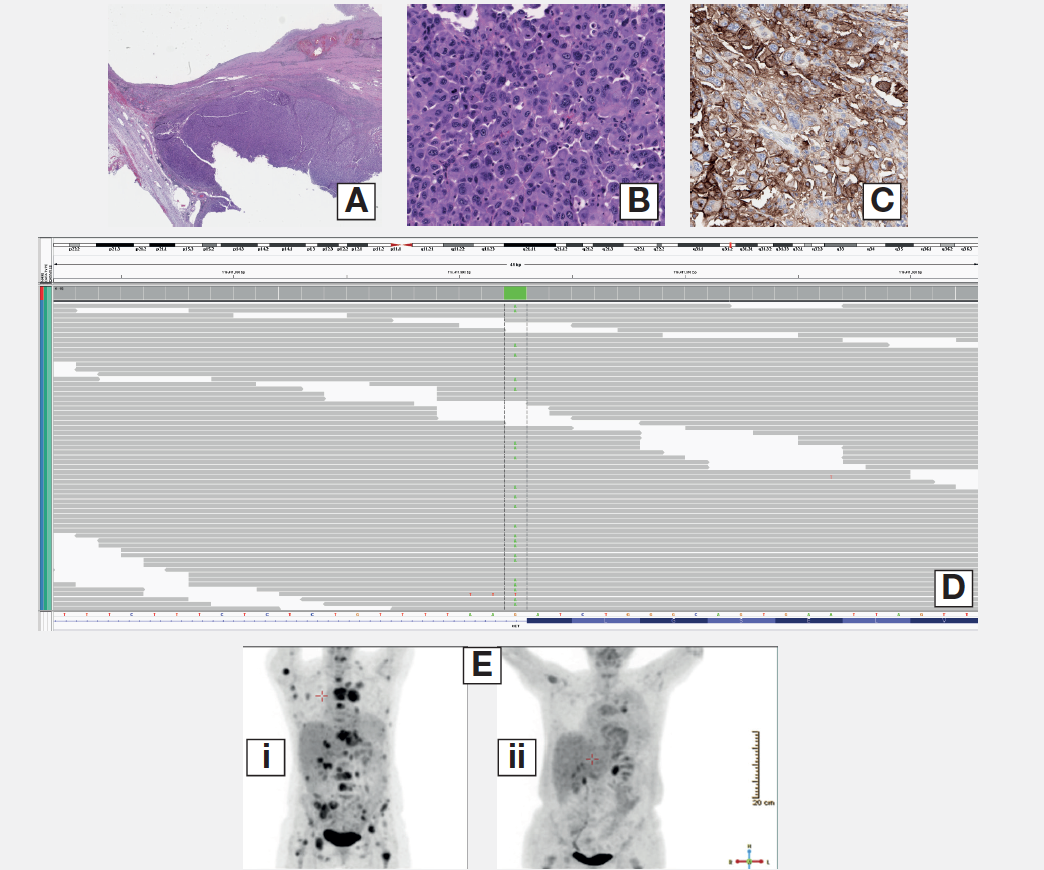
图3. 病例1 A. HE染色低倍镜;B.HE染色高倍镜;C.IHC显示CK7和AE1/3染色阳性;D.NGS检测MET 剪接突变;D.使用Crizotinib前后的PET-CT;
这例CUP为87岁男性,颈部淋巴结活检为中等分化腺癌,常规IHC检测以下蛋白表达阳性:CK7, AE1/AE3, p16和GATA3;以下蛋白表达阴性:TTF1, PAX8, 嗜铬粒蛋白A, 突触素,钙网膜蛋白,CDX2, CK20和CD56。PD-L1 IHC染色为阴性。CGP检测发现CHEK2 S428F短片段突变,NF1内含子35至外显子39倒置,TP53 T102fs*47。 HER2扩增,拷贝数为14 copies/nucleus,FGFR4扩增,拷贝数6 copies/nucleus。患者为MSI稳定型,TMB 5mut/Mb。尽管目前抗HER2靶向治疗仅获批用于乳腺癌和胃食管癌,很多其他类型HER2阳性肿瘤也从抗HER2靶向治疗中获益。
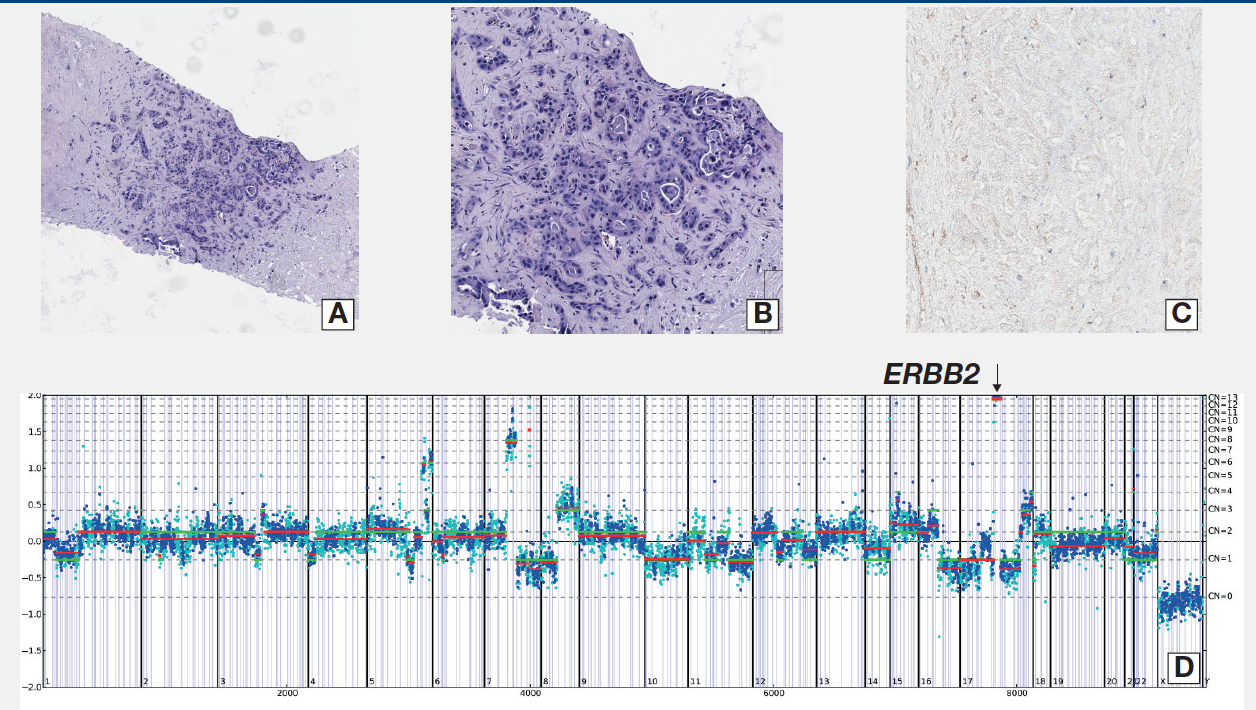
图4. 病例2 A-B. HE染色展示淋巴结的分化;C. IHC显示CK7, AE1/AE3,p16染色阳性;D.NGS检测结果展示ERBB2扩增;
小结:目前CUP的治疗选择有限,预后很差,该研究证明FoundationOneCDx用于指导CUP精确治疗具有一定的潜力。本研究在CUPISCO临床研究的基础之上,同时探索了其他生物标志物如PD-L1、gLOH等在CUP中的表达,结果显示根据上述指标改变,可能会进一步使部分CUP患者获益于个体化治疗。
(三)总结
上述两项研究都是针对CUPISCO临床研究的分析,这一研究选择预后较差的CUP患者,主要基于这类患者目前没有明确的治疗选择,属于相对同质的人群,最有可能从精准治疗中获益,初步的研究结果也证实这一治疗模式的可行性和疗效。我们期待这一基于分子指导下的临床研究结果,可以为CUP患者的管理带来新的思路。

北京大学肿瘤医院国际合作交流部副主任,内科教研室副主任
中国临床肿瘤学会青年专家委员会 主任委员
中国抗癌协会胃癌专业委员会青年委员会
主任委员
中国抗癌协会肿瘤支持治疗委员会 秘书长
中国研究型医院学会精准医学与肿瘤MDT专业委员会 副主任委员
中国老年学会老年肿瘤专业委员会胃肠分委会 常务委员
参考文献
1. A challenging task- identifying carcinoma of unknown primary (CUP) patients according to ESMO guideline: the CUPISCO trial experience. 2019 ESMO, abs 2037P.
2. Comprehensive genomic profiling (CGP) of carcinoma of unknown primary origin (CUP): Retrospective molecular classification of potentially eligible patients (pts) for targeted or immunotherapy treatment considering the prospective CUPISCO study design. 2019 ESMO, abs1983PD.












 苏公网安备32059002004080号
苏公网安备32059002004080号


