
第74例
HER2阳性乳腺癌高度依赖HER2蛋白通路生长,因此抗HER2治疗的应用有望取得非常好的疗效。而HER2+乳腺癌中有50%的患者为HR+。目前HR+/HER2+型晚期乳腺癌治疗方案尚无统一标准,此类患者的治疗方案强调个体化治疗。通过化疗、靶向、内分泌等多种模式综合治疗,给激素受体阳性、HER2阳性乳腺癌患者带来更长久的生存获益。

中南大学湘雅医院
《中国普外科杂志》青年编委
CSBS(中国医师协会外科医师分会乳腺专业青年委员会)青年委员
湘雅医院乳腺遗传咨询门诊主诊医师
主攻遗传性乳腺癌临床诊断与治疗的研究
2008 年在导师唐利立教授的指导下参与省部级课题 2 项
目前负责和参加的国家级及省部级课题8项,参编《乳腺癌经典文献解读》一书,发表文章11篇,获国家专利一项
基本情况
患者女性,42岁,未绝经,月经规律。因发现右乳肿块3个月就诊。既往体健,2002年行剖宫产手术,余无特殊。
既往诊断治疗经历
2017年12月3日,患者因发现右乳肿块3个月就诊。体格检查:两侧乳房发育良好,基本对称,右侧乳房外下象限局部皮肤有凹陷。挤压乳头及附近腺体,双侧乳头无溢液;于右侧乳房外下象限区,约6点钟方位可扪及1个肿物,6cm×6cm,乳头后下方质硬,边不清,活动度差,表面不光滑,左侧乳房未扪及肿物;双腋下双锁骨上未扪及肿物。2017年11月25日行乳腺彩超示:右乳低回声区并砂砾样钙化,BI-RADS 4C类,右乳实质性结节,BI-RADS 3类。乳腺钼靶:①右乳下象限片状不对称高密度影及多发泥沙样钙化灶,52mm×52mm大小,BI-RADS 4C类。②右乳内上象限多个颗粒状钙化灶,BI-RADS 4A类。③左乳外上象限边缘模糊的团片状不对称影,BIRADS 3类;乳腺增生?④左乳内上象限密度增高结节影,BI-RADS 4A类。⑤双腋下副乳。腹部CT发现肝内多发占位,较大者位于肝右后叶上段,大小约1.9cm×1.7cm,结合临床病史,考虑转移可能性大。2017年11月24日PET-CT检查发现右乳外下象限软组织增厚,考虑乳腺癌。肝内多发低密度结节影,考虑肝转移癌。乙状结肠壁稍增厚,建议肠镜。2017年11月29日,胃镜检查发现胃溃疡,性质待定,非萎缩性胃炎。2017年11月24日结肠镜发现结肠慢性炎症。CEA为 8.28ng/ml。
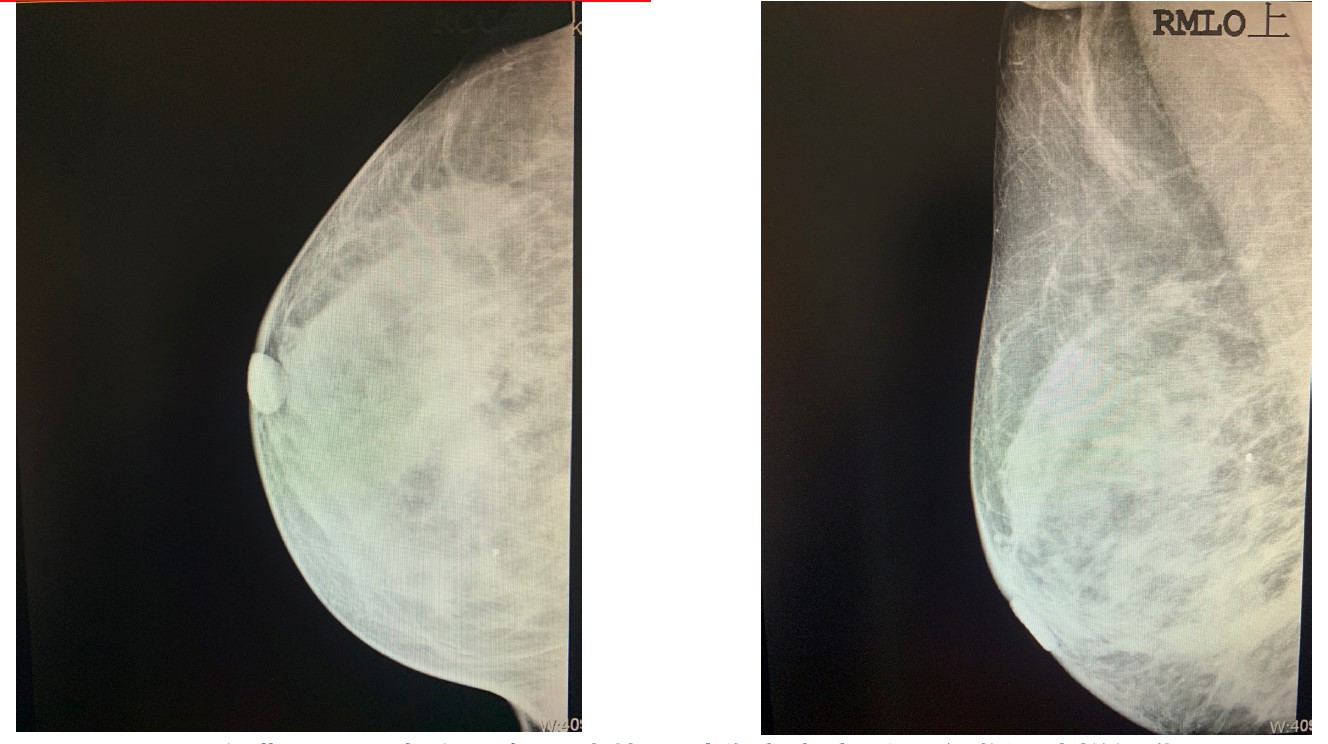
图1. 乳腺钼靶检查右乳下象限片状不对称高密度影
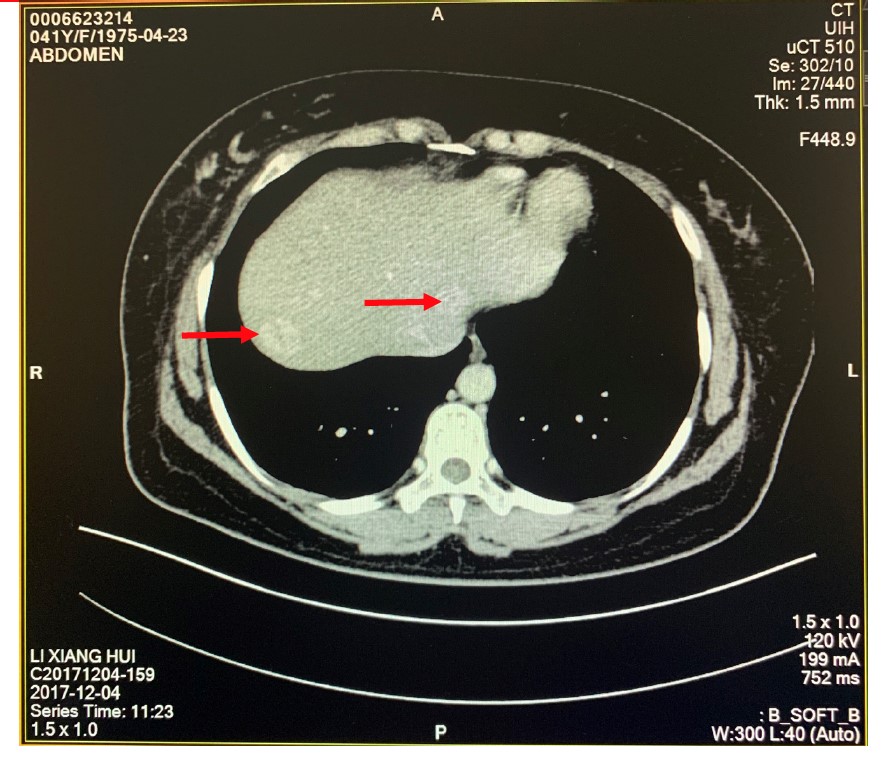
图2. 腹部CT检查发现肝内多发占位
2017年12月5日行右乳肿块穿刺活检,病理为:见少量癌组织,部分为非特殊类型浸润性癌,倾向Ⅱ级,少数导管内癌。免疫组化结果:Ki67(+,约10%),ER(+,约5%),PR(+,约5%),HER2(3+)。诊断:右乳浸润性乳腺癌Ⅳ期,伴肝转移,HER2阳性型;胆囊炎、胆囊结石。
2017年12月7日至2018年5月5日行EC(表柔比星+环磷酰胺)方案化疗1周期→DC(多柔比星+环磷酰胺)方案化疗3周期→PH(紫杉醇脂质体+曲妥珠单抗)治疗4周期,共计治疗8周期。2018年5月8日行卡培他滨+曲妥珠单抗维持治疗3个月。复查乳腺彩超:①右乳低回声区,11mm×8mm大小:BI-RADS 6类;②双乳实质性结节(左乳多发):BI-RADS 3类;③右乳多发囊性结节:BI-RADS 2类。PET-CT检查: “乳腺癌肝转移化疗后”,右乳内下象限近乳头区小结节,代谢与正常乳腺组织相近,肝实质内未见明显代谢异常增高灶,提示“乳腺癌肝转移化疗后”肿瘤及转移瘤活性受抑(活性目前基本消失);右内上象限钙化灶;右乳外侧平乳头水平结节、代谢无异常;多为偏良性病变。肝脾MRI:“右乳癌肝转移”患者复查,与老片对比:原肝内多发结节现未见确切显示。
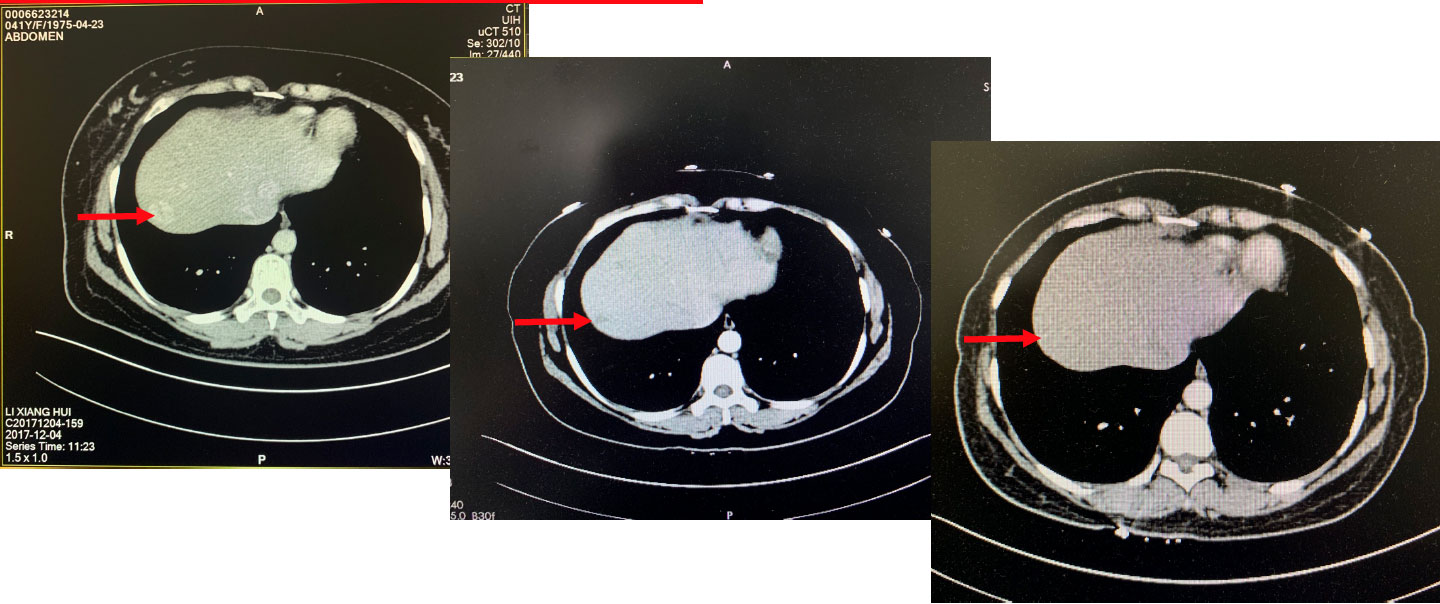
图3. 一线化疗过程中的疗效评价
2018年9月7日行右乳癌姑息性切除手术。术后病理评估为pCR,乳腺组织及腋窝淋巴结(0/7)均未见癌细胞。患者术后继续给予卡培他滨+曲妥珠单抗维持治疗至今。2019年2月20日,乳腺彩超:①左乳多发实质性结节,BI-RADS 3类;②右侧腋窝至右侧胸壁皮下局限性积液。乳腺钼靶:①右乳外上象限肿块灶,BI-RADS 3类;②左乳内上象限密度增高影,BI-RADS 4A类。肝脾MRI:“右乳癌肝转移”患者复查,与老片对比:肝内未见明显异常强化灶。现规律复查,未见明显新发转移或进展征象。
总结
患者绝经前女性,月经规律。2017年11月发现右乳肿物,伴肝转移。免疫组化结果:Ki67(+,约10%),ER(+,约5%),PR(+,约5%),HER-2(3+)。诊断为右乳浸润性乳腺癌,伴肝转移, HER2阳性型。2017年12月至2018年5月接受EC×1周期+DC×3周期+PH×4周期方案治疗后,继续给予卡培他滨+曲妥珠单抗维持治疗3个月。影像学复查后,患者原发病灶取得完全缓解。2018年9月行右乳癌姑息性切除手术,术后病理评估原发灶和淋巴结达到pCR。术后继续给予卡培他滨和曲妥珠单抗维持治疗至今,规律复查,未见明显新发转移或进展征象。
点评专家

天津市肿瘤医院乳腺肿瘤内科主任医师
天津市肿瘤医院Ⅰ期临床试验病房主任
中国抗癌协会乳腺癌专业委员会委员
中国抗癌协会头颈专业委员会委员
中国医药教育学会乳腺疾病专业委员会常委
天津市抗癌协会化疗专业委员会常委
北京乳腺病防治学会健康管理专业委员会常委
天津市抗癌协会靶向治疗专业委员会乳腺癌学组组长
点评
患者绝经前女性,月经规律。首诊即为IV期,合并肝脏转移。免疫组化检测显示患者为HER2阳性、HR阳性的三阳性乳腺癌,但ER/PR均为低表达。根据《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南(2019)》推荐,在对这类患者治疗决策时,有以下几点需要注意:
1. HER2阳性、HR阳性的复发转移乳腺癌,优先考虑曲妥珠单抗联合化疗
CSCO乳腺癌诊疗指南指出,对于HER2阳性、HR阳性的复发转移乳腺癌,优先考虑曲妥珠单抗联合化疗。这例患者为首诊Ⅳ期,既往未接受过曲妥珠单抗治疗,因此以曲妥珠单抗为基础联合化疗的方案是这部分患者晚期一线治疗标准方案。目前,已经有多项研究证实了曲妥珠单抗用于HER2阳性晚期乳腺癌一线治疗的地位。H0648g研究最早评估了曲妥珠单抗联合AC或紫杉醇一线治疗HER2阳性转移性乳腺癌的疗效。结果显示,对于HER2阳性的患者,曲妥珠单抗方案显著延长生存期达到9月。后续的M77001研究、US Oncology、CHAT、HERNATA也进一步证实了曲妥珠单抗一线治疗的地位。目前,国际指南推荐,HER2阳性晚期乳腺癌标准一线治疗为帕妥珠单抗、曲妥珠单抗双靶向联合多西他赛;帕妥珠单抗也已经在国内上市,因此,对于部分HER2阳性晚期乳腺癌,可考虑一线帕妥珠单抗联合曲妥珠单抗双靶方案。这一推荐主要是基于CLEOPATRA研究,根据今年ASCO大会上的最新研究结果,中位随访99个月的结果显示,帕妥珠单抗+曲妥珠单抗+紫杉醇对比曲妥珠单抗+紫杉醇仍具有显著的生存获益,中位OS分别为57.1个月和40.8个月(绝对差值16.3个月;HR 0.69;95%CI:0.58~0.82);两组的8年OS率分别达到37%和23%。
对于HER2阳性/HR阳性复发转移乳腺癌治疗,目前也进行了抗HER2治疗联合内分泌治疗的相关研究探索,如TAnDEM研究和EGF30008研究,但目前抗HER2治疗联合内分泌治疗主要的适应人群尚未有明确规定。PERTAIN研究是一项随机、开放、双臂、多中心临床试验,入组HER2阳性、HR阳性局部晚期或转移性乳腺癌患者共计258例,既往未接受全身治疗(除了内分泌治疗),随机1:1接受曲帕双靶+AI或曲妥珠单抗+AI治疗,主要研究终点是PFS。结果显示,曲帕双靶+AI较曲妥珠单抗+AI一线治疗能够降低复发风险35%,两组中位PFS分别为18.89个月和15.80个月(HR 0.65;95%CI 0.48~0.89;P=0.007)。上述患者合并肝脏转移,在初始治疗时,仅采用单纯化疗方案,后续采用紫杉类联合曲妥珠单抗治疗的模式,肿瘤持续退缩。目前患者仍在治疗过程中,临床医生应该和患者进行充分沟通,说明持续抗HER2治疗的重要性,鼓励患者坚持曲妥珠单抗治疗,直至病情进展或不良反应不能耐受。关于是否停用化疗改为内分泌治疗联合抗HER2靶向治疗,要根据既往内分泌治疗的效果及肿瘤免疫组化结果以及患者耐受性而综合考量。至于选择换用卡培他滨联合曲妥珠单抗这一治疗方式只是具体临床工作中的一种选择,缺乏循证医学证据支持。
2. 是否进行姑息性切除?
一些回顾性研究提示,对于IV期乳腺癌患者,切除原发灶可以改善患者的预后,但这些研究纳入的患者具有很大的异质性。前瞻性的随机研究结果仍充满争议,有些研究提示,原发灶切除并不能给患者带来生存获益。不同研究结果不一致的原因,可能是因为未充分考虑系统性治疗的变化。目前关于转移性乳腺癌能否从局部治疗中获益,尚无定论,后续仍需要进行更多研究,包括对不同亚型患者进行相关分析。在具体的临床实践中,对于转移性乳腺癌是否进行手术或其他局部治疗,应该进行多学科综合讨论,结合患者个人意愿进行决策。
1. Slamon DJ, Leyland-Jones B, Shak S, Fuchs H, Paton V, Bajamonde A, et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med 2001;344(11):783-92.
2. End-of-study analysis from the phase III, randomized, double-blind, placebo (Pla)-controlled CLEOPATRA study of first-line (1L) pertuzumab (P), trastuzumab (H), and docetaxel (D) in patients (pts) with HER2-positive metastatic breast cancer (MBC). 2019 ASCO,abs1020.
3. Kaufman B, Mackey JR, Clemens MR, et al. Trastuzumab plus anastrozole versus anastrozole alone for the treatment of postmenopausal women with human epidermal growth factor receptor 2-positive, hormone receptor-positive metastatic breast cancer: results from the randomized phase III TAnDEM study. J Clin Oncol 2009;27(33):5529-37.
4. Johnston S, Pippen J, Jr., Pivot X, et al. Lapatinib combined with letrozole versus letrozole and placebo as first-line therapy for postmenopausal hormone receptor-positive metastatic breast cancer. J Clin Oncol 2009;27(33):5538-46.
5. Rimawi M,Ferrero JM,de la Haba-Rodriguez J, et al. First-Line Trastuzumab Plus an Aromatase Inhibitor, With or Without Pertuzumab, in Human Epidermal Growth Factor Receptor 2-Positive and Hormone Receptor-Positive Metastatic or Locally Advanced Breast Cancer (PERTAIN): A Randomized, Open-Label Phase II Trial.[J] .J. Clin. Oncol., 2018, 36: 2826-2835.














 苏公网安备32059002004080号
苏公网安备32059002004080号


