作者单位:中山大学附属肿瘤医院 结直肠科,放疗科

主任医师,中山大学附属肿瘤医院结直肠科副主任
中国临床肿瘤学会(CSCO)副秘书长、常务理事
2015-2017年ASCO学术委员会委员
CSCO青年专家委员会第一届主任委员
中国抗癌协会大肠癌专业委员会委员
CSCO结直肠癌专委会常委
CSCO结直肠癌指南专家组秘书、执笔人
CSCO全国胃肠道间质瘤专家委员会委员、胃肠胰神经内分泌肿瘤专家委员会委员
中国医师协会结直肠外科医师分会常务委员
广东省大肠癌专业委员会常委
由于盆腔解剖的特殊性及手术操作的困难性,与结肠癌相比,局部进展期直肠癌(locally advanced rectal cancer,LARC)的根治性手术存在2个主要问题:局部复发率高和器官功能受损,包括肛门括约肌功能、性功能和膀胱排尿功能。对于位置比较低的直肠癌,根治性腹会阴联合切除术(APR)患者需行造口,对患者的身心造成沉重打击,这也是部分直肠癌患者拒绝治疗的主要原因。为保留肛门的极限保肛术式如低位/极低位前切除术(LAR)、括约肌间切除术(ISR),对功能的保留不甚理想,还有很多问题未能解决,典型的包括“前切除综合征”(low anterior resection syndrome,LARS)、术后控便功能障碍乃至失禁。为减少局部复发,也避免扩大手术带来的功能损害,目前全球标准策略是:术前同步放化疗(chemoradiation,CRT)-全直肠系膜切除术(total mesorectal excision,TME)-术后化疗,即“三明治”模式。该模式可以显著降低局部复发率,提高保肛率。但是,CRT对后续的TME手术影响很大,FOWARC研究数据表明,相比单纯化疗组,CRT明显增加了吻合口漏发生的比例(13.9%/14.2% vs 3.3%,P=0.02),亦明显增加LARS发生率(重度LARS 64.4% vs 38.6%,P<0.001)。而CRT后接受LAR手术,越来越多采用保护性造口,还出现了一些新型的并发症,如术后吻合口上方结肠狭窄 ,这让外科医生束手无策,预防性造口无法回纳,也严重影响了患者的生活质量。
外科手术导致的功能影响最大,也最难改变,因其与肿瘤位置、分期有关。降低外科手术带来的功能影响,主要是通过术前治疗改变手术模式:从括约肌毁损手术变为括约肌保留手术(如APR变为LAR、ISR等),从根治性手术变为经肛门局部切除术,从手术治疗变为非手术治疗(即肿瘤消退后的“观察&等待”)。解决CRT对手术并发症及器官功能影响的策略是:是否所有LARC患者均需要行术前新辅助治疗?哪些LARC患者可不需术前放疗而采用单纯化疗取代?
哪些局部进展期直肠癌患者可以直接手术
LARC是一个非常笼统的名词,简单来说,只要是T3或N+期的直肠癌就属于此概念范畴,那么所有LARC均应该按照统一模式“术前放化疗+TME手术+术后化疗”治疗吗?今天来看,答案是否定的,我们应该将LARC进一步分层,采用更加精准的分层治疗模式。
来自中山大学肿瘤医院一项2005~2009年的早期研究表明(结果尚未公开发表),依靠直肠腔内超声检查(ERUS)和CT分期确定的距离肛缘12 cm以内的LARC(n=192),与直接手术相比,联合XELOX的同步CRT尽管取得了35.6%的病理完全缓解率(pCR),但是没有降低局部复发率(5.6% vs 4.3%,P=0.743),也没能带来生存获益(6年DFS 的HR=1.030,P=0.929;OS的HR=0.887,P=0.719;图1)。华西医院2011~2015年的一项研究资料表明,使用MRI和ERUS确定的距离肛缘10 cm以内的LARC(n=410),分为高危组(高危因素具有以下条件:T3浸润>5 mm、腹膜反折上方的T4a、LN直径>8 mm)和低危组,分别采用术前短程放疗(5×5 Gy)和直接手术,结果显示术前RT仅给高危组患者带来了生存获益,而与低危组3年局部复发率、远处转移率、DFS和OS比较差异均无统计学意义。这2项研究结果给我们的启示是:直肠癌的局部分期应该更加精细化,分层治疗势在必行,所有LARC患者均按照统一模式治疗显然会让很多患者过度治疗,从而带来了治疗相关毒性以及对功能的影响。
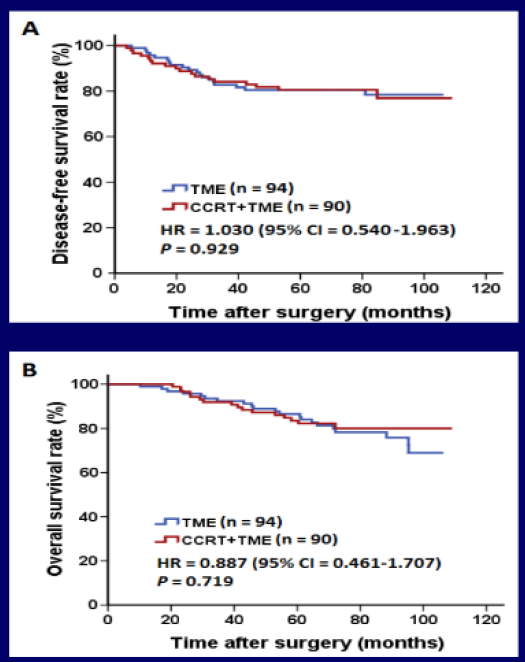
图1. 中山大学附属肿瘤医院的研究:LARC联合XELOX的CRT与直接手术相比的(A)DFS和(B)OS结果
因此,我们强烈推荐国内同事参考欧洲肿瘤内科学会(ESMO)直肠癌指南。自2013年开始,ESMO直肠癌指南首先提出了基于以“肛门指诊+直肠腔内超声+高分辨率盆腔MRI”联合一体的综合手段,对直肠癌进行术前精准分期,然后基于肿瘤位置(距肛缘距离)、T分期、N分期、肠壁外血管侵犯(EMVI)和直肠系膜筋膜(MRF)等因素对直肠癌的局部复发风险进行分级(也就是DISTANCE分期系统)。同样的肿瘤T/N分期,不同位置的危险度是不同的,位置越低,风险越高,最后根据复发风险程度选择不同的治疗模式。ESMO倡导的这种基于复发危险度的精细个体化治疗模式对传统意义上的“局部进展期直肠癌(即分期>cT3或N+)”具有更加重要的意义。
2017版的ESMO指南 这种精细化分层治疗的思想体现得更加明显。表1列举了2017版ESMO指南的分层治疗策略。很显然,传统意义上的LARC,在ESMO指南里LARC的风险分级遍布了好、中、差和极差4个级别,而对于好、中2个危险度分级的LARC,2017版指南推荐可以直接行TME手术。做出这些改变是因为一来术前基于MRI的淋巴结分期是不准确的;二来只要MRF清晰的cT3a/b,高质量TME手术后的局部复发率极低(<5%),因此术前新辅助治疗对该部分患者是否获益仍然未知,考虑到治疗的毒性,尤其是肠道和泌尿生殖系统的功能损害问题,推荐直接手术。需要强调的是,对于这部分患者,外科医生有义务判断能否做到高质量TME手术,这是关键。
关于术后辅助性放化疗的问题,也建议参考2017版ESMO指南,其对术后CRT给出了“充分且必要”、“充分”、“边缘充分”和“不充分也不必要”一共4种推荐(表2)。从该推荐可以看出,术后CRT决策中最重要的3个参数为TME手术质量、CRM状态、肿瘤距肛缘的距离。此外,整体的术后CRT推荐适应证严格于术前治疗的适应证,主要原因一是术后分期精准,二是术后CRT的毒性显著增加。比如,只要肿瘤位于腹膜反折上方(中高位),可做到高质量TME手术,即便pT4a(肿瘤应该位于前壁),也不主张术后CRT。但需要强调的是,这一点提醒我们外科医生,如果一个直肠癌患者需要放疗,应该术前进行而不是术后,切不可错误理解为术后CRT的适应证较术前更窄,因此抱侥幸心理先行手术,这是万万不可取的。
简言之,对于传统意义上的LARC,要采用高分辨率MRI检查进行精细分期和危险度分级,为了避免过度治疗,减少治疗毒性及对功能的影响,根据危险度进行精细化分层治疗尤为重要。符合下列条件者可不再推荐术前治疗,可以直接行TME手术: MRF-、EMVI-的低位cT3a/b、中高位cT3a/b且cN1-2直肠癌。同时,应该严格掌握术后辅助放疗适应证,对于需要放疗的LARC患者,应该坚定推荐使用术前治疗取代术后治疗,以减少术后治疗带来的功能影响。
哪些局部进展期直肠癌患者术前治疗中不需要放疗:单纯全身化疗
鉴于放疗对外科手术并发症及器官功能的影响,目前业界的一个研究方向是能否甄别出一部分LARC患者,用单纯的全身化疗取代标准的CRT,既能维持与CRT相似的较低局部复发率,又可以避免放疗的相关毒性,即“去放疗化”。
来自MSKCC的Ⅱ期先导性试验对Ⅱ/Ⅲ期直肠癌患者采用FOLFOX/贝伐单抗诱导化疗后行手术切除,而仅对诱导化疗后疾病稳定或进展的患者术前加行放化疗。32例受试者均获得R0切除,4年DFS达84.0%(95%CI:67.0%~94.0%)。
FOWARC研究结果表明,尽管单纯新辅助FOLFOX化疗组的pCR率是3个组中最低的(6.6% vs 5-FU-RT组的14.0%、FOLFOX-RT组的27.5%,顺序下同),但降期率与5-FU-RT组相似(35.5% vs 37.1%和56.4%)。在2018年更新的最终疗效分析中,3个组的局部复发率(8.9% vs 10.0%和8.5%)、3年DFS(75.7% vs 76.4%和77.8%)、OS(92.2% vs 93.7%和92.0%)差异均无统计学意义。
这些结果为部分LARC患者采用单纯化疗取代放疗带来了希望,目前国内外针对该热点有多个大型研究正在进行,但尚未有肯定性结论。而事实上,在我国的常规临床实践中,由于多数医院放疗设备及资源配置欠缺,以及多数外科医生对放疗的担忧,很多地方已经开始使用单纯化疗作为LARC的术前治疗,这也算符合我国实际国情的临床举措。但鉴于单纯化疗获得的肿瘤退缩依然是最差这一事实,目前该类研究的设计均会排除治疗上更需要肿瘤退缩的LARC,主要包括极低位置、T4b或MRF阳性的肿瘤,业界的基本共识还是认为这类危险度较高的肿瘤不适合单纯化疗。例如正在进行的该类研究,也是目前全球最大型的北美Ⅲ期随机对照研究PROSPECT(NCT01515787),入组标准排除了距肛缘<5 cm和T4b的LARC患者。因此,笔者建议我国的同仁在临床实际的治疗选择中也参考这些共识,以最大程度保护患者的权益。笔者所在中心目前也正在进行一项LARC患者接受术前CAPOX单纯化疗对比CRT的研究(NCT02288195),入组标准与PROSPECT相似。而在此基础上,我们中心刚刚启动了术前FOLFOXIRI单纯化疗对比CRT的FAVORE研究(NCT 03671252),探索强化全身化疗后能否让更多患者避免放疗,同时改善远期生存。这些研究结果值得期待。
通过术前治疗策略带来手术模式改变而保全器官功能
该策略的主要目标是通过术前治疗后的肿瘤退缩(tumor regression grading ,TRG)程度,将直肠癌的手术治疗模式“从大变小,从小变无”:显著的肿瘤退缩,使原本需行APR手术的患者可以施行括约肌保留的根治术式(LAR或ISR),乃至经肛门的局部切除术,而完全消退者,即达到临床完全缓解 (complete clinical regression,cCR),可以考虑施行“观察&等待策略(Watch & Wait,W&W策略)”。由此可见,某种意义上肿瘤退缩程度决定了手术模式。
3.1 术前治疗模式中强化肿瘤退缩的策略
早在10年前,德国CAO/ARO/AIO 94研究已证实术前放化疗由于肿瘤退缩,较直接手术可显著增加初诊不能保肛患者的保肛手术率(39% vs 19%,P=0.04),从外科角度看,对于临界可保肛的肿瘤,比如距肛缘3~5 cm的肿瘤,更多的肿瘤退缩让手术有了安全切缘。另外,已经有研究证实,接受术前CRT治疗后,直肠肠管的远切端也许1 cm就足够,这也在很大程度上提高了保肛机会。那么,如何在现有标准术前治疗模式的基础上进一步增加肿瘤退缩呢?目前业界的探索及进展有以下几种。
3.1.1 强化局部放疗 增加局部放疗的剂量,甚至应用直肠腔内的近距离放疗,可能有助于肿瘤退缩。2015年丹麦APPELT等报道了51例远端直肠癌患者接受高剂量放化疗的前瞻性临床研究结果,直肠肿瘤予60 Gy/30 F、淋巴结引流区予50 Gy/30 F外照射后,采用后装治疗给予直肠肿瘤5 Gy推量,同期口服氟尿嘧啶化疗。11例患者仍有肿瘤残留,接受TME手术;40例患者达到cCR后接受W&W策略,中位随访23.9个月后,9例患者复发,3例远处转移;中位复发时间为10.4个月,所有复发均出现在治疗后2年内,并且都得以行根治性切除术,术后并发症发生率和11例放化疗后即接受手术的队列相当;观察组患者获得较高的生活质量,约70%的患者治疗完成后未出现大便失禁。笔者认为该研究cCR比例明显高于其他研究,一方面与入组病例限定为T2-3N0-1M0有关,另一方面是高剂量放疗同样起到了提升肿瘤缓解的作用。但后装推量的方法导致肿瘤附近直肠黏膜照射总剂量超过100BED 2Gy,造成了观察组中7%的患者治疗后出现3级直肠出血。从外科的角度看,鉴于总体cCR比例偏低,即对于大多数患者来说最终仍然需要手术,而增加剂量放疗对术后并发症的影响可能更大,因此笔者对于此模式持谨慎态度。
3.1.2 强化CRT中的化疗 口服卡培他滨或使用持续静脉输注的小剂量5-FU是目前CRT模式中的标准化疗类型,为了提高CRT疗效,业界尝试了多种新型化疗模式,在CRT中加入奥沙利铂、伊立替康以及靶向药物西妥昔单抗或贝伐单抗,靶向药物的尝试均以失败而告终。研究最多的是在术前CRT中加入奥沙利铂,全球的大型Ⅲ期研究一共有6个:ACCORD-12、STAR-01、R-04、CAO/ARO/AIO-04、PETACC-6和中国FOWARC研究。从改善生存的角度看,仅有德国研究AIO-04是阳性,但目前并没有改变临床实践。从肿瘤退缩pCR的角度看,AIO-04(17% vs 13%)、FOWARC研究为阳性研究(29% vs 13%),ACCORD-12研究为边界阳性(19% vs 14%)。而从TRG0/1(即包括显著缓解和完全缓解)的指标看,ACCORD-12研究(39.4% vs 28.9%,P=0.008)和FOWARC研究(68.8% vs 48.4%)均为阳性。从这些研究结果看,奥沙利铂的加入在某种程度上提高了肿瘤退缩,尤其是中国FOWARC研究,pCR率和显著率均达新高。如果我们仔细分析中国研究和其他国际研究的不同之处可以发现,国际研究的奥沙利铂使用方法完全按照“放疗增敏剂”的模式,一般是每周50~60 mg/m2,与放疗同步使用5周,而这个剂量强度和全身化疗是完全不同的。FOWARC研究则是将奥沙利铂以标准的全身化疗模式mFOLFOX6和放疗同步,剂量为85 mg/m2,2周。无独有偶,笔者所在单位自2004年以来一直采用全身化疗模式的CAPEOX和放疗同步进行CRT治疗,奥沙利铂剂量为130 mg/m2(70岁以上减为100 mg/m2),3周;卡培他滨 1 000 mg/(m2·d),d1~14,每3周重复;在整个为期5周的放疗期间,刚好化疗2个周期。分析2010~2017年共728例资料完整的LARC患者(结果尚未正式发表),其中卡培他滨单药同步CRT组192例,CAPEOX同步CRT组536例,结果显示pCR从17.7%提高到30.8%(P<0.001);TRG0/1从40.1%提高到61.4%(P<0.001),我们的结果也提示获得pCR者OS显著延长。
结合分析中山大学肿瘤医院的数据和FOWARC研究的数据(我中心并未参与FOWARC研究),两个完全独立的数据显示在中国患者群体中,这种含有奥沙利铂的标准全身化疗与放疗同步的模式能够显著提高肿瘤退缩和pCR率,而关于国际学界担心的耐受性问题,在中国患者中似乎不是问题,FOWARC研究中mFOLFOX6同步CRT组放疗完成率为90%,术前化疗完成率为94%,较标准FU单药同步CRT组均未降低,还有数值上的优势。我们中心的资料显示能完成计划性CAPEOX同步CRT的患者比率高达96%以上。
总之,关于CRT中加入奥沙利铂的问题,尽管目前国际上不主张使用,但笔者的观点是不能一概否定其价值,如果我们治疗的目标是最大限度的肿瘤退缩以达到保全括约肌功能时,值得重新审视奥沙利铂的价值。此时应该把奥沙利铂当做标准全身化疗模式而不是放疗增敏剂的模式来使用,这一使用方式的调整是否是导致肿瘤退缩显著增加的主要原因呢? 笔者认为值得进一步研究。目前中山大学肿瘤医院正在进行一项大型Ⅲ期随机对照试验来验证该模式的效率(NCT02031939)。复旦大学肿瘤医院章真教授领衔的CinClare研究则在探索伊立替康用于术前CRT的价值(NCT02605262),敬请大家关注这些研究的进展。
3.2 TNT模式:强化全身化疗并延长CRT结束到手术的间隔
“三明治”模式在近10年的演变过程中,变化最大的是逐渐延长的手术等待间歇期(从CRT结束到TME手术的间期),美国国家癌症综合网络(NCCN)指南推荐从最初的4~6周延长到5~8周,再到现在的5~12周;而在逐渐延长的间歇期内,可以给予更多的全身化疗,由于间隔时间延长和间歇期化疗的双重作用,肿瘤进一步退缩,更多患者可以接受W&W策略或保肛手术,同时化疗强度增加后有望进一步降低远处转移率,提高远期生存率。这就是“全程新辅助治疗(total neoadjuvant therapy,TNT)”的理念雏形:将更多或全部的全身化疗从ACT模式前移到手术之前,变为新辅助化疗(neoadjuvant chemotherapy,NeoCT)模式,而将TME手术变为LARC治疗模式中的最后一个环节。
根据全身化疗与放化疗/放疗的顺序,TNT模式又可以分为两种:NeoCT-CRT/ SCPRT-TME或CRT/SCPRT-NeoCT-TME(图1)。但不管哪一种模式,TNT策略期望达到的潜在优势都是一致的:提高全身化疗依从性和完成率,增加肿瘤缓解程度,提高保肛率或非手术治疗率,最终延长生存期。
2017年ASCO会议上纽约纪念斯隆凯瑟琳癌症中心(MSKCC)报道的628例回顾性大宗病例对比分析,是TNT模式1的经典代表。308例TNT组患者先行8程FOLFOX方案或5程CAPOX方案化疗,再行放化疗的模式(NeoCT-CRT-TME),320例接受常规治疗模式(CRT-TME-ACT)。TNT组全身化疗依从性显著提高,未出现更多肿瘤,使21.8%的患者因此没有接受手术治疗并且在CRT结束12个月时依然处于无瘤状态,但对照组常规CRT模式里,该比例仅为5.9%。尽管这种TNT模式治疗最终并未带来生存获益,但意外发现该模式能让更多患者由于肿瘤完全缓解而接受W&W策略,从而保全器官功能。
放化疗后肿瘤的退缩程度取决于肿瘤本身内在对射线和化疗药物的敏感性、放疗的剂量、化疗的强度以及治疗结束至复查的时间,其中放疗结束至复查的间隔时间尤为重要。这就是TNT模式2的基本理念。STOCKHOLM Ⅲ研究中短程放疗结束后1周和4~8周后手术组的pCR率分别为1.7%和11.8% 。而意大利21个中心2 113例局部进展期直肠癌病例依据术前新辅助放化疗和手术间隔时间分组统计,间隔6周以内、间隔6~12周和间隔13周以上的pCR率分别为12.4%、22.9%和30.8%(图2),每增加1周等待时间pCR率提高1.5%,多因素分析也显示间隔时间是影响能否达到pCR的显著因素。因此,MSKCC报道的Ⅱ期临床研究、RAPIDO研究和STELLAR研究的试验组均采用了先长程放化疗或短程放疗(short-course radiothearpy,SRT)后增加间隔期化疗的TNT策略。对于接受CRT者来说,该模式很好地利用了放化疗结束后6~8周的等候期,可以节约时间,比较符合患者的治疗意愿。而对于采用短程放疗模式的患者来说,如想获得更多的肿瘤退缩,TNT模式是必须的,因为传统的术前短程放疗(5×5 Gy)结束后1周立即手术几乎没有肿瘤退缩和pCR。
总之,以强化术前全身化疗、延长手术等候间隔为标志的TNT模式,是目前LARC术前治疗策略中能带来最大程度肿瘤退缩的治疗模式,为器官功能保全提供了肿瘤学基础。就笔者目前的临床实践而言,如果按照计划进行手术会面临肛门括约肌功能丧失或极大损伤的低位直肠癌,且在前期的CRT治疗后肿瘤退缩明显,有cCR趋势的患者,笔者会积极践行TNT模式治疗,以期达到cCR,然后进行W&W策略以最大程度保全器官功能。而其他情形下则不会刻意做TNT,除非是临床研究。
基于肿瘤退缩的器官功能保全策略
基于肿瘤退缩乃至完全消失而衍生出来的直肠癌器官功能保全策略有以下几种。
4.1 器官毁损性TME手术变为括约肌保留性TME手术
对仍然需行TME手术的LARC患者,部分初始需要行APR手术,主要是肿瘤位于保肛临界位置(如距肛2~4 cm),当术前治疗带来显著肿瘤退缩后,保肛手术变为可能,包括LAR、ISR等。这早在AIO-94研究里已经被证实。作为结直肠外科医生,笔者对这一点亦有同感。
4.2 TME手术变为经肛门局部切除术
术前治疗使肿瘤显著退缩,但未达到cCR,比如肿瘤体积较小的ycT1N0,虽然无法进行W&W策略,但可以缩小手术范围,从原来的TME术变为经肛门局部切除术(local excision,LE),从而避免肛门毁损性APR,或LAR及其带来的LARS,最大限度保全器官功能,这也是近年从外科技术层面探索的方向之一。法国GRECCAR 2研究将低位、T2-3、肿瘤<4 cm且术前放化疗后肿瘤消退较好的患者随机分至TME组和LE组,由于LE组近一半患者需再次接受TME手术,研究未能证实LE优于TME,且二次手术可能增加术后并发症,此外利用多种手段准确评估肿瘤的退缩程度可能避免不适宜人群接受LE。而一旦筛选出适宜接受LE手术的群体,将极大改善患者的器官功能。另外需要关注的还有一类早期(ESMO危险度分级极好、好和部分中)极低位直肠癌患者,目前标准治疗是无需术前治疗,直接手术,但如果临床医生考虑手术会导致功能损失较大,则可转而寻求术前新辅助治疗,尽管目前指南尚未做标准推荐。有限的数据表明,这些早期患者如果接受术前治疗,可更容易达到肿瘤明显退缩乃至完全缓解,为缩小手术乃至进行W&W策略提供了可能性。
4.3 需要手术变为非手术治疗
基于肿瘤完全消退,即cCR后的W&W策略,这毫无疑问是近年关于LARC器官功能保全研究最热门的话题。从最早2004年巴西学者Habr-Gama教授的数据,到最近“国际观察等待数据库”(IWWD),越来越多数据表明,对于经过严格评估达到cCR的直肠癌患者,W&W是一种可行的、安全的处理方法,这种非手术治疗模式是对患者功能(直肠括约肌功能、膀胱功能和性功能)最佳的保全策略,但也面临着不少问题:首先,目前的治疗模式,LARC中能达到cCR的患者比例过低(20%左右);其次,在观察等待过程中需进行主动的、密切的监测随访,这需患者有很好的依从性,一旦发现“肿瘤再生长”,即给予积极挽救性干预;再次,治疗前难以准确预测获cCR患者,因此业界将这种完全缓解称之为“机会性完全缓解”。
W&W策略的核心和难点在于如何准确判断cCR乃至pCR。目前cCR判断的四大标准:肛门指诊、内窥镜、活检及MRI检查,其中临床医生的肛门指诊对判断肠壁病灶是最重要的,而动态的MRI检查则为肠壁原发灶和系膜淋巴结判断提供更有用的信息。对于这部分患者,cCR后给予W&W是一种可以推荐的治疗模式,也写入了2017年的ESMO直肠癌指南,但临床实践中需要详细告知患者并作出决策。总之,对于LARC,术前治疗后出现“机会性”肿瘤完全缓解的患者,当有功能保全考量时,临床医生应该知道W&W策略是一种选择。
结语
局部进展期直肠癌治疗过程中面临的器官功能困境是多方面的,从治疗前的诊断评估就应该高度关注功能保全问题,采用以高分辨率MRI为基础的术前精准分期、局部危险度分级是第一步,然后在保证肿瘤根治的基础上,根据器官功能面临的具体问题采用个体化分层治疗,灵活应用直接手术、术前治疗后再手术、缩小手术乃至不手术等各种具体治疗模式,以最大限度保全患者的器官功能。











 苏公网安备32059002004080号
苏公网安备32059002004080号


