2019年美国临床肿瘤学会(ASCO)已经结束,但众多的研究进展仍值得大家回味。来自中山大学肿瘤防治中心的蔡修宇教授对肺癌领域免疫治疗热点进行了盘点,分为新辅助治疗、局部晚期治疗、晚期治疗和疗效预测四部分呈现给大家。

中山大学肿瘤防治中心 副主任医师
中国临床肿瘤青年委员会(CSCO Young) 常委
中国临床肿瘤学会(CSCO)免疫治疗专家委员会 委员
中国临床肿瘤学会(CSCO)智慧医疗专家委员会 委员
中国抗癌协会(CACA)肿瘤临床化疗专业委员会 常委
中国抗癌协会(CACA)肿瘤标志专业委员会 委员
广州市中青年肿瘤医师论坛 主席
广州市抗癌协会肿瘤复发与转移专业委员会 主任委员
广东省胸部疾病学会免疫治疗专业委员会 候任主任委员
广东省健康管理学会肿瘤防治专业委员会 常委
广东省保健协会肿瘤防治专业委员会 秘书长
广东省中西医结合学会肿瘤专业委员会 秘书长
Journal of Clinical Oncology 杂志中文版 审稿人
今年ASCO并未像之前大会那样,有诸多新的大型Ⅲ期随机对照试验亮相,主要是更新了之前几个重要研究的亚组数据或生存数据。同时也让我们看到了免疫联合抗血管或其他靶向药的新型组合模式,有可能对后线患者或免疫耐药患者带来获益。
一、IMpower150:显著降低基线肝转移患者疾病进展风险和死亡风险(ab9012)
今年ASCO公布了IMpower150研究中基线肝转移NSCLC患者的特征与缓解率。研究将1202例意向性治疗(ITT)患者按1:1:1的比例随机接受Atezolizumab+贝伐珠单抗+卡铂+紫杉醇(ABCP)、Atezolizumab+卡铂+紫杉醇(ACP)、贝伐珠单抗+卡铂+紫杉醇(BCP)治疗。
主要终点为ITT野生型患者的总生存(OS)与无进展生存(PFS)。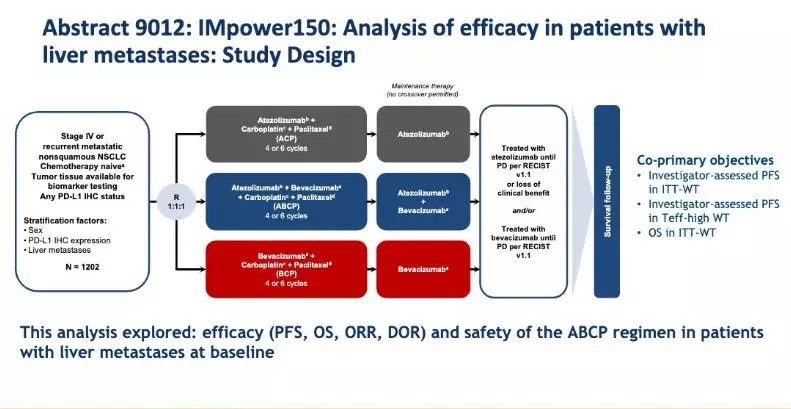
图1 研究设计
研究中共有162例基线肝转移患者(ABCP组,n=52;ACP 组,n=53;BCP组,n=57)。与BCP组相比,ABCP组患者的PFS和OS均有延长,中位PFS分别为8.2月 vs 5.4月(HR=0.41),中位OS分别为13.3月 vs 9.4月(HR=0.52)。肝转移患者接受ABCP、ACP和BCP方案的3-4级治疗相关不良事件(TRAE)发生率分别为52.1%、36.5%和54.5%。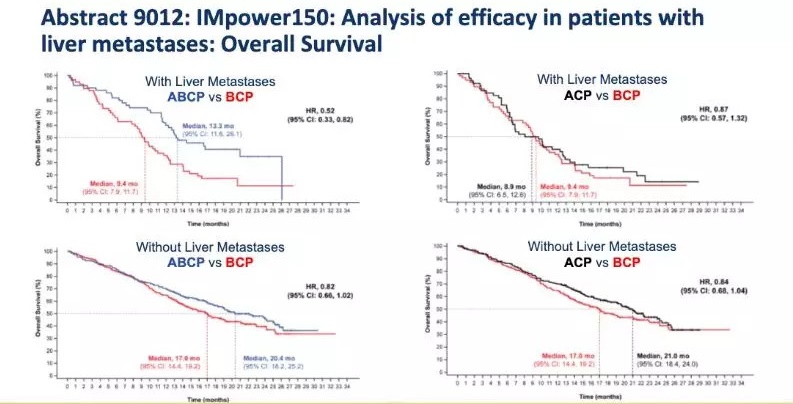
图2 OS数据
目前免疫单药或联合化疗在晚期NSCLC患者一线治疗中的获益已经明确,而IMpower150证实了肺癌肝转移人群在化疗基础上接受免疫联合抗血管治疗优于标准的化疗联合抗血管治疗。且不论PD-L1表达及EGFR/ALK状态如何,ABCP方案都能显著降低患者的疾病进展风险(59%)或死亡风险(48%),意味着驱动基因阳性患者也可从ABCP治疗方案中得到更多获益。
二、Keynote189:一线免疫联合化疗无需考虑PD-L1表达水平(ab9013)
Keynote189研究比较帕博利珠单抗+化疗对比单纯化疗在非鳞NSCLC患者中的疗效,经过更长时间的随访,研究者发现,无论患者PD-L1的表达水平,一线使用免疫联合化疗均在转移性非鳞NSCLC中显示出明显的生存获益。
研究受试者发生疾病进展(PD)时,允许化疗组交叉至免疫治疗组。PFS2定义为自患者随机化至二线治疗疾病进展或死亡的时间。
结果发现,不论PD-L1表达情况如何,帕博利珠单抗联合化疗效果都优于化疗。免疫联合化疗组继续显示出更长的OS(22.0月 vs 10.7月,HR=0.56,P<0.00001)和PFS(9.0月 vs 4.9月,HR=0.48,P<0.00001)。并且在所有PD-L1 TPS组中都观察到了临床获益。
表1 不同PD-L1 TPS组生存结果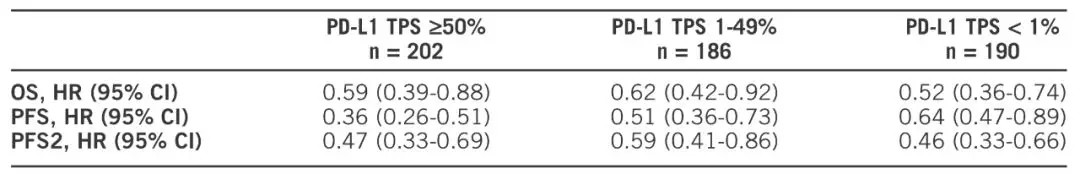
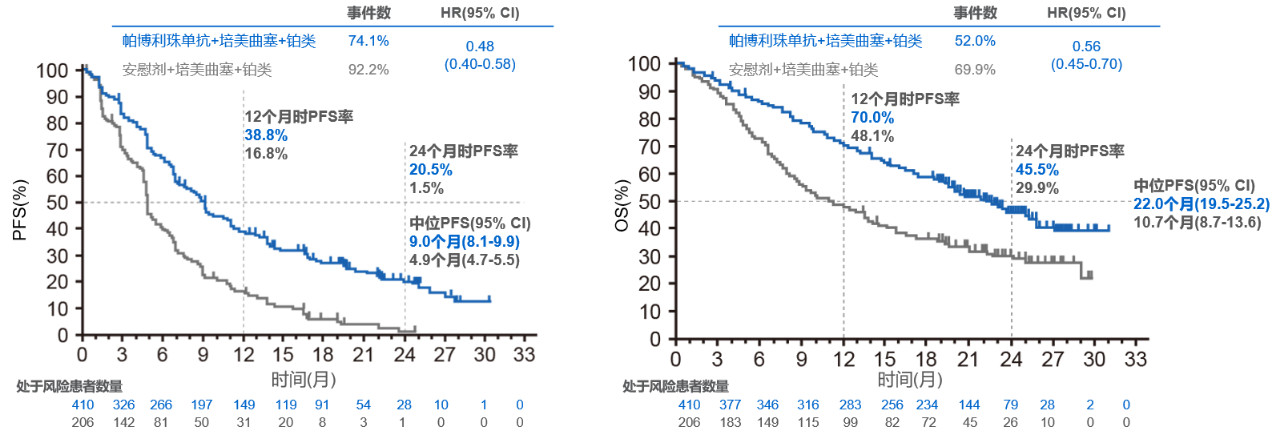
图3 两组患者PFS率和OS率
在免疫联合组有45%患者接受了二线治疗,化疗组有59%(其中54%在二线添加了免疫治疗)。结果发现,一线使用免疫联合化疗患者二线PFS2仍较长(17.0月vs 9.0月,HR=0.49,P<0.00001),不同PD-L1 TPS组间没有差异。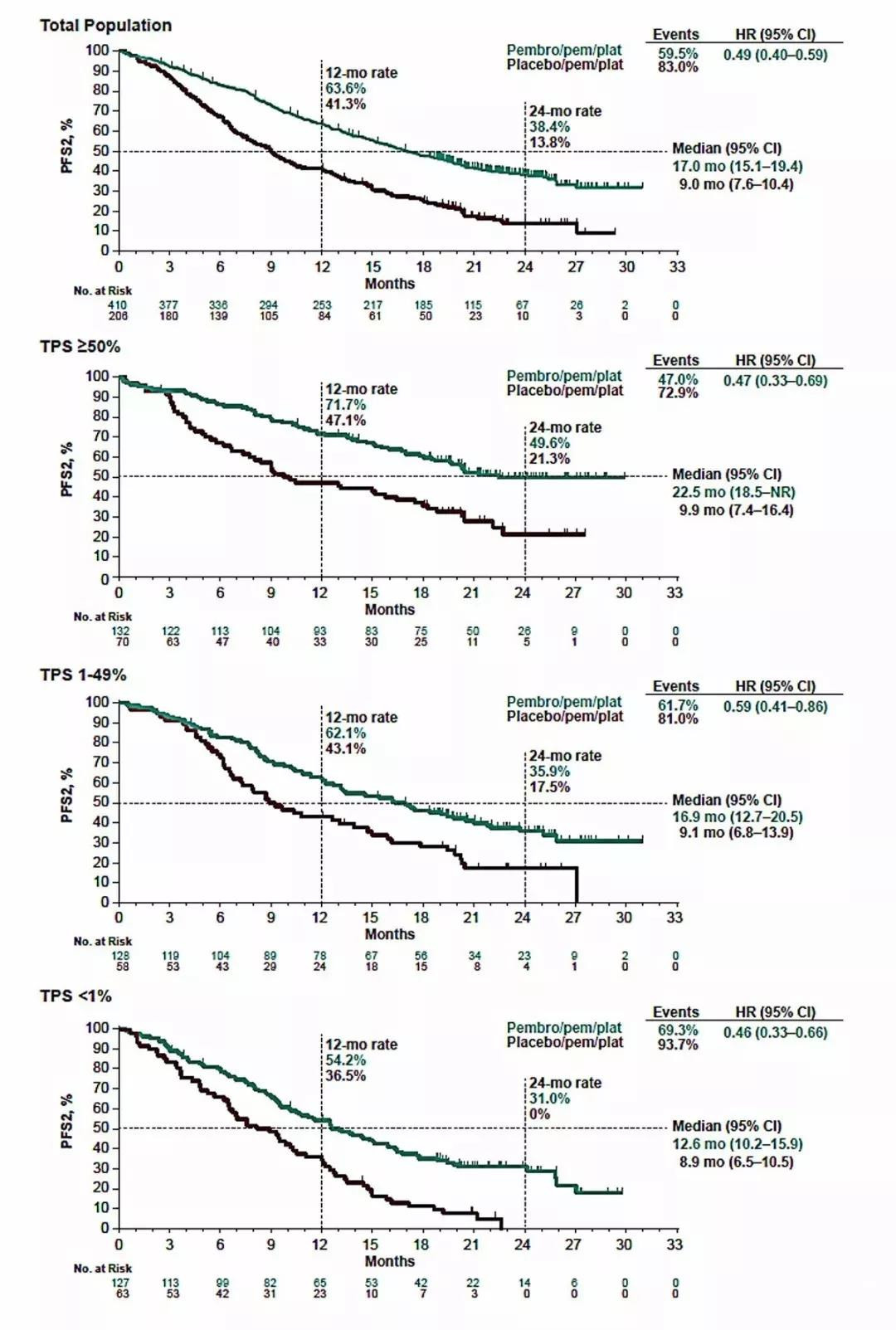
图4 总人群及不同PD-L1 TPS组PFS2率
由此得出,一线使用免疫联合化疗在转移性非鳞NSCLC的OS数据中显示出明显的获益,无论PD-L1 TPS如何,帕博利珠单抗都应作为一线治疗应用于临床实践。
三、Keynote 001:帕博利珠单抗单药治疗NSCLC患者5年生存率达到23.2%,PD-L1依然为伴随诊断(ab9015)
Keynote 001是第一项评估帕博利珠单抗治疗晚期NSCLC患者的Ib期研究,共纳入未经治疗或经治NSCLC患者550例(未经治疗101例,经治治疗初始449例),分别随机至2mg/kg q3w、10mg/kg q2w或q3w的给药方案。
本次ASCO会议更新了患者5年长期随访结果,发现帕博利珠单抗治疗初治患者的5年OS率为23.2%,其中PD-L1高表达患者(TPS≥50%)达到了29.6%,PD-L1阳性患者(TPS 1%~49%)达到了15.7%。对于非一线治疗的患者5年OS率为15.5%,其中PD-L1高表达的患者达到25%,而PD-L1阴性的患者(TPS≤1%)只有3.5%。
毋庸置疑,K药的疗效还是依赖于PD-L1这一金指标来预测。
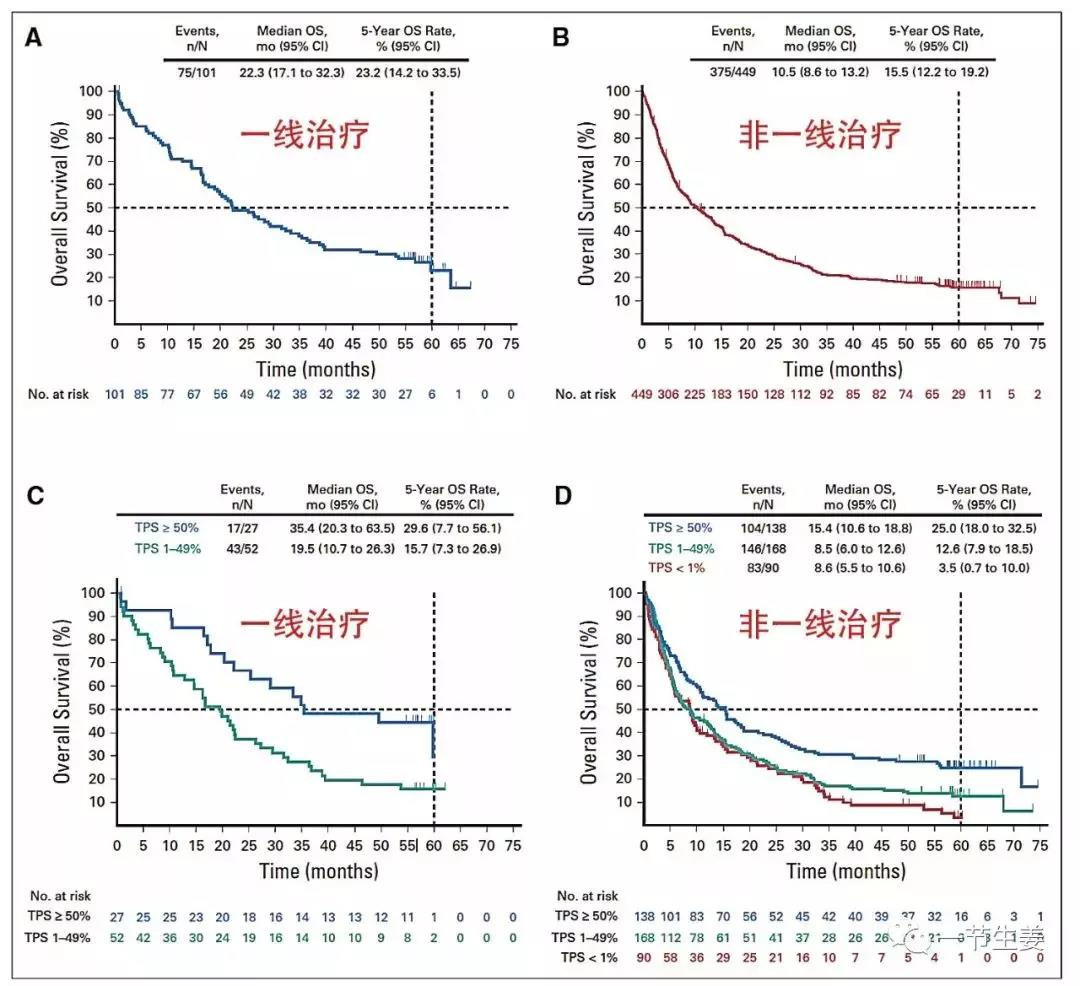
图5 总人群及不同PD-L1 TPS组帕博利珠单抗一线及非一线治疗的OS率
四、Lung-MAP S1400I:肺鳞癌患者接受纳武利尤单抗+Ipilimumab双免疫联合治疗未能进一步获益(ab9014)
Lung-MAP S1400I是一项对比纳武利尤单抗联合Ipilimumab对比纳武利尤单抗单药在经治IV期肺鳞癌患者的III期临床研究,结果显示,双免疫联合治疗肺鳞癌患者的生存预后未得到明显改善。
该研究招募未接受过免疫治疗的经治肺鳞癌患者,不论PD-L1表达水平,按1∶1分配至纳武利尤单抗+Ipilimumab组和纳武利尤单抗组。研究主要终点是OS,次要终点是研究者评估的PFS、缓解率和安全性。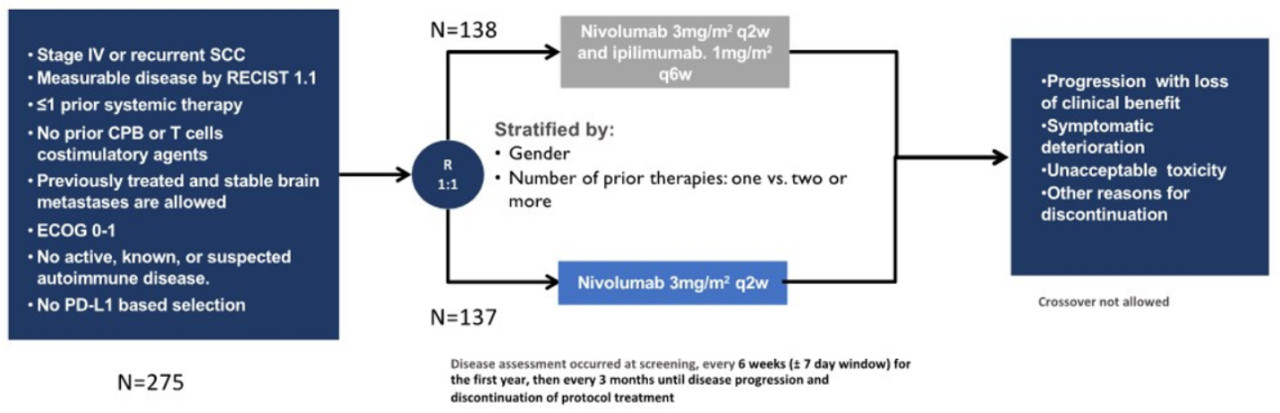
图6 研究设计
研究共纳入275例患者,两组基线特征相似。纳武利尤单抗+Ipilimumab组与纳武利尤单抗组的中位OS分别为10.0月 vs 11.0月(HR=0.97,P=0.82),中位PFS分别为3.8月 vs 2.9月(HR=0.84,P=0.19);两组缓解率分别为18%和17%。基于PD-L1和肿瘤突变负荷(TBM)亚组的结果如表2所示。 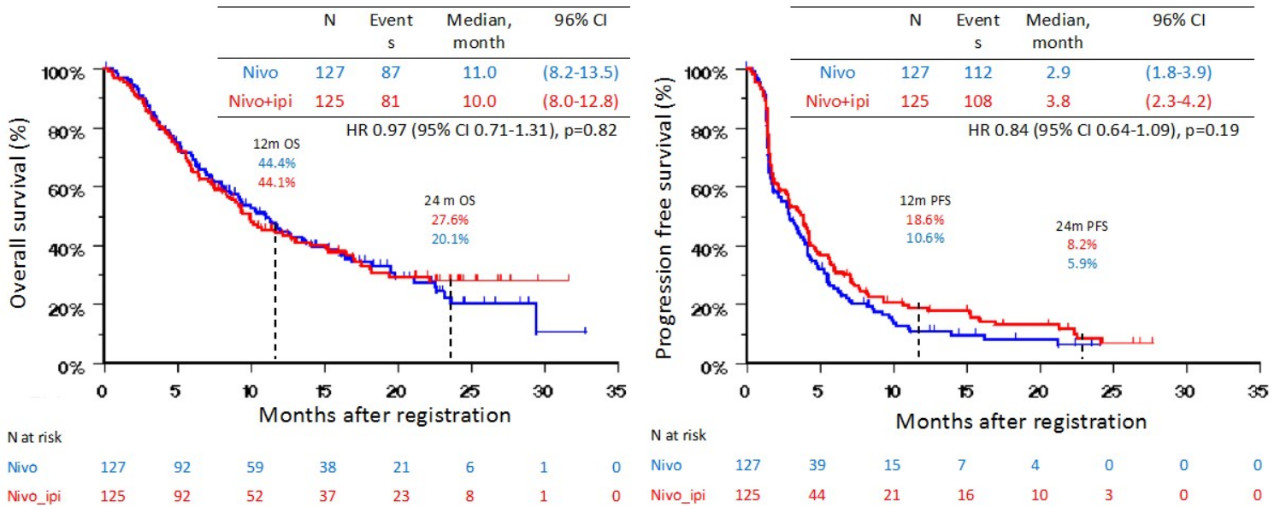
图7 两组OS和PFS结果 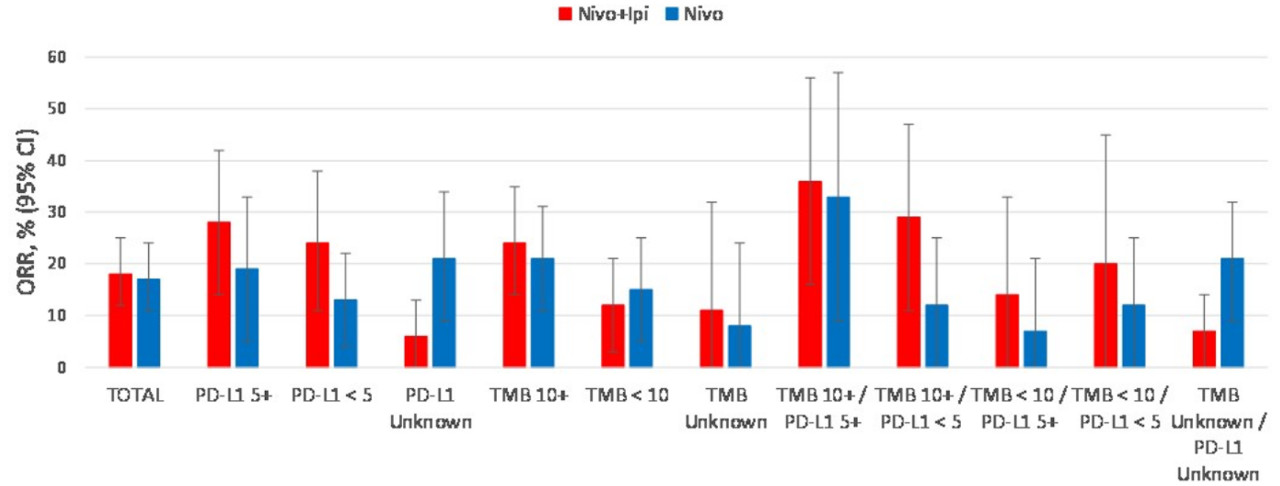
图8 两组客观缓解率(ORR)
表2 不同PD-L1和TBM亚组的OS和PFS结果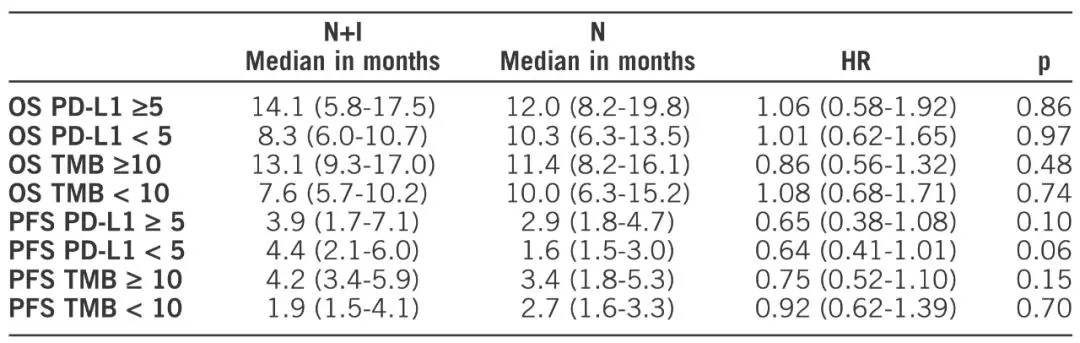
纳武利尤单抗+Ipilimumab组有48例(39%)患者发生3级及以上治疗相关的不良事件,纳武利尤单抗组有38例(31%);两组分别有25%和16%的患者因药物相关不良事件导致停药。
表3 两组不良事件发生率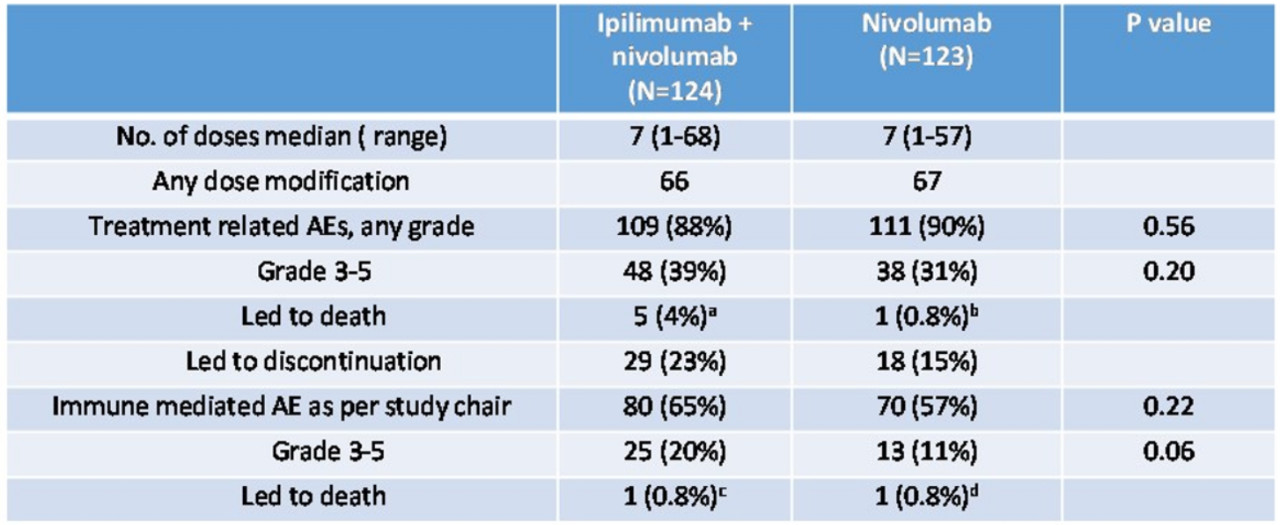
该研究结果表明,双免疫联合治疗未能明显改善肺鳞癌患者生存预后,两组毒性亦无差异。
五、国产PD-1卡瑞利珠单抗联合阿帕替尼治疗EGFR和ALK野生型非鳞NSCLC患者疗效显著,尤其对于高bTMB患者(ab9112)
该研究为多中心、开放1/2期临床研究,旨在评估卡瑞利珠单抗联合阿帕替尼治疗晚期NSCLC患者的有效性和安全性。初始组接受2种剂量水平的阿帕替尼250mg/d或375mg/d,卡瑞利珠单抗200mg q2w。根据I期研究结果,后扩展组选用了阿帕替尼250mg/d的剂量。研究纳入了96例晚期非鳞NSCLC患者,其中23例接受过二线及以上的系统治疗,73例接受过一线治疗。主要研究终点为ORR。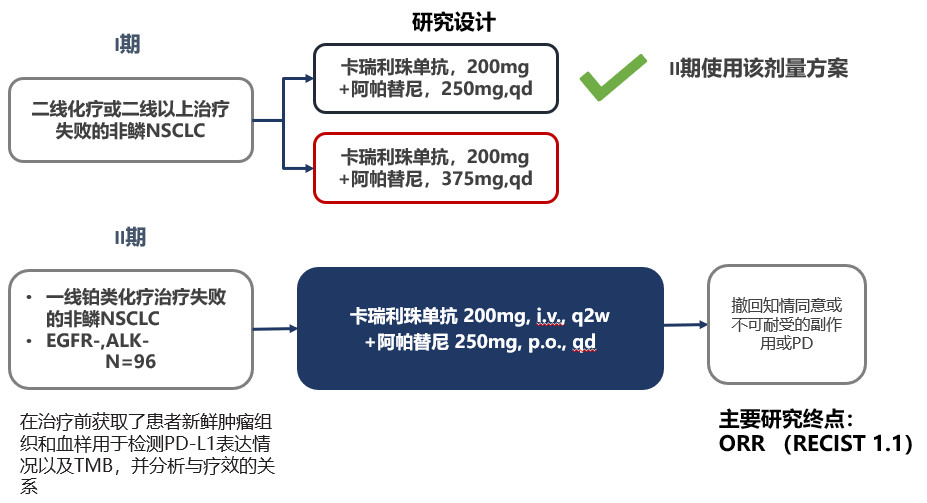
图9 研究设计
结果显示,在91例可评估的患者中,总体ORR为30.8%,疾病控制率(DCR)为81.3%。中位PFS为5.9个月。在所有96例患者中,83例患者进行了bTMB检测,通过ROC曲线计算其临界值为1.54 muts/Mb。高bTMB患者ORR达52.6%。在数据收集截止时,有29例受试者仍在接受治疗。
表4 研究结果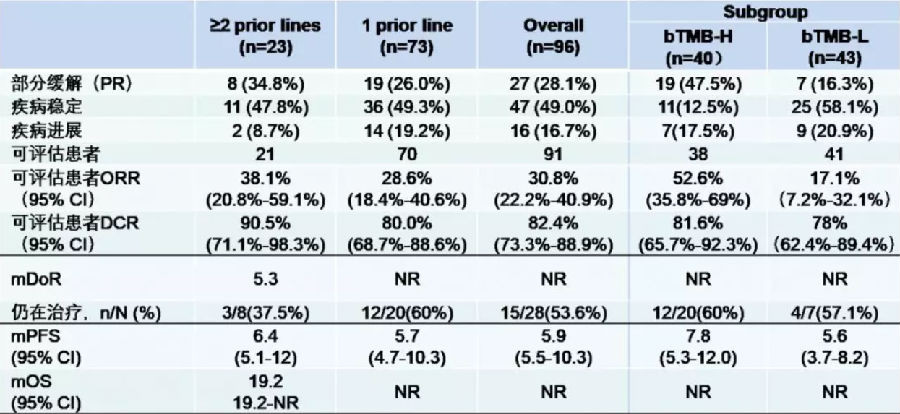
常见的TRAE包括高血压、手足综合征、蛋白尿、谷氨酰胺转移酶升高、肝功异常和碱性磷酸酶升高等。安全性方面,观察到的不良事件主要与阿帕替尼相关,可以通过调整阿帕替尼给药频次进行管理。
该研究结果提示,卡瑞利珠单抗联合阿帕替尼治疗晚期非鳞NSCLC显示出良好的抗肿瘤效果,尤其是对于高bTMB的患者,且安全性可控。后续仍需前瞻性研究来进一步确认此临床结果以及bTMB作为疗效预测因子的有效性。
六、高选择性AXL抑制剂Bemcentinib(BGB324)联合帕博利珠单抗治疗晚期NSCLC安全性良好(ab9098)
AXL是一种参与上皮-间质转化的酪氨酸激酶,间质转化是包含PD-1在内的多种治疗耐药的原因。Bemcentinib(BGB324)是一种口服、高选择性、强效的AXL抑制剂,临床前研究已被证明可以增强PD-1疗效。
在此项II期单臂研究中,对48例初治IV期肺腺癌患者给予Bemcentinib(200mg/d)联合帕博利珠单抗 (200mg q3w)治疗。结果显示,在29例可评估疗效的患者中,7例(24%)评估为部分缓解(PR),ORR为24%。对于AXL阳性的患者,ORR达到40%。5例应答者中4例患者(80%)PD-L1阴性或弱阳性。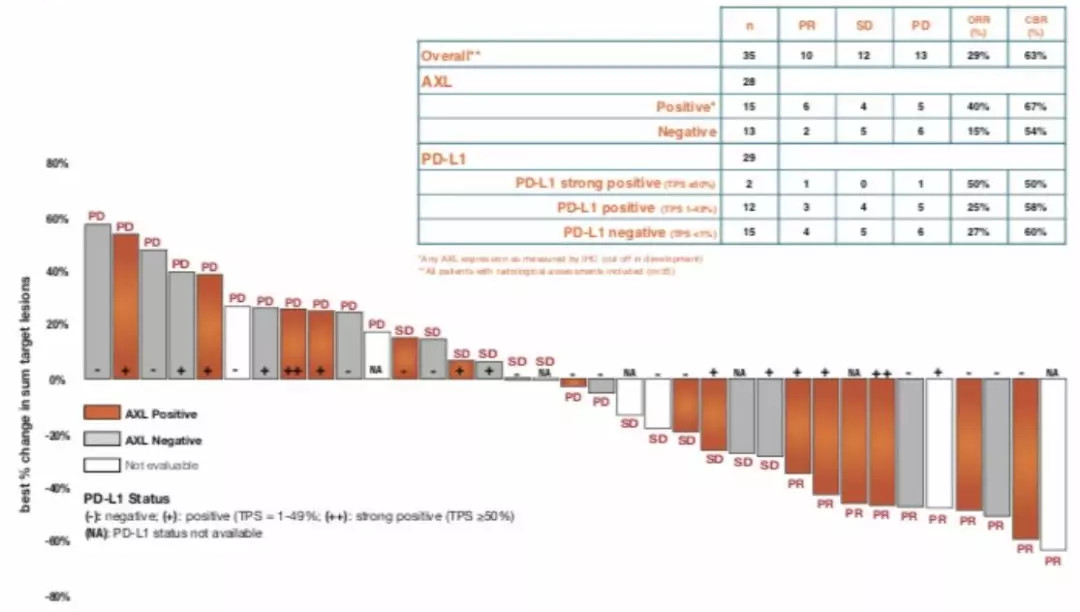
图10 总人群及不同亚组患者的应答情况
在第一阶段,中位PFS为4.0个月(95% CI 1.9-NR), AXL阳性患者(n=10)为5.9个月(3.0-NR)。中位OS还不成熟。最常见的TRAE(发生率>15%)是转氨酶升高(37%)、腹泻(29%)和乏力(17%)。
结论:Bemcentinib联合帕博利珠单抗耐受性良好,尤其是在AXL阳性患者中,具有良好的应用前景。
七、HDAC抑制剂联合帕博利珠单抗对耐药后患者也有效(ab9073)
Vorinostat是已经获批的组蛋白去乙酰化酶抑制剂(HDAC)抑制剂,适应证是皮肤T细胞淋巴瘤。
今年ASCO更新了口服Vorinostat联合帕博利珠单抗治疗晚期NSCLC的I/Ib期临床数据。I期采用帕博利珠单抗200 mg q3wk+Vorinostat 200或400mg/d po治疗(未接受免疫治疗或免疫治疗耐药患者均纳入),Ib期则要求在之前的免疫检查点抑制剂(ICI)治疗基础上取得进展。
主要终点是安全性/耐受性;次要终点包括RR、PFS、缓解持续时间(DOR)和OS。并收集患者治疗前后的组织和血液标本进行相关分析,以确定肿瘤基因表达的变化、T细胞密度和髓系来源的抑制细胞的水平。
表5 患者基线特征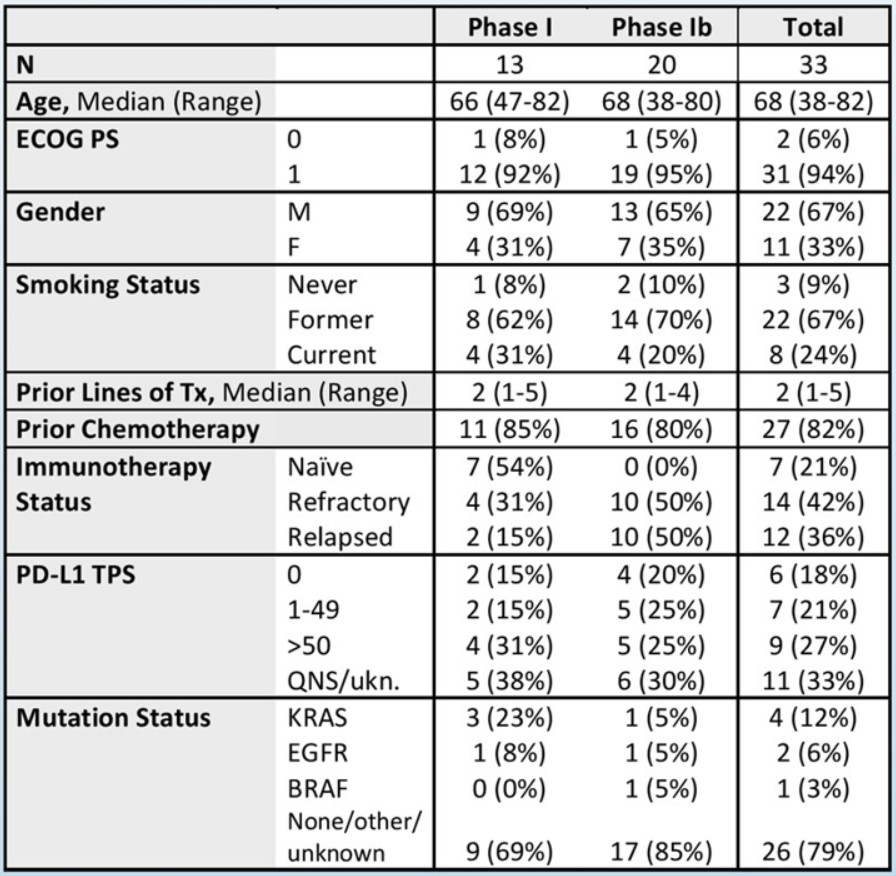
第一阶段:治疗13例(4例200 mg,9例400 mg V剂量);第二阶段:20例。中位年龄:68岁(38-82岁);女性11例(33%);ECOG 1分31人(94%);从未/曾经/现在吸烟者:3/22/8(9%/67%/24%)。PD-L1表达:8/33(18%)<1%,7/33(21%)为1%-49%,9/33(27%)为≥50%,11/30(33%)为未知。研究中未观察到剂量限制毒性或治疗相关死亡。最常见的任何级别的不良事件是疲劳(11%)和恶心/呕吐(8%)。2例(6%)因毒性不耐受而停药。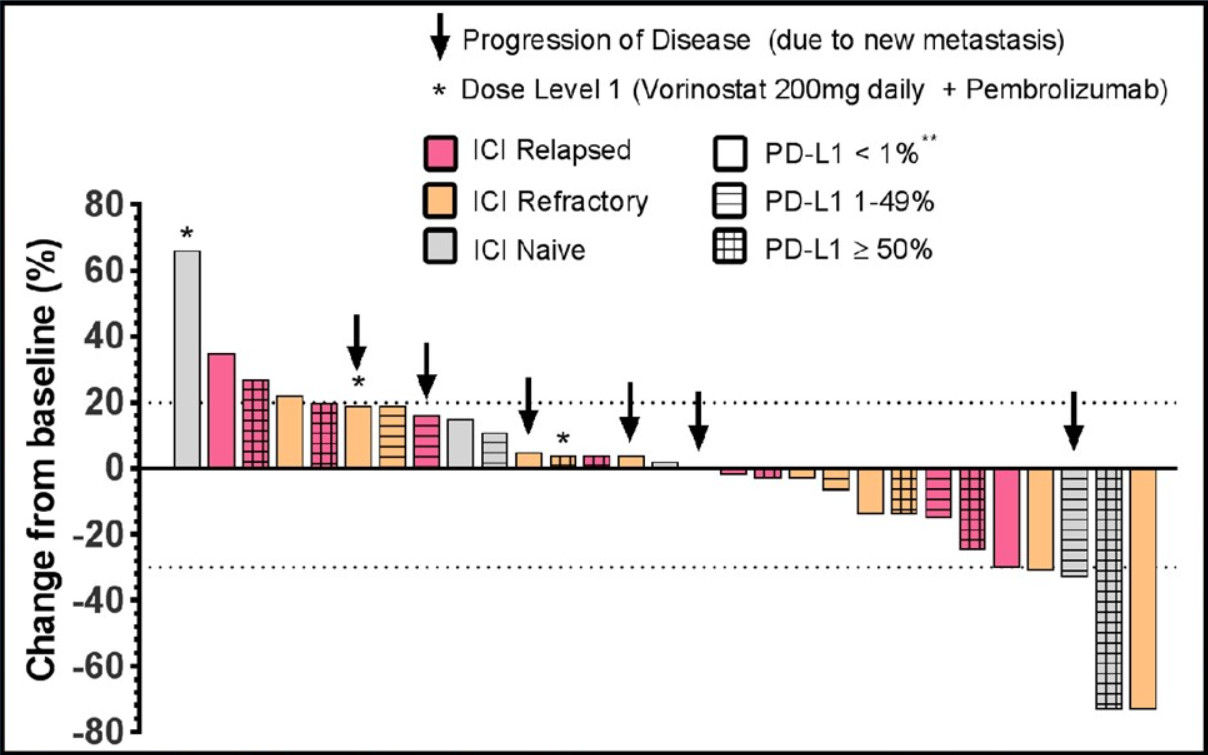
图11 不同亚组病情变化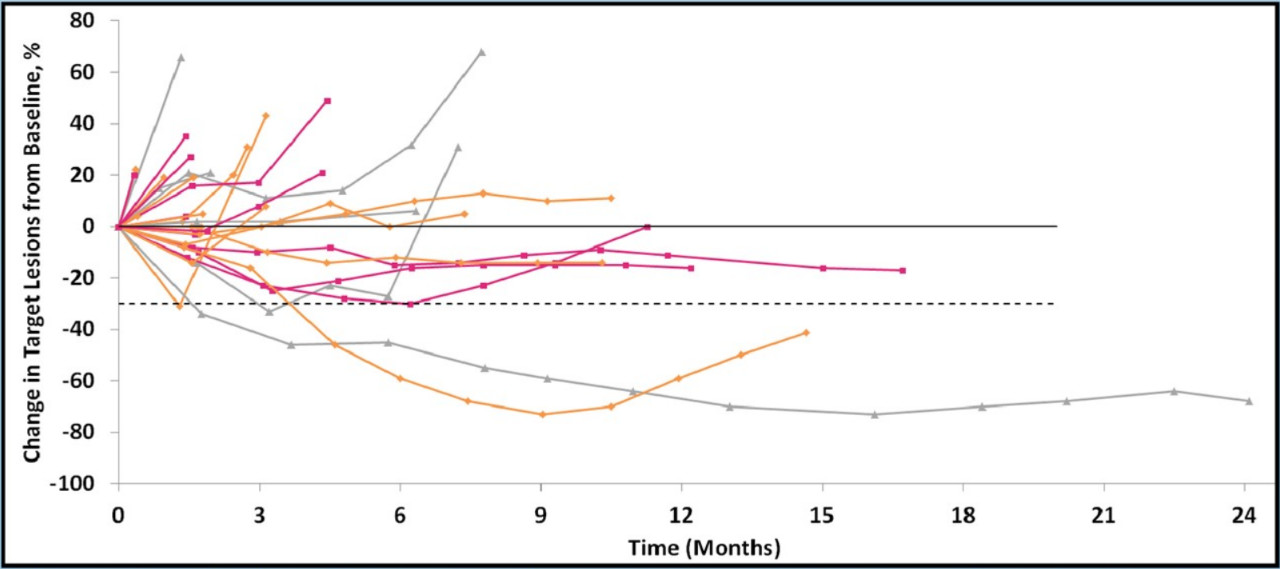
图12 靶病灶相对于基线的变化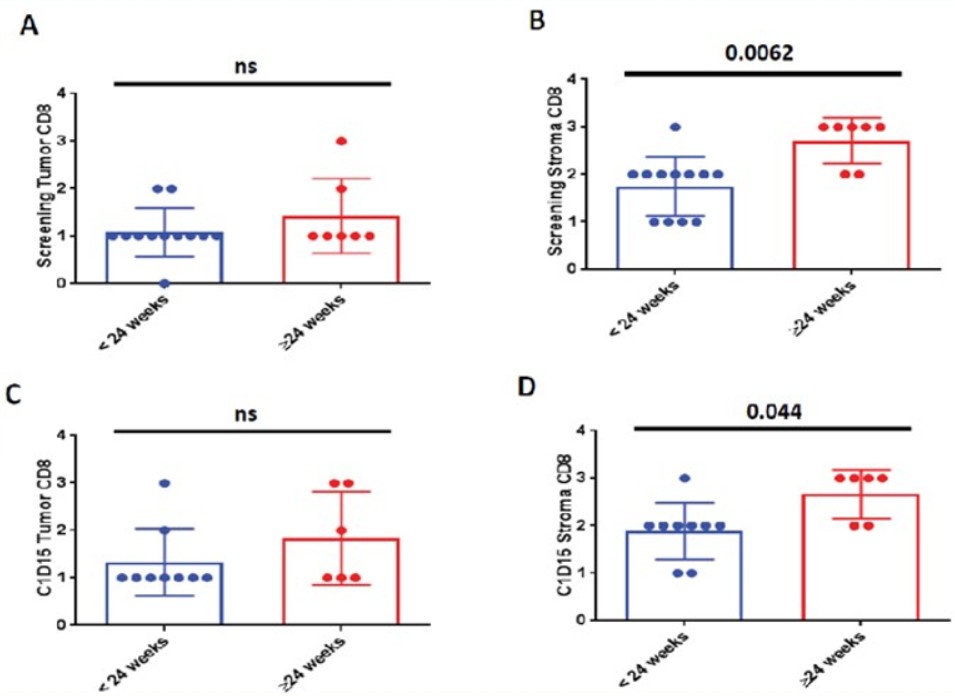
图13 肿瘤基质区域中CD8 +T细胞水平升高
30例患者可评估疗效,其中6例未接受过免疫治疗,24例为ICI耐药患者。4例(13%)达到PR,16例(53%)疾病稳定(SD),10例(33%)疾病进展(PD),DCR 67%。在ICI耐药的Ib队列中,3例为PR,10例为SD。ICI耐药患者的中位PFS为3.2个月,中位总生存期为7.3个月,1年无进展生存率为17%(4例)。而未接受过免疫治疗的患者中位PFS为7.6个月,中位OS为16个月。肿瘤基质区域中CD8 +T细胞的存在有利于Vorinostat联合帕博利珠单抗治疗。











 苏公网安备32059002004080号
苏公网安备32059002004080号


