审阅: 邓艳红 主任

2019年的美国临床肿瘤学会(ASCO)年会于5月31日~6月4日在美国芝加哥隆重召开。ASCO作为世界上规模最大、最具权威的临床肿瘤学会议,聚集了来自世界各地一流的肿瘤学专家,一起分享探讨当前国际最前沿的临床肿瘤学研究进展和成果。
6月1日下午是结直肠癌专场的口头报告,笔者仅对2019年ASCO局部进展期直肠癌的治疗进展进行总结介绍。

中山大学附属第六医院肿瘤内科主任
中国结直肠癌诊疗规范专家组成员
中国老年医学会肿瘤分会副会长
中国南方肿瘤临床研究协会 (CSWOG) 结直肠癌专业委员会副主委
中国南方肿瘤临床研究协会(CSWOG)青年委员会主委
中国抗癌协会大肠癌专业委员会青年委员会主委
中国医师协会结直肠肿瘤分会青年委员会副主委
中国抗癌协会整合肿瘤分会常委
中国抗癌协会精准治疗专业委员会常委
中国临床肿瘤协会青年委员会常委
广东省女医师协会消化肿瘤专业委员会主委
广州抗癌协会大肠癌转移委员会副主委
NRG-GI002研究:局部进展期直肠癌全新辅助治疗模式的II期临床研究--第一个研究组的初步结果
全程新辅助治疗(TNT)在局部进展期直肠癌将术后的辅助化疗前移,可避免术后患者因辅助依从性差,进而导致术后远处转移发生率高的问题;另外,TNT可以进一步提高病理完全缓解(pCR)率,对于需要行保肛手术采取等待观察策略的患者也是比较适宜的。在TNT的基础上,如何能进一步提高患者的生存获益?在前期的临床前研究中发现,放化疗联合PARP抑制剂对肿瘤细胞有协同致死效应,而且在前期的I期研究中,新辅助放化疗联合Veliparib的安全性耐受性已被证实。
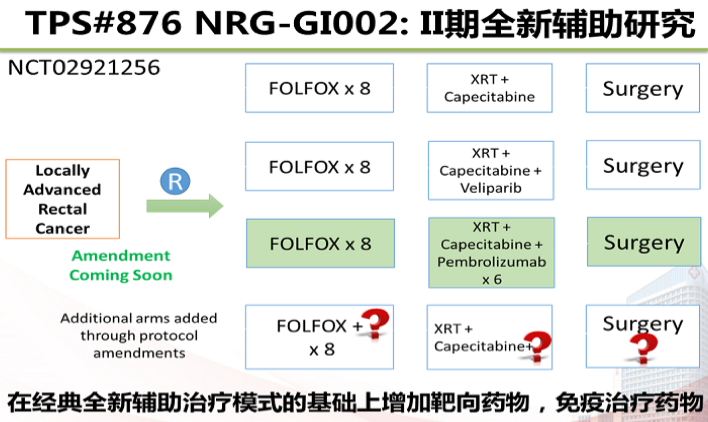 NRG-GI002研究是随机对照II期研究,对照组为TNT组,新辅助FOLFOX方案化疗4个月→随后进行放化疗(卡培他滨联合50.4Gy放疗)→放化疗后8~12周手术。试验组的队列第一组为同步放化疗联合PARP抑制剂Veliparib;另一组为同步放化疗联合PD-1单抗Pembrolizumab;后续可修正方案增加其他药物队列。
NRG-GI002研究是随机对照II期研究,对照组为TNT组,新辅助FOLFOX方案化疗4个月→随后进行放化疗(卡培他滨联合50.4Gy放疗)→放化疗后8~12周手术。试验组的队列第一组为同步放化疗联合PARP抑制剂Veliparib;另一组为同步放化疗联合PD-1单抗Pembrolizumab;后续可修正方案增加其他药物队列。
主要研究终点为NAR评分下降4分,次要研究终点:总生存期(OS),无病生存期(DFS),安全性,pCR,临床完全缓解(cCR),治疗完成率,阴性手术切缘和SSS比例。对照组pCR率为21.6%,Veliparib组pCR率为33.8%,虽然有提高,但差异无统计学意义。MSKCC的Timming研究中, CRT后增加6程FOLFOX巩固化疗,pCR率达到38%。而在GI002研究的对照组中,pCR率并未明显提高,一方面是纳入分期相对较晚的患者比例较多(纳入T4患者占30%,N2患者占40%~45%,60%~70%的患者为低位直肠癌);另一方面放疗结束至手术的间隔也不同。GI002研究的主要研究终点是阴性的,增加PARP抑制剂并未改善NAR评分(对照组vs. Veliparib组:12.6 vs. 13.7)。虽然NAR评分已在多项研究验证可作为DFS的替代终点,但最终DFS是否能提高,有待长期随访的结果。此外,GI002研究的另一个试验组是放疗联合Pembrolizumab,在同步放化疗的时候增加PD-1单抗,是否会进一步提高放疗敏感性,是否可以在放疗释放新生抗原的同时联合PD-1激活免疫应答,有待这一组结果的数据报道。
VOLTAGE研究:新辅助放化疗后序贯Nivolumab免疫治疗在MSS局部进展期直肠癌的疗效探索
免疫治疗在肺癌和黑色素瘤新辅助治疗领域疗效显著,在早期结肠癌,来自荷兰的NICHE研究,双抗联合(Ipilimumab+Nivolumab)的新辅助治疗策略在 dMMR结肠癌中显现出令人震惊的效果,7例dMMR患者均达到显著的病理缓解,其中4例患者达到病理完全缓解pCR,另外3例患者肿瘤残留1%~2%;但是在pMMR或MSS的结肠癌患者中,无论是晚期还是早期新辅助,免疫治疗均未显示出疗效。
如何令免疫治疗抵抗的MSS结肠癌能够对免疫治疗起效一直是当前结直肠癌免疫治疗领域的难题。联合治疗是潜在可行的方案,在动物实验中看到,放疗与PD-1联合有协同作用;放疗与免疫检查点抑制剂联合在其他瘤种中显示出可明显提高疗效,例如肺癌PACIFIC研究。
对于局部进展期直肠癌,当前的标准治疗仍是新辅助放化疗后手术,术后辅助化疗。通常认为,新辅助放疗后肿瘤会释放更多新抗原,改变免疫微环境,此时再使用PD-1单抗,是否会有更好的免疫应答,达到更好的疗效?Voltage研究也是基于这样的研究假设。
Voltage研究的主要研究终点是pCR,队列1纳入MSS的局部晚期直肠癌,研究假设pCR率能提高到30%,预计需要37例患者(检验效能90%,单侧α值 0.05);队列2为探索性,最多纳入5例MSI-H的患者。
研究纳入T3-4NanyM0的局部进展期直肠癌,新辅助放化疗后,接受5个疗程Nivolumab治疗(240mg Q2W),再行TME手术。该项研究达到了其主要研究终点,队列1中,MSS患者pCR率达到30%,另外3例患者TRG 1级,共14例(38%)的患者达到重大的病理缓解。另有1例患者达到cCR,等待观察未行手术。在队列2中,纳入2例MSI-H患者,均达到pCR。
在后续Biomarker分析中,根据治疗前组织检测,PD-L1大于1%的亚组,pCR率达到60%,而PD-L1阴性(<1%)的亚组,pCR率为19%。另外有23例患者有可获得的标本进行流式细胞分析,比较CD8+淋巴细胞与T调节细胞的比例(CD8/Treg),比例≥2时,pCR率62%(8/13),比例<2时,pCR率为10%(1/10)。
在既往研究中,局部进展期直肠癌氟尿嘧啶为基础的新辅助放化疗pCR率约为15%,前期多项联合奥沙利铂新辅助治疗的临床研究均未能提高pCR率,也未改善DFS。FOWARC研究中,mFOLFOX6联合放疗组的pCR率为28%,比标准治疗组提高了1倍,但是pCR率的提高并未转化为最终生存的获益。MSKCC的Timming研究是一项非随机对照研究,其中,在新辅助放化疗后加6程FOLFOX化疗的一组,pCR率达38%,对比标准治疗,DFS有所提高,但是,也并非pCR率最高的一组患者DFS的生存获益最大,而且,四组的OS也没有明显差异。
Voltage研究的设计中,在放疗结束后,接受5程Nivolumab治疗,放疗结束至手术的间隔大于10周,延长了放疗至手术的间期,这对pCR率的提高也潜在有一定的贡献。另外,Voltage研究达到30%的pCR率,与TNT的新辅助治疗策略相近,不同的是TNT的新辅助治疗策略将术后辅助化疗FOLFOX提到术前做,术后不再行辅助治疗;而Voltage研究术后仍推荐行FOLFOX辅助化疗。但最终免疫治疗新辅助能否改善生存,有待长期生存随访的结果。
在今年ASCO的TPS中,另有两项类似的直肠癌新辅助治疗的II期临床研究设计(TPS3620;TPS3622),一项是在新辅助放化疗后加4个疗程Durvalumab,主要研究终点为NAR的改善;另一项研究是在新辅助放化疗后加4个疗程Avelumab,主要研究终点是pCR率,有待这些研究进一步验证免疫治疗在直肠癌新辅助治疗中的作用。
CinClare研究:UGT1A1基因引导下卡培他滨±伊立替康用于直肠癌新辅助化放疗的随机对照多中心III期研究
在局部进展期直肠癌的新辅助治疗中,虽然放化疗降低了局部复发率,但仍有30%左右的患者出现远处转移。既往在放化疗期间增加奥沙利铂的相关临床研究结果一直不尽如人意,未能改善生存;而伊立替康由于其存在腹泻的风险,与放化疗的联合可能增加不良反应,因此,相关研究也较少。卡培他滨与伊立替康的联合在前期的临床研究中由于其毒副作用,一直是不被欧美国家指南推荐的组合。亚洲的AXEPT研究证明了FOLFIRI与mXELIRI在mCRC二线治疗的疗效相当,而且并未增加毒副反应,因此mXELIRI也已被列入CSCO指南。
从作用机制上,伊立替康与放疗存在协同作用,放疗杀灭G2/M期肿瘤细胞,导致S期阻滞,伊立替康是S期特异性杀伤。在新辅助放化疗期间增加伊立替康,同时根据UGT1A1状态调整伊立替康剂量,是否可改善局部进展期直肠癌预后,CinClare研究探讨了mXELIRI方案在直肠癌新辅助治疗的价值。
该研究的对照组(A组,N=180)接受IMRT放疗50 Gy/25 Fxs,同期联合卡培他滨825 mg/m2 bid d1-5qw,在CRT结束后两周进行一程XELOX化疗。试验组(B组,N=180)接受相同剂量的放疗,同期卡培他滨625 mg/ m2 bid d1-5qw,并联合伊立替康(UGT1A1*1*1患者80 mg/m2,UGT1A1*1*28患者65 mg/m2)。每周一次,在CRT结束后两周进行一程XELIRI化疗,主要研究终点为pCR。结果表明,两组pCR率分别为17.5%和30.8%,差异具有统计学意义。主要的毒副作用,3~4级白细胞减少(1.7% vs. 25.3%),腹泻(1.7%vs. 13.5%)在试验组均较高。在FOWARC研究中,FOLFOX联合放疗组的pCR率为27.5%,3~4级白细胞减少的发生率为19%,腹泻发生率14.5%,两者相近。根据UGT1A1分型,在基于卡培他滨的新辅助放化疗基础上引入伊立替康可显着提高肿瘤的完全缓解率。但治疗相关毒副反应发生率有所增加。但更重要的是,pCR率的提高最终能否转化为生存的获益,有待长期随访结果。目前并不推荐伊立替康用于术后辅助化疗,但对于mXELIRI新辅助治疗后,肿瘤退缩较好的患者,是应该“效不更方”继续伊立替康辅助化疗,还是更换奥沙利铂辅助化疗,更早地暴露三种药物?哪种策略对患者的生存获益更大,有待新的研究验证。











 苏公网安备32059002004080号
苏公网安备32059002004080号


